
- •1.Развитие представлений о развитии атома
- •2. Квантовые числа и двойственная природа электрона
- •3.Принцип заполнения электронных орбиталей в многоэлектронных атомах.
- •Очередность заполнения орбиталей:
- •4. Химическая связь: виды, причины, основные характеристики.
- •5.Ковалентная химическая связь. Метод валентных связей. Свойства ковалентной связи
- •Ковалентная связь. Метод молекулярных орбиталей. Свойства ковалентной связи
- •Ионная связь. Металлическая связь. Донорно-акцепторная связь.
- •8.Водородная связь. Межмолекулярные взаимодействия
- •9.Агрегатное состояние вещества
- •12.Атомные нарушения структуры кристаллов
- •14.Первое начало термодинамики
- •17.Энергия Гиббса, Гельмгольца. Критерии направленности химических процессов.
- •19.Химическое равновесие. Принцип Ле-Шателье.
- •20.Химическая кинетика. Основные понятия химической кинетики. Закон действующих масс. Молекурярность и порядок реакции
- •21.Факторы влияющие на скорость хим реакции.
- •22.Кинетические уравнения реакции первого второго и третьего порядка. Период полураспада.
- •23.Зависимость скорости химической реакции от температуры. Уравнение Аррениуса. Энергия активации
- •24.Скорость химической реакции в однородной среде. Константа скорости.
- •25.Каталитические процессы
- •Степень гидролиза
- •Вывод значения pH
- •Первый закон Рауля
- •Второй закон Рауля
- •Понижение температуры кристаллизации растворов
- •Повышение температуры кипения растворов
- •Криоскопическая и эбулиоскопическая константы
- •Растворы электролитов
- •Электролитическая диссоциация — процесс распада электролита на ионы при его растворении или плавлении Диссоциация в растворах
- •Диссоциация при плавлении
- •Классическая теория электролитической диссоциации
- •Слабые электролиты
- •Сильные электролиты
- •Диссоциация воды
- •Известные способы диссоциации воды:
- •Вывод уравнения Нернста
- •Устройство
- •Классификация электрохимических цепей.
Вывод уравнения Нернста
![]() ,
,
где
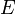 —
электродный
потенциал,
—
электродный
потенциал,  —
стандартный электродный потенциал,
измеряется в вольтах;
—
стандартный электродный потенциал,
измеряется в вольтах;— универсальная газовая постоянная, равная 8.31 Дж/(моль·K);
— абсолютная температура;
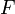 — постоянная
Фарадея,
равная 96485,35 Кл·моль−1;
— постоянная
Фарадея,
равная 96485,35 Кл·моль−1;— число моль электронов, участвующих в процессе;
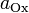 и
и 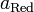 — активности соответственно окисленной
и восстановленной форм вещества,
участвующего в полуреакции.
— активности соответственно окисленной
и восстановленной форм вещества,
участвующего в полуреакции.
Если
в формулу Нернста подставить числовые
значения констант ![]() и
и ![]() и
перейти от натуральных
логарифмов к десятичным,
то при
и
перейти от натуральных
логарифмов к десятичным,
то при ![]() получим
получим
![]()
Стандартный водоро́дный электро́д — электрод, использующийся в качестве электрода сравнения при различных электрохимических измерениях и в гальванических элементах. Водородный электрод (ВЭ) представляет собой пластинку или проволоку из металла, хорошо поглощающего газообразный водород (обычно используют платину или палладий), насыщенную водородом (при атмосферном давлении) и погруженную в водный раствор, содержащий ионы водорода. Потенциал пластины зависит[уточнить] от концентрации ионов Н+ в растворе. Электрод является эталоном, относительно которого ведется отсчет электродного потенциала определяемой химической реакции. При давлении водорода 1 атм., концентрации протонов в растворе 1 моль/л и температуре 298 Кпотенциал ВЭ принимают равным 0 В. При сборке гальванического элемента из ВЭ и определяемого электрода, на поверхности платины обратимо протекает реакция:
2Н+ + 2e− = H2
то есть, происходит либо восстановление водорода, либо его окисление — это зависит от потенциала реакции, протекающей на определяемом электроде. Измеряя ЭДС гальванического электрода при стандартных условиях (см. выше) определяют стандартный электродный потенциал определяемой химической реакции.
ВЭ применяют для измерения стандартного электродного потенциала электрохимической реакции, для измерения концентрации (активности) водородных ионов, а также любых других ионов. Применяют ВЭ так же для определения произведения растворимости, для определения констант скорости некоторых электрохимических реакций.
Устройство
Схема стандартного водородного электрода:
Платиновый электрод.
Подводимый газообразный водород.
Раствор кислоты (обычно HCl), в котором концентрация H+ = 1 моль/л.
Водяной затвор, препятствующий попаданию кислорода воздуха.
Электролитический мост (состоящий из концентрированного р-ра KCl), позволяющий присоединить вторую половину гальванического элемента.
В электрохимии стандартный
электродный потенциал,
обозначаемый Eo,
E0,
или EO,
является мерой индивидуального потенциала
обратимого электрода (в равновесии)
в стандартном
состоянии,
которое осуществляется в растворах при
эффективной концентрации в 1 моль/кг и
в газах при давлении в 1 атмосферу или
100 кПа (кило Паскалей). Объёмы чаще всего
взяты при 25 °C. Основой для
электрохимической
ячейки,
такой как гальваническая
ячейка всегда
является окислительно-восстановительная
реакция,
которая может быть разбита на две полу
реакции: окисление на
аноде (потеря электрона) и восстановление на
катоде (приобретение
электрона). Электричество вырабатывается
вследствие различия электростатического
потенциала двух
электродов. Эта разность потенциалов
создаётся в результате различий
индивидуальных потенциалов двух
металлов электродов по
отношению к электролиту.
Электрохимический ряд активности (ряд напряжений, ряд стандартных электродных потенциалов) металлов — последовательность, в которой металлы расположены в порядке увеличения их стандартных электрохимических потенциалов φ0, отвечающих полу реакции восстановления катиона металла Men+: Men+ + nē → Me.
Билет 34. Гальванический элемент. Устройство, принцип работы. Классификация электрохимических цепей
Гальванический элемент - это источник электричества, который основан на химическом взаимодействии некоторых веществ между собой. Он был впервые придуман известным учёным Алессандро Вольта. И так давайте посмотрим, как же на самом деле всё происходит, и разберём устройство батарейки.
Представим, у нас есть стеклянный сосуд, а в него налита серная кислота и опущен цинковый стержень. Поскольку на поверхности пластины находятся положительно заряженные атомы цинка, то в растворе вокруг стержня собираются отрицательные ионы раствора, а положительные ионы раствора выталкиваются в не эту область. Притяжение раствора отрывает ионы цинка, и они становятся уже частью этого раствора. В результате цинковый стержень становится отрицательно заряженным, а раствор положительно. Вот и получили разность потенциалов. И так что получается? При соприкосновении металла и раствора на границе возникает электрическое поле. В момент образования этого поля и происходит непосредственно само превращение химической энергии в электрическую.Что даёт нам возможность её использовать.
Теперь вернёмся к понятию гальванический элемент и устройство батарейки. Мы выяснили, что для преобразования химической энергии в электрическую, необходимо наличие двух разнородных проводника с электронной проводимостью и раствор с ионной проводимостью.
Элемент Вольта состоит из двух разных пластин меди и цинка, опущенных в слабый раствор серной кислоты. Медная пластина становится плюсом, а цинковая, минусом, с разность потенциала этого элемента в 1 вольт. Нужно заметить, что это вырабатываемое в итоге ЭДС, полностью зависит только от материала и от самих химических процессов внутри.
Подсоединив гальванический элемент к обычной лампочке, мы увидим что внутри электроны с цинка начнут переходить на медь, тем самым нарушая равновесие. В итоге на медной пластине начнет, выделятся газообразный водород. Это образование газа весьма негативно влияет на дальнейшую работу элемента, не давая ионам водорода заряжаться, поскольку собой они делают барьер между границей меди и раствора. И это поляризация.
Для борьбы с этим недостатком было придумано иное устройство батарейки. Он получил название - элемент Лекланше. В сосуде с раствором нашатыря, разбавленного водой помещены цинковый стержень и графитовый, для борьбы с поляризацией, графитовый стержень вокруг себя имеет слой двуокиси марганца, назначение которого сводится как раз для поглощения нежелательного газа.
Таким образом гальванический элемент становится намного эффективнее. Именно на таком принципе и делаются большинство батареек, которыми мы с Вами пользуемся. Разница заключается в том, что в различных видах производимых батареек, отличие только в используемых веществах и материалах. Кстати именно эта разница и даёт определённые параметры и характеристики гальваническим элементам. Например, одни могут терять свой заряд постепенно и при этом ЭДС, так же будет, понижаться, а другие батарейки более равномерно отдают энергию и лишь в конце резко теряют заряд.
В настоящее время существует множество различных типов гальванических элементов, к примеру: Марганцево - цинковый, Марганцево - оловянный, Марганцево - магниевый, Свинцово - цинковый, Свинцово - кадмиевый, Свинцово - хлорный, Хром - цинковый, Окисно - ртутно-оловянный, Ртутно - цинковый, Ртутно - кадмиевый и т.д. Кроме внутреннего состава, батарейки также отличаются размерам и, следовательно, ёмкостью заряда.
озникновение электрохимии связано с именем итальянского врача Л. Гальвани, который в 1790 г., изучая препарированную лягушку, соорудил устройство, состоявшее из мышц лягушки и двух разных металлов. Это устройство получило в дальнейшем название "гальванический элемент". В 1800 г. итальянский физик А. Вольта сконструировал первый химический источник электрической энергии - батарею гальванических элементов из медных и цинковых дисков, разделенных прокладками, смоченными кислотой. Благодаря этому изобретению химики получили удобный источник электрической энергии. Годом позднее русский физик В.В. Петров создал батарею большой мощности, с помощью которой впервые получил некоторые металлы (свинец, олово, ртуть).
Большую роль в развитии электрохимии сыграли открытие М. Фарадеем количественных законов электрохимии, создание С. Аррениусом теории ЭДС, В. Нернстом - теории гальванических элементов.
Основным объектом изучения раздела химической науки - электрохимии - являются электрохимические реакции, т.е. химические реакции, протекающие под влиянием электрического тока, и процессы генерирования электрической энергии, происходящие в результате протекания химических реакций. Электрохимическая реакция - это разновидность окислительно - восстановительных реакций, особенность которой состоит в том, что в результате такой реакции может происходить как превращение химической энергии в электрическую, так и превращение электрической энергии в химическую. Эти превращения осуществляются в электрохимических системах, которые в зависимости от направления перехода форм энергии делят на два типа:
1) электрическая энергия переходит в химическую (под действием электрического тока происходят химические реакции) - процессы электролиза;
2) химическая энергия переходит в электрическую (в результате протекания химических реакций возникает электрический ток) - гальванические элементы, аккумуляторы.
Электрохимическая система состоит из двух частей: электрода и электролита.
Электрод - двухфазное устройство, в котором одной фазой чаще всего является металл или полупроводник, другая фаза - раствор или расплав электролита.
Если погрузить металлическую пластинку в воду или другой полярный растворитель, на металле возникает отрицательный заряд, а в растворе - положительный, т. е. возникает разность потенциалов на границе металл - раствор. Появление этой разности потенциалов при погружении металла в воду объясняется следующим образом. Все металлы имеют кристаллическую решетку, в узлах которой находятся ион-атомы с обобществленными валентными электронами. Полярные молекулы воды, ориентируясь одним из своих полюсов на поверхность металла, адсорбируются на ней и взаимодействуют с ион-атомами металла. Такое взаимодействие может привести к выходу ион-атома из кристаллической решетки в раствор в виде гидратированного катиона. В кристаллической решетке металла после ухода иона остаются его валентные электроны n , придающие металлу отрицательный заряд.
