
- •Предмет химической термодинамики. Термодинамические системы, виды термодинамических систем, параметры состояния, параметры процесса
- •Первый закон термодинамики. Функции состояния системы и их свойства.
- •Закон Гесса. Следствия из закона Гесса. Тепловые эффекты химических процессов и методы их вычисления. Стандартные энтальпии образования и сгорания веществ.
- •4. Предмет химической кинетики. Скорость химических реакций и факторы ее определяющие. Закон действия масс.
- •5. Влияние температуры на скорость химической реакции:
- •6. Понятия о катализе, катализаторах и ингибиторах. Природа
- •7. Практическое использование гетерогенного катализа на примере производства аммиака или серной кислоты.
- •8. Биологические катализаторы и их особенности. Явление комплементарности.
- •9. Колебательные реакции. Реакция Белоусова-Жаботинского.
- •10. Фазовое равновесие. Правило фаз.
- •Уравнение Гиббса
- •11. Понятия об обратимых и необратимых химических процессах, химическом равновесии. Константа равновесия и ее вычисление.
- •12. Принцип Ле Шателье и его использование для управления химико-технологическими процессами.
- •13. Основные законы стехиометрии. Атомные и молекулярные массы, количество вещества, молярная масса и молярный объем, плотность одного газа по отношению к другому, парциальное давление газа.
- •1. Закон сохранения массы веществ:
- •14. Материальный баланс химического процесса. Понятие о выходе.
- •15. Химический эквивалент. Количество вещества эквивалентов, число эквивалентности для различных типов реакций. Закон эквивалентов.
- •16. Периодический закон Менделеева, историческая и современная формулировка. Физический смысл порядкового номера элемента. Явление периодичности и электронная структура атомов
- •17. Квантовые числа и порядок заполнения энергетических уровней и орбиталей в атомах. Правила Клечковского
- •1. Принцип Паули
- •3. Принцип минимума энергии (Правила в.М. Клечковского, 1954)
- •18. Методы моделирования химических связей: метод валентных связей и метод молекулярных орбиталей.
- •19. Количественная оценка полярности связи и полярности молекулы.
- •20. Растворы и их природа. Способы выражения состава растворов (молярная концентрация, массовая доля растворенного вещества).
- •21. Растворы неэлектролитов и их свойства. Закон Генри.
- •22. Законы Рауля. Вычисление температур кипения и замерзания растворов.
- •Повышение температуры кипения растворов
- •23. Осмос. Роль осмоса в природе и технике. Вычисление осмотического давления.
- •24. Теория электролитической диссоциации. Изотонический коэффициент, степень диссоциации, константа диссоциации электролита.
- •2 Ch3cooh ↔ (ch3cooh)2
- •25. Вода как растворитель. Использование воды в технологических процессах. Процесс водоподготовки.
- •26. Ионное произведение воды, водородный показатель. Регулирование водородного показателя в технологических процессах.
- •27. Произведение растворимости. Управление растворимостью веществ.
- •28. Дисперсные системы. Строение, классификация, молекулярно-кинетические и оптические свойства дисперсных систем.
- •29. Строение мицелл золя. Электрокинетические явления (электрофорез и электроосмос) и их практическое использование.
- •30. Агрегативная устойчивость и коагуляция дисперсных систем. Методы разрушения дисперсных систем.
- •31. Методы формообразования, основанные на использовании свойств дисперсных систем.
- •32. Виды адсорбции и их использование в технологических процессах. Использование адсорбции в водоподготовке.
- •33. Эффект адсорбционного понижения прочности и облегчения деформации твердых тел (эффект Ребиндера).
- •34. Электрохимические системы. Межфазный скачек потенциала. Стандартные электродные потенциалы и их измерение.
- •35. Электрохимический ряд напряжений. Уравнение Нернста.
- •36. Гальванические элементы. Вычисление эдс. Современные химические источники тока.
- •37. Электролиз. Количественные расчеты с использованием законов Фарадея.
- •38. Гальванопластика и гальваностегия как примеры технического использования электролиза.
- •39. Коррозия металлов и ее типы. Механизм электрохимической коррозии и методы борьбы с ней.
- •40. Полимеры и олигомеры. Зависимость свойств полимерных материалов от состава и структуры. Использование полимерных материалов в современных технологических процессах. Переработка полимеров.
- •41. Качественный и количественный анализ. Аналитический сигнал. Их роль в технологических процессах.
- •42. Физико-химический анализ. Физический анализ. Их роль в технологических процессах.
31. Методы формообразования, основанные на использовании свойств дисперсных систем.
32. Виды адсорбции и их использование в технологических процессах. Использование адсорбции в водоподготовке.
Адсорбция
Адсорбция – накопление молекул на поверхности раздела фаз. Физическая адсорбция происходит под действием сил Ван-дер-Ваальса. Химическая адсорбция (хемосорбция) происходит вследствие образования химических связей между адсорбируемыми молекулами и поверхностью
33. Эффект адсорбционного понижения прочности и облегчения деформации твердых тел (эффект Ребиндера).
Петр Александрович Ребиндер (1898-1972) в 20-х годах прошлого века обнаружил, что так называемые адсорбционно-активные вещества способны адсорбироваться на поверхности твердых тел и резко снижать их поверхностностное натяжение. При этом снижается работа диспергирования, следовательно тела измельчаются легче.
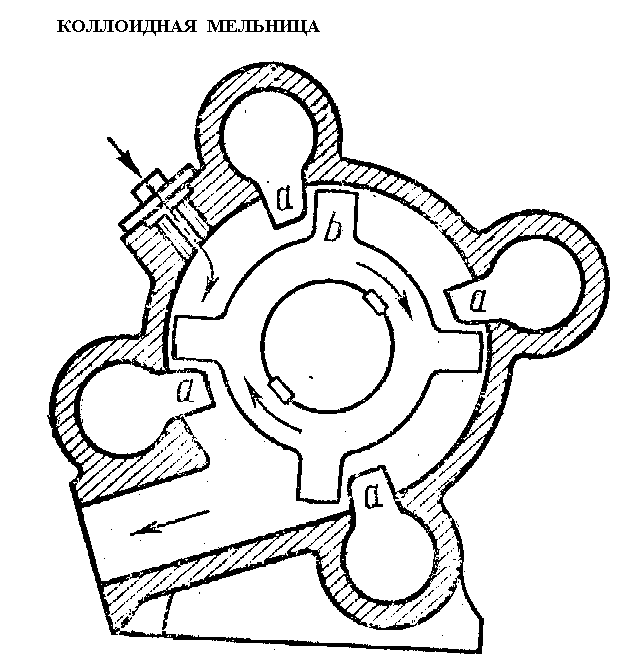
Рис. 11. Коллоидная мельница для получения частиц дисперсной фазы путем механического диспергирования
Эффект Ребиндера
34. Электрохимические системы. Межфазный скачек потенциала. Стандартные электродные потенциалы и их измерение.
Электрохимией называется раздел физической химии, посвященный изучению связей между химическими и электрическими явлениями.
П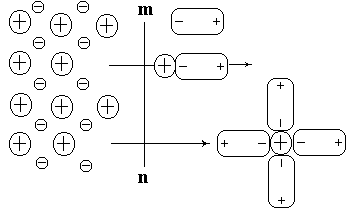 ростейшая
электрохимическая система возникает,
если в чистую воду
ростейшая
электрохимическая система возникает,
если в чистую воду
При погружении пластинки металла в воду расположенные на поверхности катионы кристаллической решетки будут гидратироваться молекулами воды и частично переходить в окружающий раствор. В результате прилегающий к электроду раствор будет заряжаться положительно, а сам металл отрицательно. Между положительно заряженными катионами, перешедшими в раствор, и отрицательно заряженной поверхностью металла возникают силы электростатического притяжения. Поэтому катионы металла не уходят в глубь раствора, а удерживаются вблизи поверхности раздела металл-электролит, образуя обкладку двойного электрический слоя. Причем наряду с выходом ионов металлов в раствор идет и процесс их возвращения из раствора на поверхность металла.
Таким образом, при соприкосновении пластинки металла с водой ионы металла находятся под действием противоположно направленных сил и через некоторое время устанавливается равновесие между двумя процессами:
Me ↔ Men+ + nē
Образующаяся при этом пограничная разность потенциалов (скачек потенциала) получила название электродного потенциала.
Значение возникающего электродного потенциала зависит:
1. От природы металла;
2. От концентрации ионов металла в растворе;
3. От температуры.
Э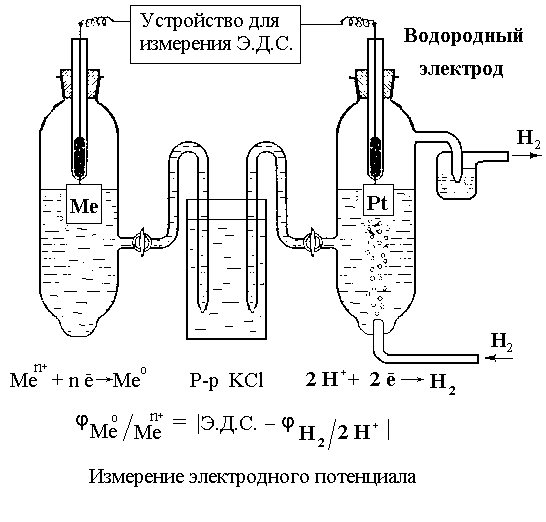 лектродные
потенциалы, измеренные по отношению к
водородному электроду в стандартных
условиях, называются стандартными. При
измерении стандартного электродного
потенциала какого-либо металла
составляется электрическая цепь из
стандартного водородного электрода и
исследуемого металлического электрода
(рис. 17).
лектродные
потенциалы, измеренные по отношению к
водородному электроду в стандартных
условиях, называются стандартными. При
измерении стандартного электродного
потенциала какого-либо металла
составляется электрическая цепь из
стандартного водородного электрода и
исследуемого металлического электрода
(рис. 17).
Исследуемый электрод погружают в раствор его соли с концентрацией ионов металла, равной 1 моль/л. Для обеспечения электрического контакта между электродами помещается соединительный сосуд, который заполняют насыщенным раствором хлорида калия (у него одинаковая подвижность катионов и анионов).
Если расположить металлы в ряд в порядке возрастания величин их стандартных электродных потенциалов, то мы получим ряд напряжений металлов.
