
- •2)Идеальный газ. Параметры состояния. Уравнение состояния идеального газа.
- •3) Изопроцессы. Газовые законы. Графическое изображение изопроцессов.
- •4)Основное уравнение молекулярно-кинетической теории идеального газа.
- •5)Понятие о температуре. Эмпирическая и термодинамическая температуры. Молекулярно-кинетическое толкование абсолютной температуры.
- •10)Количество теплоты. Способы теплопередачи. Теплоемкость.
- •11)Количество степеней свободы молекул. Теорема Больцмана о равномерном распределении энергии по степеням свободы.
- •12)Понятие о внутренней энергии. Внутренняя энергия идеального газа.
- •13)Работа в термодинамике. Графический смысл работы.
- •14)Первое начало термодинамики. Его физический смысл.
- •15)Применение первого начала термодинамики к изопроцессам.
- •16)Адиабатический процесс. Уравнение Пуассона.
- •Адиабата Пуассона
- •19)Обратимые и необратимые процессы.
- •20)Макро- и микросостояния термодинамической системы. Термодинамическая вероятность состояния.
- •21)Энтропия как мера термодинамической вероятности состояния. Закон возрастания энтропии.
- •23)Второе начало термодинамики.
- •25) Цикл Карно́ и его кпд
- •26)Реальные газы. Отличие реальных газов от идеального. Уравнение Ван-Дер-Ваальса.
- •27)Изотермы Ван-Дер-Вальса и их сравнение с эмпирическими изотермами. Критическая точка.
- •28) Внутренняя энергия реального газа
- •29)Особенности жидкого состояния. Поверхностное натяжение. Коэффициент поверхностного натяжения.
- •30)Добавочное давление под искривлённой поверхностью жидкости. Формула Лапласа.
- •Формула Лапласа
25) Цикл Карно́ и его кпд
Цикл Карно — идеальный термодинамический цикл. Тепловая машина Карно, работающая по этому циклу, обладает максимальным КПД из всех машин, у которых максимальная и минимальная температуры осуществляемого цикла совпадают соответственно с максимальной и минимальной температурами цикла Карно. Состоит из 2 адиабатических и 2изотермических процессов.
Одним из важных свойств цикла Карно является его обратимость: он может быть проведён как в прямом, так и в обратном направлении, при этом энтропия адиабатически изолированной (без теплообмена с окружающей средой) системы не меняется.
КПД цикла Карно:
Количество теплоты, полученное рабочим телом от нагревателя при изотермическом расширении, равно
![]() .
.
Аналогично, при изотермическом сжатии рабочее тело отдало холодильнику
![]() .
.
Отсюда коэффициент полезного действия тепловой машины Карно равен
![]() .
.
Из последнего выражения видно, что КПД тепловой машины Карно зависит только от температур нагревателя и холодильника. Кроме того, из него следует, что КПД может составлять 100 % только в том случае, если температура холодильника равна абсолютному нулю.
26)Реальные газы. Отличие реальных газов от идеального. Уравнение Ван-Дер-Ваальса.
Реальный газ — газ, который не описывается уравнением состояния идеального газа Клапейрона — Менделеева.
Зависимости между его параметрами показывают, что молекулы в реальном газе взаимодействуют между собой и занимают определенный объём. Состояние реального газа часто на практике описывается обобщённым уравнением Менделеева — Клапейрона:
![]()
где p — давление; V - объем T — температура; Zr = Zr (p,T) — коэффициент сжимаемости газа; m - масса; М — молярная масса; R — газовая постоянная.
Отличие реальных газов от идеального:
Молекулы идеального газа не сталкиваются друг с другом, а в реальном газе они движутся сталкиваясь. Идеальный газ поэтому легче рассчитывать. Но в реале идеального газа не существует.
Уравнение Ван-дер-Ваальса — уравнение, связывающее основные термодинамические величины в модели газа Ван-дер-Ваальса.
Для
более точного описания поведения
реальных газов при низких температурах
была создана модель газа Ван-дер-Ваальса,
учитывающая силы межмолекулярного
взаимодействия. В этой модели внутренняя
энергия ![]() становится
функцией не только температуры,
но и объёма.
становится
функцией не только температуры,
но и объёма.
Для одного моля газа Ван-дер-Ваальса оно имеет вид:
![]()
где
— давление,
— молярный объём,
— абсолютная температура,
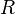 — универсальная
газовая постоянная.
— универсальная
газовая постоянная.
Видно, что это
уравнение фактически является уравнением
состояния идеального газа с
двумя поправками. Поправка ![]() учитывает
силы притяжения между молекулами
(давление на стенку уменьшается, так
как есть силы, втягивающие молекулы
приграничного слоя внутрь), поправка
учитывает
силы притяжения между молекулами
(давление на стенку уменьшается, так
как есть силы, втягивающие молекулы
приграничного слоя внутрь), поправка ![]() —
объем молекул газа.
—
объем молекул газа.
Для ![]() молей
газа Ван-дер-Ваальса уравнение состояния
выглядит так:
молей
газа Ван-дер-Ваальса уравнение состояния
выглядит так:
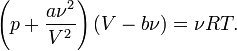
где
— объём,
27)Изотермы Ван-Дер-Вальса и их сравнение с эмпирическими изотермами. Критическая точка.
Изотермы Ван-дер-Ваальса — кривые зависимости р от Vm при заданных Т, определяемые уравнением Ван-дер-Ваальс для моля газа. Эти кривые рассматриваются для четырех различных температур; имеют довольно своеобразный характер. При высоких температурах (T > Tк) изотерма реального газа отличается от изотермы идеального газа только некоторым искажением ее формы, оставаясь монотонно спадающей кривой. При некоторой температуре Tк на изотерме имеется лишь одна точка перегиба К.
Эта изотерма называется критической, соответствующая ей температура Tк — критической температурой; точка перегиба К называется критической точкой; в этой точке касательная к ней параллельна оси абсцисс. Соответствующие этой точке объем Vк, и давление рк называются также критическими. Состояние с критическими параметрами (pк, Vк, Tк) называется критическим состоянием. При низких температурах (Т < Tк ) изотермы имеют волнообразный участок, сначала монотонно опускаясь вниз, затем монотонно поднимаясь вверх и снова монотонно опускаясь.
Проанализируем изотермы уравнения Ван–дер–Ваальса – зависимости Р от V для реального газа при постоянной температуре. Умножив уравнение Ван-дер-Ваальса на V 2 и раскрыв скобки, получаем
PV 3 – (RT + bP) vV 2 + av2V - abv3 = 0.
Поскольку данное уравнение имеет третью степень относительно V, а коэффициенты при V действительны, то оно имеет либо один, либо три вещественных корня, т.е. изобара Р = const пересекает кривую Р = Р(V) в одной или трех точках, как это изображено на рисунке 7.4. Причем с повышением температуры мы перейдем от немонотонной зависимости Р = Р(V) к монотонной однозначной функции. Изотерма при Ткр, которая разделяет немонотонные T < Tкр и монотонные T > Ткр изотермы, соответствует изотерме при критической температуре. При температуре выше критической зависимость Р = Р(V) является однозначной монотонной функцией объема. Это означает, что при T > Ткр вещество находится только в одном, газообразном состоянии, как это имело место у идеального газа. При температуре газа ниже критической такая однозначность исчезает, а это означает возможность перехода вещества из газообразного в жидкое и наоборот. На участке АСВ изотермы Т1 давление растет с увеличением объема (dP/dV) > 0. Данное состояние неустойчиво, поскольку здесь должны усиливаться малейшие флуктуации плотности. Поэтому область ВСА не может устойчиво существовать. В областях DLB и AGE давление падает с увеличением объема (dP/dV)Т < 0 – это необходимое, но не достаточное условие устойчивого равновесия. Эксперимент показывает, что система переходит из области устойчивых состояний GE (газ) в область устойчивых состояний LD(жидкость) через двухфазное состояние (газ – жидкость) GL вдоль горизонтальной изотермы GCL.
При квазистатическом сжатии, начиная с точки G, система распадается на 2 фазы – жидкость и газ, причем плотности жидкости и газа остаются при сжатии неизменными и равными их значениям в точках L и G соответственно. При сжатии количество вещества в газообразной фазе непрерывно уменьшается, а в жидкой фазе – увеличивается, пока не будет достигнута точка L, в которой все вещество перейдет в жидкое состояние.
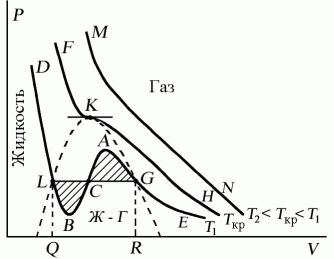 Рис.
7.4
Рис.
7.4
Наличие критической точки на изотерме Ван–дер–Ваальса означает, что для каждой жидкости существует такая температура, выше которой вещество может существовать только в газообразном состоянии
Критическую точку K мы определили как точку перегиба критической изотермы, в которой касательная к изотерме горизонтальна (рис. 7.5). Ее можно определить также как точку, в которую в пределе переходят горизонтальные участки изотерм при повышении температуры до критической. На этом основан способ определения критических параметров Pk, Vk, Тk, принадлежащий Эндрюсу. Строится система изотерм при различных температурах. Предельная изотерма, у которой горизонтальный участок LG (рис. 7.4) переходит в точку, будет критической изотермой, а указанная точка – критической точкой (рис. 7.5).
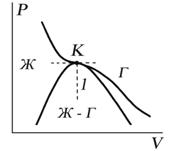 Рис.
7.5
Рис.
7.5
Недостаток способа Эндрюса заключается в его громоздкости.
