
- •2)Идеальный газ. Параметры состояния. Уравнение состояния идеального газа.
- •3) Изопроцессы. Газовые законы. Графическое изображение изопроцессов.
- •4)Основное уравнение молекулярно-кинетической теории идеального газа.
- •5)Понятие о температуре. Эмпирическая и термодинамическая температуры. Молекулярно-кинетическое толкование абсолютной температуры.
- •10)Количество теплоты. Способы теплопередачи. Теплоемкость.
- •11)Количество степеней свободы молекул. Теорема Больцмана о равномерном распределении энергии по степеням свободы.
- •12)Понятие о внутренней энергии. Внутренняя энергия идеального газа.
- •13)Работа в термодинамике. Графический смысл работы.
- •14)Первое начало термодинамики. Его физический смысл.
- •15)Применение первого начала термодинамики к изопроцессам.
- •16)Адиабатический процесс. Уравнение Пуассона.
- •Адиабата Пуассона
- •19)Обратимые и необратимые процессы.
- •20)Макро- и микросостояния термодинамической системы. Термодинамическая вероятность состояния.
- •21)Энтропия как мера термодинамической вероятности состояния. Закон возрастания энтропии.
- •23)Второе начало термодинамики.
- •25) Цикл Карно́ и его кпд
- •26)Реальные газы. Отличие реальных газов от идеального. Уравнение Ван-Дер-Ваальса.
- •27)Изотермы Ван-Дер-Вальса и их сравнение с эмпирическими изотермами. Критическая точка.
- •28) Внутренняя энергия реального газа
- •29)Особенности жидкого состояния. Поверхностное натяжение. Коэффициент поверхностного натяжения.
- •30)Добавочное давление под искривлённой поверхностью жидкости. Формула Лапласа.
- •Формула Лапласа
14)Первое начало термодинамики. Его физический смысл.
Первое начало термодинамики — один из трёх основных законов термодинамики, представляет собой закон сохранения энергии длятермодинамических систем.
Существует несколько эквивалентных формулировок первого начала термодинамики
В любой изолированной системе запас энергии остаётся постоянным.[2] Это — формулировка Дж. П. Джоуля (1842 г.).
Количество теплоты, полученное системой, идёт на изменение её внутренней энергии и совершение работы против внешних сил
Изменение внутренней энергии системы при переходе её из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе, то есть, оно зависит только от начального и конечного состояния системы и не зависит от способа, которым осуществляется этот переход. Это определение особенно важно для химической термодинамики[2] (ввиду сложности рассматриваемых процессов). Иными словами, внутренняя энергия является функцией состояния. В циклическом процессе внутренняя энергия не изменяется.
![]()
Изменение полной
энергии системы в квазистатическом
процессе равно
количеству теплоты ![]() ,
сообщённому системе, в сумме с изменением
энергии, связанной с количеством
вещества
,
сообщённому системе, в сумме с изменением
энергии, связанной с количеством
вещества ![]() при химическом
потенциале
при химическом
потенциале ![]() ,
и работы
,
и работы ![]() [3],
совершённой над системой внешними
силами и полями,
за вычетом работы
[3],
совершённой над системой внешними
силами и полями,
за вычетом работы ![]() ,
совершённой самой системой против
внешних сил
,
совершённой самой системой против
внешних сил
![]() .
.
Для элементарного
количества теплоты ![]() ,
элементарной работы
,
элементарной работы ![]() и
малого приращения
и
малого приращения ![]() внутренней
энергии первый закон термодинамики
имеет вид:
внутренней
энергии первый закон термодинамики
имеет вид:
![]() .
.
Разделение работы на две части, одна из которых описывает работу, совершённую над системой, а вторая — работу, совершённую самой системой, подчёркивает, что эти работы могут быть совершены силами разной природы вследствие разных источников сил.
Важно заметить,
что
и ![]() являются полными
дифференциалами,
а
и
—
нет.
являются полными
дифференциалами,
а
и
—
нет.
15)Применение первого начала термодинамики к изопроцессам.
Среди
равновесных процессов, которые происходят
с термодинамическими системами, отдельно
рассматриваются изопроцессы, при которых
один из основных параметров состояния
остается постоянным.
Изохорный
процесс (V=const).
Диаграмма этого процесса (изохора)
в координатах р, V изображается прямой,
параллельной оси ординат (рис. 1), где
процесс 1—2 есть изохорное нагревание,
а 1—3 — изохорное охлаждение. При
изохорном процессе газ не совершает
работы над внешними телами, т. е.
![]() Из
первого начала термодинамики (δQ=dU+δA)
для изохорного процесса следует, что
вся теплота, которая сообщается газу,
идет на увеличение его внутренней
энергии:
Из
первого начала термодинамики (δQ=dU+δA)
для изохорного процесса следует, что
вся теплота, которая сообщается газу,
идет на увеличение его внутренней
энергии:
![]() т.к.
CV=dUm/dt,
Тогда
для произвольной массы газа
получим
т.к.
CV=dUm/dt,
Тогда
для произвольной массы газа
получим
![]() (1)
Изобарный
процесс (p=const).
Диаграмма этого процесса (изобара)
в координатах р, V изображается прямой,
которая параллельна оси V. При изобарном
процессе работа газа при увеличения
объема от V1 до
V2 равна
(2)
и
равна площади заштрихованного
прямоугольника (рис. 2). Если использовать
уравнение Менделеева-Клапейрона для
выбранных нами двух состояний,
то
и
(1)
Изобарный
процесс (p=const).
Диаграмма этого процесса (изобара)
в координатах р, V изображается прямой,
которая параллельна оси V. При изобарном
процессе работа газа при увеличения
объема от V1 до
V2 равна
(2)
и
равна площади заштрихованного
прямоугольника (рис. 2). Если использовать
уравнение Менделеева-Клапейрона для
выбранных нами двух состояний,
то
и ![]() откуда
откуда
![]() Тогда
выражение (2) для работы изобарного
расширения примет вид
Тогда
выражение (2) для работы изобарного
расширения примет вид
![]() (3)
Из
этого выражения вытекает физический
смысл молярной газовой постоянной R:
если T2 —T1 =
1К, то для 1 моль газа R=A, т. е. R численно
равна работе изобарного расширения 1
моль идеального газа при нагревании
его на 1 К.
(3)
Из
этого выражения вытекает физический
смысл молярной газовой постоянной R:
если T2 —T1 =
1К, то для 1 моль газа R=A, т. е. R численно
равна работе изобарного расширения 1
моль идеального газа при нагревании
его на 1 К.
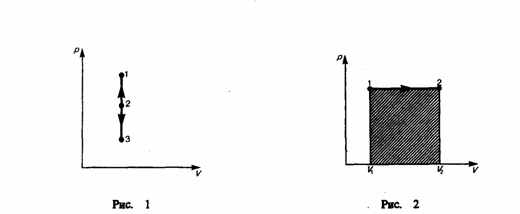
Рис.1
В
изобарном процессе при сообщении газу
массой m количества теплоты
![]() его
внутренняя энергия возрастает на
величину (т.к. CV=dUm/dt)
его
внутренняя энергия возрастает на
величину (т.к. CV=dUm/dt)
![]() При
этом газ совершит работу, определяемую
выражением (3).
Изотермический
процесс (T=const).
Изотермический процесс описывается
законом Бойля—Мариотта:
Диаграмма
этого процесса (изотерма)
в координатах р, V представляет собой
гиперболу, которая расположена на
диаграмме тем выше, чем выше температура,
при которой происходит процесс.
Исходя
из формул для работы газа и уравнения
Менделеева-Клайперона найдем работу
изотермического расширения газа:
При
этом газ совершит работу, определяемую
выражением (3).
Изотермический
процесс (T=const).
Изотермический процесс описывается
законом Бойля—Мариотта:
Диаграмма
этого процесса (изотерма)
в координатах р, V представляет собой
гиперболу, которая расположена на
диаграмме тем выше, чем выше температура,
при которой происходит процесс.
Исходя
из формул для работы газа и уравнения
Менделеева-Клайперона найдем работу
изотермического расширения газа:
![]() Так
как при Т=const внутренняя энергия идеального
газа не изменяется:
Так
как при Т=const внутренняя энергия идеального
газа не изменяется:
![]() то
из первого начала термодинамики
(δQ=dU+δA) следует, что для изотермического
процесса
то
из первого начала термодинамики
(δQ=dU+δA) следует, что для изотермического
процесса
![]() т.
е. все количество теплоты, сообщаемое
газу, расходуется на совершение им
работы против внешних сил:
т.
е. все количество теплоты, сообщаемое
газу, расходуется на совершение им
работы против внешних сил:
![]() (4)
Значит,
для того чтобы при расширении газа
температура не становилась меньше, к
газу в течение изотермического процесса
необходимо подводить количество теплоты,
равное внешней работе расширения.
(4)
Значит,
для того чтобы при расширении газа
температура не становилась меньше, к
газу в течение изотермического процесса
необходимо подводить количество теплоты,
равное внешней работе расширения.
