
- •1. Основы атомно-молекулярного учения.
- •1. Основные стехиометрические законы.
- •2.Квантовомеханические представления о строении атома.
- •2.Понятие о квантовых числах.
- •3.Порядок заполнения атомных орбиталей электронами. Принцип минимума энергии.
- •3.Правило Хунда.
- •3. Принцип Паули.
- •4.Периодический закон и периодическая система д.И. Менделеева в свете современных представлений о строении атома.
- •4. Характеристика периодов и групп.
- •4.Главные и побочные подгруппы.
- •6.При нагревании
- •8. Метод валентных связей.
- •9.Строение кристаллических веществ.
- •10.Скорость химических реакций. Факторы, влияющие на скорость химической реакции. Закон действующих масс.
- •11.Катализ положительный и отрицательный.
- •12.Химическое равновесие.
- •12. Константа химического равновесия и её физический смысл.
- •12.Влияние внешних факторов на состояние химического равновесия.
- •12.Принцип Ле-Шателье.
- •12.Фазовые равновесия в системах.
- •13.Типичные восстановители и окислители.
- •14.Метод электронного баланса.
- •14.Типы овр.
12. Константа химического равновесия и её физический смысл.
Kр – константа равновесия - количественная величина, равная произведению молярных масс продуктов к произведению молярных масс исходных веществ возведенных в степени равные их стехиометрических коэффициентов.
Физ.
смысл: это отношение констант скоростей
прямой к обратной.
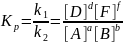
12.Влияние внешних факторов на состояние химического равновесия.
Концентрация
При увеличении концентрации исходных веществ равновесие смещается в сторону продукта. При величении концентрации продукта реакции равновесие смещается в сторону исходных веществ.
Изменение давления
При увеличении давления равновесие смещается в сторону меньших объемов.
Температура
При понижении температуры равновесие смещается в сторону экзотермической реакции, а при понижении в сторону эндотермической реакции
12.Принцип Ле-Шателье.
Ле-Шателье доказал, что константу равновесия можно сместить
Если на систему находящуюся в равновесии оказать какое-либо воздействие, то равновесие сместится так, чтобы уменьшить это воздействие
12.Фазовые равновесия в системах.
Равнове́сие фаз в термодинамике — состояние, при котором фазы в термодинамической системе находятся в состоянии теплового, механического и химического равновесия.
Типы фазовых равновесий:
Тепловое равновесие означает, что все фазы вещества в системе имеют одинаковую температуру.
Механическое равновесие означает равенство давлений по разные стороны границы раздела соприкасающихся фаз. Строго говоря, в реальных системах эти давления равны лишь приближенно, разность давлений создается поверхностным натяжением.
Химическое равновесие выражается в равенстве химических потенциалов всех фаз вещества.
13.Степень окисления. Степень окисления определяется как формальный электрический заряд атома или иона в соединении
Типичные окислители и восстановители, вещества, обладающие окислительно-восстановительной двойственностью. (примеры)
Окислители - это атомы, ионы или молекулы, которые принимают электроны. Восстановители - это атомы, ионы или молекулы, которые отдают электроны.
13.Типичные восстановители и окислители.
Окислители: 1) вещества (оксиды, кислоты, соли) с максимально положительной степенью окисления входящего в них элемента. Например: кислоты – HNO3, H2SO4, HClO4, H2Cr2O7; соли – KСlO4, KClO3, KNO3, KMnO4, K2Cr2O7;оксиды –PbO2, Mn2O7, CrO3, N2O5 2) Самые активные неметаллы – фтор, кислород, озон Восстановители: 1) Bсе металлы (они могут только отдавать электроны); 2) Bещества с минимально возможной (отрицательной) степенью окисления неметалла. Например: водородные соединения – РН3, HI, HBr, H2S; соли – KI, NaBr, K2S. 13.Все остальные вещества в зависимости от условий могут быть как окислителями, так и восстановителями(двойственность): Н2О2, KNO2, Cl2, простые вещества-неметаллы могут как принимать, так и отдавать электроны.
Все простые вещества и соединения участвующие в ОВР делятся на 3 группы:
только восстановительные свойства (формула)
только окислительные свойства (формула)
Простые вещества и соед. которые могут повышать и понижать атомы элемента. (формула)
14.ОВР – Химические реакции, в результате которых происходит изменение степеней окисления атомов химических элементов или ионов, образующих реагирующие вещества, называют В окислительно-восстановительных реакциях электроны не уходят из сферы реакции, а передаются от одного элемента к другому. Вещества, участвующие в окислительно-восстановительных реакциях, и у которых изменились степени окисления, являются либо окислителями, либо восстановителями.
