
- •1.Основые сведения о процессах и аппаратах пищевых производств и методах их исследований
- •2. Сущность, назначение и характеристики механических процессов обработки пищевого сырья и полуфабрикатов
- •3.Гидромеханические процессы. Основные понятия и закономерности
- •4. Тепловые процессы.
- •5. Массообменные и тепломассообменные процессы
- •6. Мембранные процессы
- •7.Методы оптимизации процессов
- •1.2. Определение выходных параметров технологических процессов
- •1.3. Характеристики моделей процессов как объектов исследований
- •1.4.Основные принципы исследования процессов
- •1.5. Основные положения теории подобия. Метод анализа размерностей.
- •2.1. Основные сведения о свойствах и поведении пищевых материалов при
- •2.2.Процесс измельчения пищевого сырья. Технологическое оборудование
- •2.3.Процессs сортирования сыпучих материалов и оборудование для
- •2.3.Процесс смешивания пищевых компонентов. Модели и характеристики качества перемешивания
- •2.4.Процессы обработки пищевых материалов давлением
- •2.6. Процессы транспортирования пищевых материалов
- •3.2. Течение жидкостей. Вязкость
- •3.3.Основные закономерности гидродинамики аппаратов
- •3.4.Анализ некоторых моделей истечения жидких продуктов
- •4.2. Передача теплоты теплопроводностью
- •4.3.Основные сведения о конвективном теплообмене
- •4.4. Передача теплоты излучением
- •4.5.Теплообменные аппараты
- •4.6.Процессы нагревания, охлаждения и конденсации. Конденсаторы
- •5.1.Основные понятия теории массопередачи.
- •5.1. Процессы абсорбции и адсорбции
- •5.3.Диффузионные аппараты
- •6.1. Перенос теплоты и массы вещества в коллоидных капиллярно - пористых телах
- •6.2. Анализ процессов тепломассообмена при сушке пищевых материалов
- •6.3.Условия термодинамического равновесия при сушке.
- •6.4. Основные характеристики пищевых материалов, как объектов сушки
- •6.5.Классификация сушильных аппаратов
- •7.1.Основные сведения о процессах разделения гетерогенных систем.
- •6.2.Основные сведения о мембранных процессах
- •7.1.Методы и задачи оптимизации процессов
- •7.2.Оптимизация состава сыпучих смесей
5.1. Процессы абсорбции и адсорбции
Увлажнение вещества происходит в том случае, когда давление водяных паров в воздухе превышает давление водяных паров на поверхности продукта в результате испарения из него свободной влаги. В этом случае вещество поглощает влагу как за счет адсорбции (образования тонкого слоя на его поверхности) и абсорбции (путем объемного поглощения гидрофильными веществами), так и в результате капиллярной конденсации (при наличии макро- и микрокапилляров).
Процесс абсорбции используется, например, в спиртовом производстве при промывке водой газов, выделяемых при брожении, для улавливания паров этилового спирта. Абсорбция осуществляется при противотоке в аппаратах непрерывного действия при тесном контакте газа и сорбента (жидкости) (рис. 5.1)
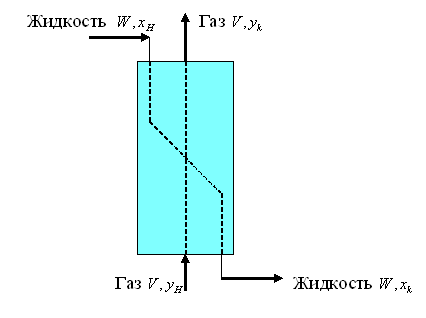
Рис. 5.1 Схема процесса абсорбции
Газ
(кмоль/ч), входящий в абсорбер, содержит
какое-то количество поглощаемого
компонента, концентрация которого равна
![]() . На выходе из абсорбера количество
газа не изменяется, а концентрация
компонента снижается до величины
. На выходе из абсорбера количество
газа не изменяется, а концентрация
компонента снижается до величины
![]() (кмоль/кмоль).
(кмоль/кмоль).
Количество жидкого
сорбента на входе в аппарат равно
![]() .
Содержание поглощаемого компонента в
жидкости на входе и на выходе из
аппарата равно соответственно
.
Содержание поглощаемого компонента в
жидкости на входе и на выходе из
аппарата равно соответственно
![]() .
И
.
И
![]()
Уравнение
материального баланса запишется как
![]() .
Из этого уравнения следует, что удельный
расход сорбента равен отношению
.
Из этого уравнения следует, что удельный
расход сорбента равен отношению
![]() .
.
При рассмотрении условий равновесия газа и сорбента используется правило фаз Гиббса [42]. При протекании технологических процессов в аппаратах совокупности взаимодействующих компонентов образуют различные связные системы. Эти системы могут быть однородными, имеющими одинаковые свойства, и неоднородными или многофазными, состоящими из нескольких фаз, разделенных друг от друга поверхностями раздела. Если состояние систем не изменяется во времени, то они являются стационарными или равновесными,
Чтобы вывести систему из состояния равновесия, нужно воздействовать на нее извне.. К общим законам, определяющим условия равновесия систем относится принцип Ле-Шателье (см. стр. ) и правило фаз Гиббса, которое устанавливает зависимость между числом компонентов системы, числом фаз и числом степеней ее свободы. Это правило позволяет определить число переменных, влияющих на равновесие системы.
Применительно к процессу абсорбции имеются две фазы – газ и жидкость и три компонента – поглощаемое вещество, инертный газ и жидкость.
Определяющими
параметрами процесса абсорбции являются
давление, концентрации и температура:
![]() ,
где
- число степеней свободы;
- число компонентов системы;
- число фаз системы. В данном случае
(рис. 5.1) в число степеней свободы входят
давление, температура и содержание
одной из фаз. Поэтому содержание
поглощаемого компонента в другой фазе
будет зависеть от этих трех параметров.
,
где
- число степеней свободы;
- число компонентов системы;
- число фаз системы. В данном случае
(рис. 5.1) в число степеней свободы входят
давление, температура и содержание
одной из фаз. Поэтому содержание
поглощаемого компонента в другой фазе
будет зависеть от этих трех параметров.
Для идеальных
растворов условия равновесия определяются
законом Генри
![]() ,
где
–
количество растворенного газа, отнесенное
к поглощающей жидкости. Согласно этому
закону растворимость газа прямо
пропорциональна парциальному давлению
газа над жидкостью. Парциальное давление
в смеси газов равно
,
где
–
количество растворенного газа, отнесенное
к поглощающей жидкости. Согласно этому
закону растворимость газа прямо
пропорциональна парциальному давлению
газа над жидкостью. Парциальное давление
в смеси газов равно
![]() ,
где
,
где
![]() - доля
компонента в газовой смеси,
- доля
компонента в газовой смеси,
![]() - общее давление в смеси. Из этих двух
уравнений следует уравнение фазового
равновесия
- общее давление в смеси. Из этих двух
уравнений следует уравнение фазового
равновесия
![]() .
.
Основное уравнение
массопередачи при абсорбции
![]() ,
где
- количество вещества, переданное из
газовой фазы в жидкую, кг;
-
поверхность контакта фаз, м2;
,
где
- количество вещества, переданное из
газовой фазы в жидкую, кг;
-
поверхность контакта фаз, м2;![]() - разность концентраций (кг/м3)
или разность парциальных давлений
(н/м2);
- длительность процесса, ч;
- разность концентраций (кг/м3)
или разность парциальных давлений
(н/м2);
- длительность процесса, ч;
![]() -
коэффициент абсорбции, кг/(м2·ч·н/м2).
-
коэффициент абсорбции, кг/(м2·ч·н/м2).
Процесс адсорбции используется в различных производственных процессах для очистки растворов, воды, спирта от вредных примесей и запахов.
Процесс адсорбции во многом аналогичен процессу абсорбции, но является более сложным, поскольку, кроме поглощения сорбтива поверхностью адсорбента, происходит его проникновение в глубину сорбента, капиллярная конденсация и хемосорбция. Адсорбент в большинстве случаев находится в неподвижном состоянии, а газ профильтровывается через его слой.
Материальный
баланс адсорбции записывается аналогично
процессу абсорбции
![]() ,
где
-
количество сорбента в аппарате,
-
начальное содержание сорбтива, отнесенное
к единице массы сорбента;
-
конечное содержание сорбтива к концу
работы аппарата.
,
где
-
количество сорбента в аппарате,
-
начальное содержание сорбтива, отнесенное
к единице массы сорбента;
-
конечное содержание сорбтива к концу
работы аппарата.
Равновесная
концентрация при адсорбции выражается
законом Фрейндлиха
![]() ,
где
-
концентрация сорбтива в поглотителе;
,
где
-
концентрация сорбтива в поглотителе;![]() - концентрация поглощаемого компонента
в газовой фазе над поглотителем при
достижении равновесия;
- концентрация поглощаемого компонента
в газовой фазе над поглотителем при
достижении равновесия;
![]() -
константы.
-
константы.
Количество
адсорбируемого вещества за время
находится из уравнения
![]() где
-
средняя разность концентраций,
- поверхность адсорбента;
-
коэффициент массопередачи при адсорбции.
где
-
средняя разность концентраций,
- поверхность адсорбента;
-
коэффициент массопередачи при адсорбции.
Кинетический
коэффициент
определяется экспериментальным путем
с применением теории подобия. Например,
при поглощении пара активированным
углем для коэффициента адсорбции
принимают диффузионный критерий
Нуссельта, равный
![]() .
.
В качестве адсорбентов в пищевых производствах используют активированный древесный уголь, силикагель, целлюлозную массу. Активированный уголь используется в ликероводочной промышленности для очистки водно-спиртовых растворов, в свекловично-сахарном производстве – для обесцвечивания сахарного сиропа. Целлюлозная масса применяется для осветления пива.
Адсорберы, используемые в пищевой промышленности, классифицируются на аппараты периодического и непрерывного действия, по состоянию адсорбента – на аппараты с подвижным и неподвижным адсорбентом, по конструкции - на аппараты колонного типа и фильтрпрессы и мешалки, по типу адсорбента и другим признакам.
