
- •Тема 4.Физико-химические и пожароопасные
- •Тема 5. Основы радиохимии …………………………………. 77
- •Раздел II основные закономерности протекания химических процессов
- •Тема 6. Химическая термодинамика…………………….. 93
- •Тема 7. Химическая кинетика и равновесие ………… 108
- •Раздел III химия растворов. Дисперсные системы. Начала электрохимии
- •Тема 8. Основные свойства растворов ………………… 129
- •Тема 9. Растворы электролитов…………………………….. 147
- •Тема 10. Окислительно-восстановительные
- •Тема 11. Основы электрохимии…………………………….. 173
- •Тема 12. Химия дисперсных систем ……………………… 198
- •12.1. Классификация дисперсных систем ……………………………………199
- •Раздел 4. Физико-химические свойства органических веществ
- •Тема 13. Основные теоретические положения
- •Тема 14. Строение и свойства углеводородов ………. 224
- •Тема 15. Органическое топливо и его
- •Тема 16. Кислородсодержащие органические
- •Тема 17. Органические соединения,
- •Тема 18. Полимеры и полимерные материалы ……… 350
- •Тема 19. Химия огнетушащих веществ ………………… 380
- •Тема 20. Основы биохимии …………………………………… 396
- •Тема 21. Химия и защита окружающей среды ………. 406
- •Раздел I. Введение в общую химию
- •Тема 1. Основные понятия и законы химии
- •1.1. Основные понятия химии
- •1.2. Типы химических реакций
- •1.3. Стехиометрические законы химии
- •Тема 2. Периодический закон д.И. Менделеева и строение атома
- •2.1. История открытия Периодического закона
- •2.2. Структура периодической системы элементов
- •2.3. Строение атома
- •2.4. Понятие периодичности
- •Относительные электроотрицательности элементов ()
- •Тема 3. Химическая связь и типы взаимодействия молекул
- •3.1. Ионная связь
- •3.2. Ковалентная связь
- •3.3. Металлическая связь
- •3.4. Водородная связь
- •3.5. Межмолекулярные взаимодействия
- •3.6. Строение газов, жидкостей и твердых тел
- •3.7. Типы кристаллических решеток
- •Тема 4. Физико-химические и пожароопасные
- •4.1. Пожарная опасность металлов
- •Образуют водород
- •4.2.2. VII группа (подгруппа VII а) Галогены (солероды)
- •4.2.3. VI группа (подгруппа VI а) Кислород и халькогены (рождающие медь)
- •4.2.4. V группа (подгруппа V а) Подгруппа азота
- •4.2.5. IV группа (подгруппа IV а) Подгруппа углерода
- •4.2.6. III группа (подгруппа III а) Подгруппа алюминия
- •4.2.7. II группа (подгруппа II а) Щелочноземельные металлы
- •4.2.8. VIII группа (подгруппа VIII а) Инертные газы
- •4.2.9. Водород
- •Тема 5. Основы радиохимии
- •5.1. Краткая история открытия радиоактивности
- •5.2. Типы ионизирующего излучения
- •5.3. Обнаружение и измерение радиоактивности
- •5.4. Устойчивые и неустойчивые изотопы
- •5.5. Скорость радиоактивного распада. Период полураспада.
- •5.6. Естественная радиоактивность
- •5.7. Искусственные превращения
- •5.8. Типы ядерных реакций
- •5.8.1. Цепная реакция деления ядер
- •5.8.2. Ядерный синтез
- •5.8.3. Трансурановые элементы
- •5.9. Применение изотопов
- •5.9.1. Определение возраста образцов с помощью радиоуглерода
- •5.10. Практическое использование ядерной энергии
- •5.11. Радиоактивные отходы и их переработка
- •Раздел II основные закономерности протекания химических процессов
- •Тема 6. Химическая термодинамика
- •Раздел II включает в себя две основных темы: термодинамика химических процессов и кинетика химических процессов.
- •6.1. Основы термохимии
- •6.1.1. Основные понятия термодинамики
- •6.1.2. Первый закон термодинамики. Понятие энтальпии
- •6.1.3. Термохимические уравнения. Стандартные энтальпии образования и горения
- •6.1.4. Законы термохимии
- •6.1.5. Измерение тепловых эффектов реакций
- •6.2. Направленность химических процессов
- •6.2.1. Обратимые и необратимые процессы
- •6.2.2. Энтропия – мера неупорядоченности системы
- •6.2.3. Энергия Гиббса – критерий возможности протекания процесса
- •6.2.4. Расчеты с использованием термодинамических функций состояния
- •Тема 7. Химическая кинетика и равновесие
- •7.1. Скорость химической реакции
- •7.2. Факторы, влияющие на скорость реакции
- •7.2.1. Влияние концентрации реагентов на скорость реакции
- •7.2.2. Влияние температуры на скорость реакции
- •7.2.3. Влияние катализатора на скорость реакции
- •7.3. Типы сложных реакций
- •7.4. Обратимые реакции. Химическое равновесие
- •7.5. Факторы, влияющие на химическое равновесие. Принцип Ле Шателье
- •7.5.1. Влияние температуры на смещение равновесия
- •7.5.2. Влияние концентраций реагирующих веществ на смещение равновесия
- •7.5.3. Влияние давления на смещение равновесия
- •7.5.4. Влияние катализатора на смещение равновесия
- •7.5.6. Принцип Ле Шателье и управление химическими процессами
- •Раздел III химия растворов. Дисперсные системы. Начала электрохимии
- •Тема 8. Основные свойства растворов
- •8.1. Общая характеристика растворов
- •8.1.1. Способы выражения состава растворов
- •Поскольку число молей n может быть рассчитано по формуле
- •8.1.2. Физико-химические свойства воды
- •8.1.3. Механизмы процессов растворения
- •8.1.4. Термодинамика процесса растворения
- •8.1.5. Понятие растворимости
- •8.1.5.1. Растворимость газов в жидкостях
- •8.1.5.2. Растворимость жидкостей в жидкостях
- •8.1.5.3. Растворимость твердых тел в жидкостях
- •8.2. Коллигативные свойства растворов
- •8.2.1. Давление насыщенного пара
- •8.2.2. Давление пара над раствором. 1-й закон Рауля
- •8.2.3. Температура замерзания и температура кипения растворов.
- •8.2.4. Закон Рауля для многокомпонентных систем
- •8.2.5. Разделение многокомпонентных систем
- •8.2.6. Осмос
- •Тема 9. Растворы электролитов
- •9.1. Теория электролитической диссоциации
- •9.1.2. Диссоциация кислот, гидроксидов, солей
- •Количественные характеристики процесса диссоциации
- •9.1.4. Сильные и слабые электролиты
- •9.1.5. Водородный показатель рН
- •9.2. Растворы солей в воде
- •9.2.1. Произведение растворимости
- •9.2.2. Условия осаждения и растворения солей
- •9.2.3. Реакции солей в растворе. Гидролиз солей
- •9.2.4. Буферные растворы
- •Тема 10. Окислительно-восстановительные реакции
- •10.1. Понятие окислительно-восстановительных реакций
- •10.2. Степень окисления
- •10.3. Основные положения теории окисления - восстановления
- •10.4. Важнейшие окислители и восстановители
- •10.4.1. Группа восстановителей
- •10.4.2. Группа окислителей
- •10.5. Классификация окислительно-восстановительных реакций
- •11.1. Гальванические элементы
- •11.1.1. Электродный потенциал
- •11.1.2. Стандартный водородный электрод
- •11.1.3. Стандартные электродные потенциалы
- •11.1.4. Уравнение электродного потенциала (уравнение Нернста)
- •11.1.5. Электрохимический ряд напряжений
- •11.1.6. Механизм возникновения электрического тока в гальванических элементах
- •11.1.7. Химические источники тока
- •11.1.8. Концентрационные элементы
- •11.1.9. Топливные элементы
- •11.2. Коррозия металлов
- •11.2.1. Основные виды коррозии металлов
- •11.2.2. Защита металлов от коррозии
- •11.3. Электролиз
- •Тема 12. Химия дисперсных систем
- •12.1. Классификация дисперсных систем
- •12.2. Способы получения коллоидов
- •Поверхностное натяжение жидкостей на границе с воздухом
- •12.4. Сорбционные процессы
- •12.5. Молекулярно-кинетические свойства коллоидных растворов
- •12.6. Оптические свойства коллоидных растворов
- •12.7. Строение коллоидных частиц
- •12.8. Электрокинетические свойства коллоидных растворов
- •12.9. Устойчивость коллоидных систем
- •12.10. Разрушение коллоидных систем
- •12.10.1. Методы разрушения аэрозолей
- •Раздел 4. Физико-химические свойства органических веществ
- •Тема 13. Основные теоретические положения
- •Органической химии
- •13.1. Теория химического строения а.М. Бутлерова
- •13.2. Классификация органических соединений
- •13.3. Типы органических реакций
- •Тема 14. Строение и свойства углеводородов
- •14.1. Ациклические предельные углеводороды (алканы)
- •1. Основные реакции алканов – реакции замещения водорода, идущие по свободно-радикальному механизму.
- •14.2. Ациклические непредельные углеводороды
- •Непредельные углеводороды
- •14.3. Галогенпроизводные углеводородов
- •14.4. Насыщенные циклические соединения (циклоалканы)
- •14.5. Ароматические углеводороды (арены)
- •14.5.1. Конденсированные циклические системы
- •Тема 15. Органическое топливо и его переработка
- •15.1. Твердое топливо и продукты его переработки
- •15.1.1. Сухая перегонка угля (пиролиз)
- •15.1.2. Газификация угля
- •15.1.3. Гидрогенизация угля
- •15.2. Жидкое топливо и продукты его переработки
- •15.2.1. Первичная переработка нефти
- •15.2.2. Вторичная переработка нефти
- •Крекинг
- •Риформинг
- •Пиролиз углеводородов
- •15.3. Газовое топливо и продукты его переработки
- •Тема 16. Кислородсодержащие органические соединения
- •16.1. Спирты
- •Классификация спиртов
- •16.1.1. Предельные одноатомные спирты
- •16.1.2. Многоатомные спирты
- •16.1.3. Фенолы
- •16.2. Простые эфиры спиртов
- •16.3. Органические перекисные соединения
- •16.4. Альдегиды и кетоны
- •16.5. Карбоновые кислоты
- •Классификация карбоновых кислот
- •16.5.1. Предельные одноосновные карбоновые кислоты
- •16.5.2. Непредельные карбоновые кислоты
- •16.5.3. Высшие жирные кислоты
- •16.5.4. Мыла
- •16.6. Сложные эфиры
- •16.6.1. Жиры
- •16.6.2. Воски
- •Тема 17. Органические соединения,
- •17.1.1. Тиолы
- •17.1.2. Органические сульфиды
- •17.1.3. Эфиры серной кислоты
- •17.2. Азотсодержащие органические соединения
- •Первичные алифатические амины
- •Вторичные алифатические амины
- •Первичные ароматические амины
- •Химические свойства солей диазония
- •17.2.2. Цвет и строение вещества
- •17.2.3. Нитросоединения
- •17.3. Краткая характеристика взрывчатых веществ
- •17.3.1. Параметры горения и взрывов вв
- •Параметры детонационной волны некоторых вв
- •Теплота взрыва некоторых вв
- •17.3.2. Чувствительность взрывчатых веществ
- •Чувствительность к тепловым воздействиям
- •Температура вспышки вв
- •Чувствительность к механическим воздействиям
- •Чувствительность бризантных вв к удару
- •Чувствительность инициирующих вв к удару
- •17.3.3. Химическая стойкость взрывчатых веществ
- •17.3.4. Условия распространения детонации и факторы, влияющие на ее скорость
- •Критический диаметр некоторых вв
- •17.3.5. Краткие сведения об основных взрывчатых веществах
- •Инициирующие взрывчатые вещества
- •Бризантные взрывчатые вещества
- •Тетрил или тринитрофенилметилнитрамин -
- •Метательные взрывчатые вещества, или пороха
- •Тема 18. Полимеры и полимерные материалы
- •Классификация полимеров
- •Отличительные особенности полимеров
- •18.1. Способы получения полимеров
- •18.1.1. Реакции полимеризации
- •18.1.2. Реакции поликонденсации
- •18.2. Деструкция полимеров
- •18.3. Факторы, влияющие на термостойкость полимеров
- •18.4. Полимерные материалы
- •18.4.1. Каучуки
- •18.4.2. Пластмассы
- •Тема 19. Химия огнетушащих веществ
- •19.1. Способы прекращения горения
- •Отв и способы прекращения горения
- •Применение отв для тушения пожаров различных классов
- •19. 2. Вода как отв
- •Преимущества воды как отв
- •Недостатки воды как отв
- •Если угол не устанавливается, то смачивание полное, капля тонкой пленкой растекается по поверхности твердого тела.
- •Пути повышения эффективности воды как отв
- •19.3. Пены как отв
- •19.3.1. Общая характеристика пенообразователей
- •19.3.2. Химическая пена
- •19.3.3. Воздушно-механическая пена
- •19.3.2. Пенообразователи целевого назначения
- •19.4. Негорючие газы как отв
- •19.5. Ингибиторы горения
- •19.5.1. Хладоны как отв
- •19.5.2. Тушение порошковыми составами
- •Тема 20. Основы биохимии
- •20.1. Углеводы
- •20.2. Жиры
- •20.3. Белки
- •Типы белков, присутствующих в человеческом теле, и их функции
- •20.4. Метаболизм пищевых продуктов
- •20.5. Химические элементы в организме человека
- •Элементный состав взрослого человека с массой 70 кг
- •Источники, функции и признаки недостаточности в организме
- •20.6. Витамины
- •Источники, функции и внешние проявления недостаточности
- •20.7. Борьба организма с ядами
- •Тема 21. Химия и защита окружающей среды
- •21.1. Природные и антропогенные источники загрязнения окружающей среды
- •21.2. Виды загрязнений воды и их контроль
- •21.2.1. Вода как природный ресурс
- •21.2.2. Виды загрязнений воды
- •21.2.3. Методы очистки и обработки воды
- •21.2.3.1. Очистка воды в природе
- •21.2.3.2. Жесткость воды и способы ее устранения
- •20.2.3.3. Очистка и водоподготовка природных вод
- •21.2.3.4. Очистка бытовых и промышленных вод
- •21.3. Борьба с загрязнениями воздуха
- •21.3.1. Строение и состав атмосферы
- •21.3.2. Виды загрязнений воздуха
- •21.3.3. Защита воздушного бассейна от загрязнений
- •21.4. Экологические проблемы применения огнетушащих веществ
- •Литература
7.2.2. Влияние температуры на скорость реакции
Скорость химических реакций в большинстве случаев с нагреванием возрастает. Так, на синтез воды из водорода и кислорода при комнатной температуре требуется 54 млрд. лет, то при 5000С на это необходимо 50 мин., а при 7000С реакция идет мгновенно.
Опытные данные свидетельствуют о справедливости правила, сформулированного в 1884 году голландским химиком Я.Х. Вант-Гоффом:
При повышении температуры на каждые 100 скорость гомогенной реакции увеличивается в 2 – 4 раза.
Математически эта зависимость выражается следующим уравнением:
![]() ,
где
,
где
- температурный коэффициент скорости реакции, показывающий, во сколько раз увеличится (или уменьшится) скорость реакции при повышении (или понижении) температуры на каждые 100. Температурный коэффициент скорости реакции принимает значения от 2 до 4.
Можно предположить, что с увеличением температуры увеличивается число столкновений частиц, и именно это является основной причиной увеличения скорости реакции. Но по кинетической теории газов число столкновений при повышении температуры, например, от 0 до 1000С возрастает в
![]() раза,
а на самом деле скорость реакции
увеличивается в 60000 раз.
раза,
а на самом деле скорость реакции
увеличивается в 60000 раз.
Какова же основная причина возрастания скорости реакции с температурой?
Молекулы газа движутся с очень большими скоростями. Например, при комнатной температуре средняя скорость молекул СО2 составляет 258 м/с,
Н2 – 1286 м/с, воздуха – 510 м/с. Скорость движения связана с запасом кинетической энергии по формуле Екин = mU2/2.
Двигаясь с такой скоростью, молекула газа испытывает каждую секунду около миллиарда соударений с другими молекулами. Однако лишь малая часть соударений молекул приводит к химической реакции.
В 1889 году было высказано предположение о существовании минимальной энергии, которой должна обладать молекула, чтобы вступить в реакцию. Эта энергия была названа энергией активации Еа (кДж/моль).
Предполагается, что если суммарная энергия двух сталкивающихся молекул меньше энергии активации, то реакция не пойдет, и столкновение будет неэффективным.
Значения энергии активации изменяются в широких пределах: для ионных реакций в растворах она мала (0 – 2 кДж/моль), а для молекулярных реакций значительно больше (40 – 200 кДж/моль).
Из-за малого значения Еа ионные реакции в растворах протекают практически мгновенно. Если энергия активации лежит в пределах от 40 до 120 кДж/моль, то скорость такой реакции удобно измерять. Именно для таких реакций выполняется правило Вант-Гоффа.
При Еа > 120 кДж/моль лишь очень малая часть столкновений при обычных условиях оканчивается реакцией. К таким реакциям относятся реакции горения.
Расчет показывает, что для протекания реакции с энергетическим барьером Еа = 200 кДж/моль, молекула должна обладать скоростью 2500 м/с. При обычной температуре таких молекул очень мало. С повышением температуры число их растет, а, следовательно, большее число соударений будет заканчиваться реакцией. Молекулы, обладающие избыточной энергией, равной энергии активации, называются активными молекулами.
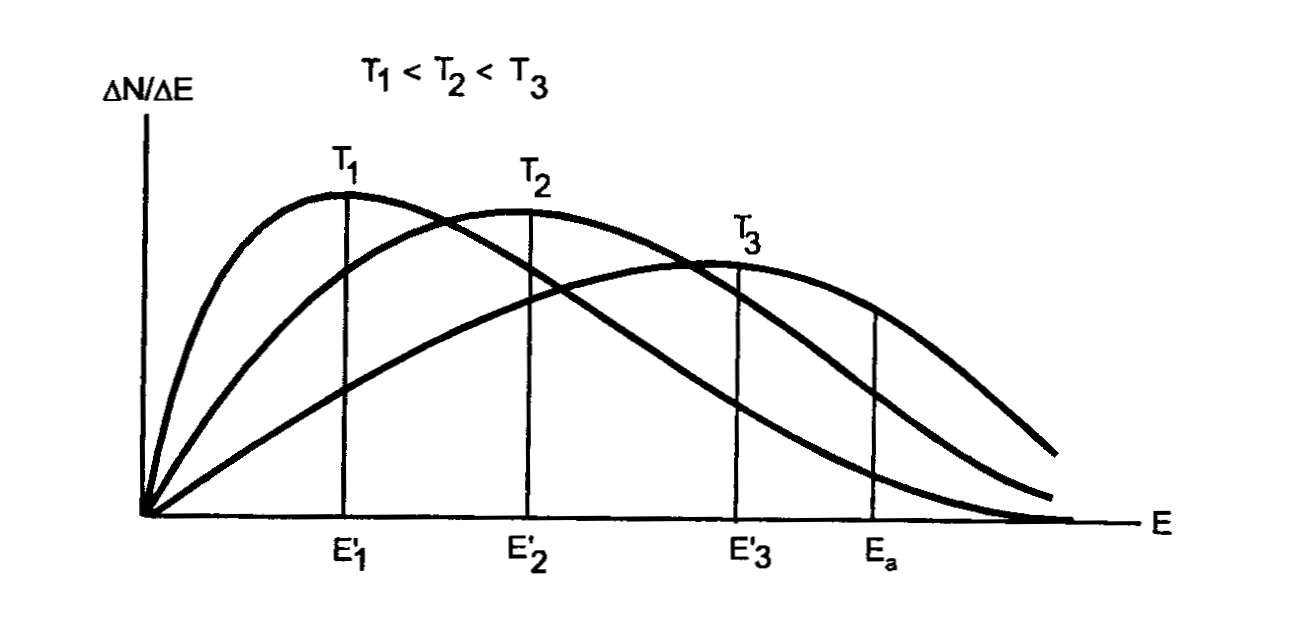
Рис. 7.1. Распределение молекул по энергиям при различных
температурах.
Таким образом, причиной увеличения скорости реакции при нагревании является то, что при повышении температуры резко увеличивается доля “активных” молекул, обладающих достаточной для протекания реакции скоростью движения и соответствующим запасом энергии, равным энергии активации реакции.
Зависимость скорости реакции от температуры выражается уравнением Аррениуса (1889 г.):
![]() ,
где
,
где
- константа скорости реакции (вспомним, что константа скорости реакции численно равна самой скорости при концентрациях реагирующих веществ, равных 1 моль/л);
А – фактор эффективности соударений, показывающий долю соударений, заканчивающихся реакцией;
е – основание натурального логарифма (е = 2,718…);
Еа – энергия активации реакции, кДж/моль;
R – универсальная газовая постоянная (8,314 Дж/мольК);
Т – абсолютная температура, К.
Параметры А и Еа называются кинетическими параметрами уравнения Аррениуса.
Доля активных молекул, обладающих энергией активации, составляет
![]()
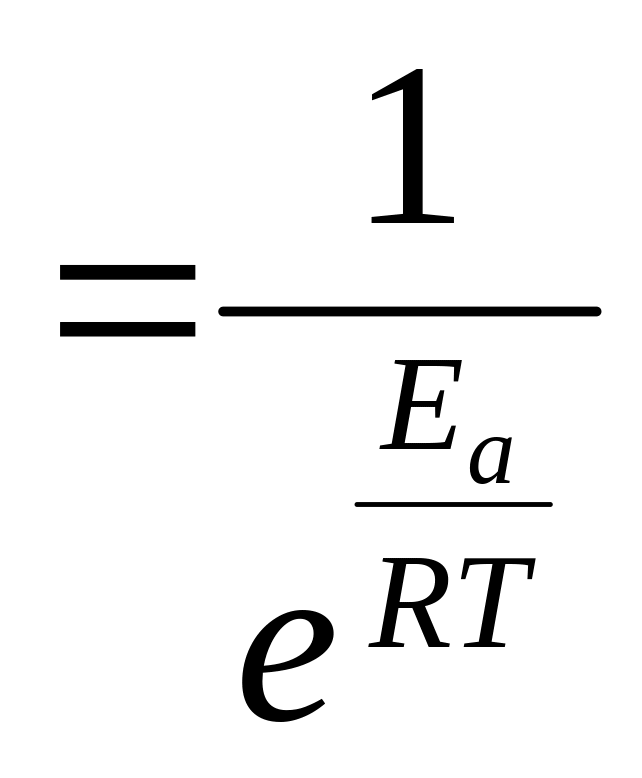 (формула
Больцмана).
(формула
Больцмана).
Таким образом, скорость реакции тем больше, чем меньше энергия активации реакции. При постоянной энергии активации скорость реакции существенно зависит от температуры: чем выше температура, тем скорость реакции выше.
Прекращение реакции горения – тушение – состоит в том, что требуется снижение скорости реакции до определенного значения, ниже которого реакция прекращается. Для уже рассмотренной реакции горения пропана
С3Н8 + 5О2 3СО2 + 4Н2О
формальное выражение для скорости реакции с учетом уравнения Аррениуса
![]() .
.
Прекращение горения (на основе анализа данного уравнения) может быть осуществлено следующим образом:
1. Изоляция горючего от кислорода.
2. Снижение температуры.
3. Разбавление горючей смеси флегматизаторами – негорючими газами. В этом случае уменьшается концентрация и кислорода и пропана.
4. Ингибирование – снижение концентрации активных частиц - свободных радикалов, фактически, уменьшение концентрации пропана.
