
- •2. . Благоприятные соударения молекул. Энтропия активации. Константа скорости реакции.
- •3. Нормальный водородный электрод. Электроды сравнения. Измерение электродных потенциалов
- •1. .Диссоциация воды:
- •2Обратимые реакции. Химическое равновесие. Константа равновесия. Смещение равновесия. Принцип Ле-Шателье.
- •3 Коррозия металлов. Химическая и электрохимическая к-я.
- •1. Общие понятия о растворах. Физ и хим теория растворов. Эффекты при растворении.
- •2. Кинетика и равновесие в гетерогенных системах.
- •3. Коррозия водная, кислотная, атмосферная
- •1. Термодинамика растворения. Способы выражения концентраций растворов.
- •3. .Механизмы химических реакций. Цепные реакции.
- •1. Зависимость скорости реакции от температуры. Теория активных молекул.
- •2.Возникновение электродных потенциалов. Стандартный потенциал. Уравнение нернста.
- •1.Химист электрической энергии, электродвиж сила, концентр элементов :
- •2. .Законы разбавл. Растворов:
- •3.Условия протекания ионных реакций.
- •2.Электролитическая диссоциация. Законы разбавленных растворов электролитов.
- •3. Химическая кинетика. Факторы влияющие на скорость реакций. Закон Гульдберга-Вааге.
- •1. .Энтропия. Свободная энергия Гиббса. Направленность.
- •2. Слабые электролиты.Константа диссоциации. Закон Оствальда.
- •3. Электролиз расплавов и растворов. Законы электролиза.
- •1. Механизмы химических реакций. Молекулярные реакции. Теория активированного комплекса.
- •2. Основы термодинамики. Классификация систем. Энтальпия. Тепловые эффекты реакций.
- •3. .Сильные электролиты. Кажующаяся степень диссоциации. Понятие об активности. Ионная сила растворов.
- •1. .Овр.Осн. Окисл-ли. И восст. Сост-е реакций.
2. Слабые электролиты.Константа диссоциации. Закон Оствальда.
Слабые электролиты – электролиты, степень диссоциации которох в р-рах меньше единицы и уменьшается с ростом концентрации.
К ним относят воду, ряд кислот, основания.
Константа диссоциации зависит от природы диссоц. в-ва и растворителя, не зависит от to и от концентр.р-ра. Указывает на прочность молекул в данном р-ре. Чем меньше k в р-ре, тем слабее диссоциирует электролит, и тем устойчивее его молекулы.
Закон Оствальда. Kg = α2/(1-α)*V α – степень диссоциации V – 1/c
3. Электролиз расплавов и растворов. Законы электролиза.
Электролиз – совокупность процессов, протекающих на электродах, при пропускании эл.тока через расплав или раствор.
р.р. NaCl (H2O) Расплав K+OH-
A(+) 2Cl- - 2e = Cl2 A(+) 4OH- - 4e = O2 + 2H2O
K(-) 2H2O + 2e = H2 + 2OH- K(-) K+ + e = K0
Законы электролиза.
1) М.Фарадей m= э*i*t / F
m – масса вещ-ва э – эквивалент вещ-ва i – ток, A t – время, с F = 96500 кл
2) равные кол-ва электричества разлагают, выделяют, образуют эквивалентые кол-ва в-в
2CuSO4+2H2O=2Cu↓+O2↑+2H2SO4 разлаг-ся выдел-ся образ-ся.
Билет 9
1. Механизмы химических реакций. Молекулярные реакции. Теория активированного комплекса.
Подмеханизмам реакции подразумевают ключевую стадию (элементарный акт), обеспечивающую реакцию в целом.
Типы реакций по механизмам:
1 малекулярныеH2+J2=2HJ 2 ионные Ba+SO4 =>BaSO4 3 радикальные CH3+C2H5 =>C3H8
4 цепные H2+Cl2 = 2HCl
Молекул реакции теория активированного комплекса.
Это большинство реакций в газовой фазе. ( без участия кислорода, фтора, хлора)
Все молекулярные реакции протекают через образование активир. комплекса. Это такое состояние реаг. системы в котором прежние хим. связи ослаблены, но не разорваны, а новые сформированы не окончательно.
![]()
2. Основы термодинамики. Классификация систем. Энтальпия. Тепловые эффекты реакций.
Наука о направлении процессов 1 механические 2 физические 3 химические 4 геологические
5 биологические 6 социальные
Основные понятия -энергия -теплота -работа расширения A=p*∆V\
-система – совокупность тел, выдел.из окружающей среды и рассматриваемых обособленно.
Типы систем 1 Изолированная 2 Открытая
Хим. Термодинамика – терм изолированных систем. Любая система обладает определенным запасом энергии. Полный запас Энергии сист – энтальпия
H= U +A
Внутр. Эн работа сист.
Скрытая ч. Н
При переходе системы из 1 состояния в другое изменяется энтальпия, что проявляется в виде теплового эффекта.
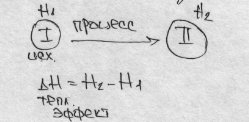
Тепл. эффект – основной признак хим. Реакции. ∆Hх.р< 0 (экзотермич реакция тепло выделяется)
∆Hх.р> 0 (эндотерпич реакция тепло поглощается)
Для расчетов тепл. эф. Используют относительную энтальпию, вычисл в предположении, что энтальпия простых веществ = 0. В этом случае энтальпия сложного вещества – тепловой эффект реакций образования его из простых элементов С+O2=CO2; ΔHх.р.= -94 ккад/моль ΔHх.р=HCO2 – Hc – HO2
Такие относит энтальпии назыв энтальпиями образования. Они рассчитаны для всех веществ и сведены в термодинамич. таблицы
