
- •2. . Благоприятные соударения молекул. Энтропия активации. Константа скорости реакции.
- •3. Нормальный водородный электрод. Электроды сравнения. Измерение электродных потенциалов
- •1. .Диссоциация воды:
- •2Обратимые реакции. Химическое равновесие. Константа равновесия. Смещение равновесия. Принцип Ле-Шателье.
- •3 Коррозия металлов. Химическая и электрохимическая к-я.
- •1. Общие понятия о растворах. Физ и хим теория растворов. Эффекты при растворении.
- •2. Кинетика и равновесие в гетерогенных системах.
- •3. Коррозия водная, кислотная, атмосферная
- •1. Термодинамика растворения. Способы выражения концентраций растворов.
- •3. .Механизмы химических реакций. Цепные реакции.
- •1. Зависимость скорости реакции от температуры. Теория активных молекул.
- •2.Возникновение электродных потенциалов. Стандартный потенциал. Уравнение нернста.
- •1.Химист электрической энергии, электродвиж сила, концентр элементов :
- •2. .Законы разбавл. Растворов:
- •3.Условия протекания ионных реакций.
- •2.Электролитическая диссоциация. Законы разбавленных растворов электролитов.
- •3. Химическая кинетика. Факторы влияющие на скорость реакций. Закон Гульдберга-Вааге.
- •1. .Энтропия. Свободная энергия Гиббса. Направленность.
- •2. Слабые электролиты.Константа диссоциации. Закон Оствальда.
- •3. Электролиз расплавов и растворов. Законы электролиза.
- •1. Механизмы химических реакций. Молекулярные реакции. Теория активированного комплекса.
- •2. Основы термодинамики. Классификация систем. Энтальпия. Тепловые эффекты реакций.
- •3. .Сильные электролиты. Кажующаяся степень диссоциации. Понятие об активности. Ионная сила растворов.
- •1. .Овр.Осн. Окисл-ли. И восст. Сост-е реакций.
3.Условия протекания ионных реакций.
Ионная реакция идет до конца если обр.-ся: а) малорастворимое вещ- во
б) слабый электролит в) если обр.- ся газ г) обр.- ся комплекс
Билет 7
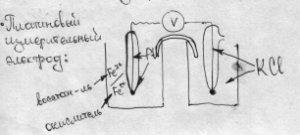
1.ОВС - сис-ма в которой происходит обмен электронами. Любая ОВС характеризуется ОВП (окислительно-восст. потенциал).
ОВП для систем одного типа измеряется по отношению к нормальному водородному электроду или электроду сравнения, а для систем 2-х других типов – с помощью платинового измерительного электрода.
2.Электролитическая диссоциация. Законы разбавленных растворов электролитов.
Электролитическая диссоциация – процесс распада электролита на ионы при растворении его в воде или при плавлении. Законы Рауля и Вант-Гофа можно применить к электролитам, если внести поправку на диссоциацию.
i – изотонический коэффициент. Δp= ip20 N1 ΔT = ikCm π = iCmRT α – степень диссоциации
α = число продиссоциированных молекул/число исходных молекул α = (i-1)/(n-1) i = αn – α + 1
Закон Оствальда:
(α2С)/(1 - α) = kа для очень слабых электролитов (α -> 0) k = α2C к – это константа диссоциации
3. Химическая кинетика. Факторы влияющие на скорость реакций. Закон Гульдберга-Вааге.
Хим. кинетика. Понятие о скорости реакции. Νхим р- ии.= ±δC / δτ
Факторы влияющие на скорость реакции
-природа вещ-в -концентрация -темперетура -катализатор -прочие ф-ры
Закон Гульдберга-Вааге - закон действия масс ν прямопропорц. С
Осн. Хар-ка хим. р-ии - это молекулярность, т.е. число молекул учавстввующих во вз-ии.
-мономолекулярные -бимолекулярные -тримолекулярные
Закон выполн. для всех р-ий , кроме реакций с молекулярностью больше 3, так как соверш. невероятно столкновение одновременно 3-х мол. Все 3-х мол.р-ии идут стадийно, те закон выполняется для каждой стадии, а не для р-ии в целом. (ν=k*CaA*CbB)
Все реак. Где сумма коэф больше 3х многостадийная. Закон выполняется для каждой стадии. А не в целом.
Билет 8
1. .Энтропия. Свободная энергия Гиббса. Направленность.
Для протекания реакции необходима достаточно большая вероятность превращения исходных вещ-в в конечные продукты. Мерой вероятн. явл. энтропия.
S=k * lnW- формула Больцмана k-конст.Больц.; K=R/Na;W- вероятность сост-я.
Sисх---хим.реак→ Sпрод ΔSхим.р=Sпрод – Sисх ΔSхим.р>0 – благоприятный фактор для хим.р.
Энтропия – фундаментальная физическая хар-ка.
Энтропия – меря вероятности, а так же мера беспорядка, хаотичности, поскольку естественное состояние любой системы – хаос.
Все реакции стремятся протекать в сторону большего объёма.
Свободная энергия Гиббса (термодинамический потенциал)
ΔG - направление реакции ΔG = ΔH – TΔS ΔGхим.р<0 (р-ция может протекать →)
ΔGх.р>0 (р-ция ←) ΔG = 0 →← (υ→ = υ←) – хим. Равновесие
