
- •1.Биохимия в решении проблем лечения и диагностики заболеваний.
- •2.Аминокислотный состав белковых молекул.
- •3.Структурно-функциональная организация клетки и функции ее компартментов.
- •4.Методы изучения обмена веществ.
- •5.Понятие об обмене веществ и энергии.Второй закон термодинамики и обмен веществ.
- •6.Переваривание углеводов пищи в ротовой полости.
- •7.Жирные кислоты важнейших липидов тканей человека.
- •1.Нобелевкие лауреаты.
- •2.Физико-химические свойства белков.
- •3.Структурная организация и функция клеточных мембран.
- •4.Состав пищи человека. Орг. И мин. Компоненты.
- •6.Переваривание углеводов в тонком кишечнике.
- •7.Структура и функции фосфолипидов тканей человека.
- •1.Объекты,цели и задачи статической биохимии.
- •2.Методы определения белков.
- •3.Механизмы действия и особенности ферметативного катализа.
- •5.Катаболические реакции.
- •6.Общая схема путей превращения глюкозы.
- •7.Состав и биологические функции транспортных липидов.
- •1. Объекты, цели и задачи динамической биохимии.
- •2. Уровни структурной организации белковых молекул.
- •3. Зависимость скорости ферментативных реакций от температуры и рН среды.
- •4. Незаменимые компоненты пищи (полиненасыщенные жирные кислоты).
- •5. Специфические и общие пути катаболизма.
- •6. Общая схема источников и путей превращения глюкозы в тканях.
- •7. Состав и биологические функции транспортных липидов.
- •1. Объекты, цели и задачи функциональной биохимии.
- •2. Зависимость биологических функций от структуры белков.
- •4. Регионарные патологии, связанные с недостатком микроэлементов.
- •5. Общие принципы регуляции метаболизма.
- •6. Химизм аэробного дихотомического пути распада глюкозы.
- •7 . Резервные и структурные липиды.
- •1. Биохимия в расшифровке механизмов физиологических функций клеток.
- •2. Классификация белков по их биологическим функциям.
- •8.Белки - биокатализаторы (ферменты).
- •3. Коферментные функции витамина в1. Витамин в1 (Тиамин)
- •4. Витамины – механизм их биологических эффектов.
- •5. Основные конечные продукты метаболизма у человека и пути их выведения.
- •6 . Челночные механизмы транспорта водорода надн в митохондрии.
- •7 . Переваривание жиров и всасывание продуктов переваривания липидов.
- •Единицы измерения активности и количества ферментов.
- •Пищевые источники и биологические функции витамина а.
- •Оксидазный тип катаболизма субстратов.
- •Химизм анаэробного пути распада углеводов.
- •Желчные кислоты. Строение и функции.
- •2. Строение и функции сложных белков
- •3.Влияние концентрации фермента и субстрата на ферментативный катализ.
- •6. Распространение и биологическая роль анаэробного гликолиза.
- •Место бх среди других наук в изучении материальных объектов.
- •Полиморфизм и гетерогенность белков в популяции человека
- •4.Полноценные и не полноценные белки
- •5. Макроэргические соединения – строение и функции.
- •6. Анаэробный гликолиз. Цикл кори.
- •7. Ресинтез липидов в кишечной стенке
- •2. Изменение белкового состава в онтогенезе и при болезнях.
- •3. Регуляция активности ферментов. Активаторы и ингибиторы.
- •5. Понятие о тканевом дыхании и биологическом окислении.
- •6. Химизм глюконеогенеза.
- •7. Бета-окисление как специфический путь катаболизм жирных кислот.
- •5. Структурная организация митохондриальной цепи переноса электронов и протонов.
- •6. Химизм и использование лактата сердечной мышцей.
- •7. Особенности метаболизма полиненасыщенных жирных кислот.
- •1. Роль биохимии в подготовке врача.
- •3. Характеристика ферментов класса оксидоредуктаз.
- •5. Анаэробные дегидрогеназы и первичные акцепторы водорода – над и надф.
- •6. Биологическая роль пентозофосфатного пути катаболизма глюкозы.
- •7. Карнитиновый челночный механизм транспорта жирных кислот в митохондрии
- •Структурная организация живого, свойства живых систем.
- •Структурная организация и функции хромосом и рибосом.
- •Характеристика ферментов класса трансфераз.
- •Строение, пищевые источники и биологические функции витамина рр.
- •Источники
- •Действие
- •Окислительное фосфорилирование, коэффициент р/0 и адф/0
- •Механизм резервирования и мобилизации жиров.
- •Билет14
- •Важнейшие этапы истории биохимии. Разделы биохимии.
- •Строение и функции генетического кода: код, кадон и антикадон.
- •Характеристика ферментов класса гидролаз.
- •Строение, пищевые источники и биологические функции витамина в12.
- •Разобщение тканевого дыхания и окислительного фосфорилирования.
- •Механизм мобилизации гликогена. Биологическая роль этого поцесса.
- •Синтез, использование и физиологическое значение кетоновых тел.
- •Формирование представлений о белках как о классе соединений и важнейшем компоненте организма.
- •3. Характеристика ферментов класса изомераз.
- •4. Строение, пищевые источники и биологические функции витамина к.
- •5. Терморегуляторная функция тканевого дыхания. Гипоэнергетические соединения.
- •7. Биосинтез жиров в жировой ткани.
- •2) Механизм репликации
- •Ферменты класс лиаз.
- •Витамин н-биотин, биос 2
- •5 ) Химизм окислительного декарбоксилирования пировиноградной кислоты.
- •7) Синтез жирных кислот в печени (на схеме сверху)
- •Важнейшие этапы развития биохимии. Разделы биохимии.
- •2) Процесс транскрипции
- •4) Витамин в3 – пантотеновая кислота
- •5) Гипо– и авитаминозы подразделяют на:
- •6) Наследственные нарушения обмена дисахаридов
- •7) Стероиды организма человека и их биологические функции.
- •3) Изоферменты. Органоспецифические ферменты
- •5) Причины и последствия вторичных авитаминозов.
- •6) Представители и биолог роль глюкозамингликанов
- •18Б, 7 вопрос
- •1. Структурная организация живого.
- •2. Зависимость биологических функций от структуры белков.
- •3. Типы транспорта веществ через клеточные мембраны.
- •4. Причины и последствия гипервитаминоза.
- •6. Структура и биологическая роль хондротинсульфатов.
- •7. Гиперхолестеринемия, причины и последствия.
- •1.Жизнь как существование белковых тел.
- •2.Химические связи и структура белковых молекл.
- •3.Наследственные энзимопатии.
- •4.Незаменимые органические компоненты пищи.
- •5.Химизм цтк.
- •6.Гиалуроновая кислота.
- •7.Биосинтез фосфолипидов.
- •2. Строение и функции рнк
- •4) Причины гипервитаминоза витамина д
- •1. Основные биохимические функции ж.В.
- •2. Понятия код, кодон, антикодон.
- •4 Гиповитаминоз pp -причины и последствия
- •5Механизмы трансформация энергии в клетке
- •6. Химизм метаболизма лактата в печени.
- •7. Понтие о сфонголипидозах.
- •Билет23
- •1)Функциональная биохимия
- •2. Типы генов днк и их функции
- •4. Гиповитаминоз с -причины и последствия
- •6)Состав и функции протеогликанов
- •Билет27
- •1. Основные биохимические функции ж.В.
- •2. Понятия код, кодон, антикодон.
- •3. Клеточные механизмы регуляции активности ферментов
- •4 Гиповитаминоз pp -причины и последствия
- •5Механизмы трансформация энергии в клетке
- •6. Химизм метаболизма лактата в печени.
- •7. Понтие о сфонголипидозах.
- •Билет23
- •1)Функциональная биохимия
- •2. Типы генов днк и их функции
- •4. Гиповитаминоз с -причины и последствия
- •5 Биоэнергетика митохондриального окисления дегидрогеназами
- •6)Состав и функции протеогликанов
- •1)Цели и задачи динамической биохимии.
- •2)Изоэлектрическое состояние и изоэлектрическая точка белков
- •7)Биохимические основы атеросклероза
- •Билет27
- •2. Уровни структурной организации
- •3, Особенности ферментативного катализа
- •2.Ферментативная реакция идет более "чисто", т.К. Фермент катализирует только одну реакцию не влияя на другие.
- •4,Строение, пищевые источники и биологические функции витамина к.
- •Билет31
- •6. Мобилизация гликогена.
- •Билет32
- •6. Фермент синтеза гликогена гликогенсинтетаза "а" (активная форма ), под воздействием цАмф-зависимой протеинкиназы переходит в неактивную гликогенсинтетазу "b".
- •Билет33
- •Объекты и методы статической биохимии
- •Т ретичная структура белка. Факторы, повреждающие третичную структуру белка
- •Коферменты алифатического ряда
- •Строение, пищевые источники и биологические функции витамина в6
- •Аденилатциклазный каскадный механизм мобилизации гликогена
- •Ресинтез триглицеридов в стенке кишечника. Значение. Химизм
- •Объекты и методы динамической биохимии
- •Четвертичная структура белка. Дайте определение и приведите примеры
- •Химизм и биоэнергетика реакции окисления изоцитрата в цтк
- •Билет42
- •Гидролазы –
- •Витамины группы е (токоферолы)
- •Билет43
- •6. Ключевая реакция апатомического пути катаболизма глюкозы
- •Билет44
- •1) Решение проблем сохранения здоровья человека;
- •2) Выяснение причин различных болезней и изыскание путей их эффективного лечения.
- •2. Химические связи в построении молекулы тетра- и пентопептидов.
- •6. При переходе в аэробные условия анаэробный гликолиз и накопление лактата прекращается, а скорость потребления глюкозы резко угнетается. Это явление носит
- •7. К стероидам относятся углеводороды производные циклопентан-пергидро-фенантрена, метилированные в положении 13 (эстран) или в положениях 10 и 13 (андростан)
6. Фермент синтеза гликогена гликогенсинтетаза "а" (активная форма ), под воздействием цАмф-зависимой протеинкиназы переходит в неактивную гликогенсинтетазу "b".
Донором глюкозных остатков для синтеза гликогена служит УДФ-глюкоза, которая образуется из УТФ и глюкозо-1-фосфата под воздействием фермента глюкозо-1-фосфат-уридилтрансферазы:
глюкозо-1-фосфат + УТФ ® УДФ-глюкоза + Н3РО4.
Далее, под воздействием гликогенсинтетазы (1,4-гликозилтрансферазы) происходит перенос остатков глюкозы с УДФ-глюкозы на олигосахаридный фрагмент (гликоген - затравка).
Синтезируется линейная цепь гликогена, где остатки глюкоза соединяются друг с другом 1-4 альфа-гликозидной связью:
УДФ-глюкоза + n(глюкоза) ® УДФ + (1,4)-гликоген
Ветвления в молекуле гликогена возникают в результате действия фермента ветвления:
- амило-1,4-->1,6 гликозилтрансферазы.
(1,4)-гликоген (1,4)-(1,6)-гликоген
Гликоген — главная форма запасания углеводов у животных и
7. Гпиколипиды (3) содержатся во всех тканях, главным образом в наружном липидном слое плазматических мембран. Гликолипиды построены из сфингозина, остатка жирной кислоты и олигосахарида. Заметим, что в них отсутствует фосфатная группа. К наиболее простым представителям этой группы веществ относятся галактозилцерамид и глюкозилцерамид (так называемые цереброзиды). Соединения с сульфогруппой на углеводных остатках носят название сульфатидов.
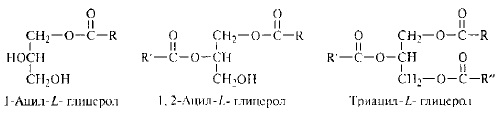
Гликолипиды участвуют также в иммунных реакциях, активном транспорте ионов натрия, передаче нервного импульса.
Билет33
1.Главной целью биологической химии является формирование системных знаний о закономерностях и химическом строении основных веществ организма и молекулярных основах биохимических процессов, лежащих в основе жизнедеятельности организма в норме и патологии.
2. После установления химической природы наследственного материала проблема самовоспроизведения (репликации) хромосом, а точнее — генотипа превратилась в проблему репликации ДНК. Первостепенное значение для решения этой проблемы имела разработка модели строения ДНК Ф. Криком и Дж. Уотсоном в 1953 г. Структура двойной спирали позволяла представить простой механизм репликации ДНК: двойная спираль сначала раскручивается, цепи расходятся, а затем каждая одноцепочечная половина молекулы ДНК достраивается до целой, двухцепочечной молекулы:Последовательность нуклеотидов вновь синтезирующихся цепей определяется правилом комплементарности оснований и последовательностью нуклеотидов имеющейся цепи. Иначе говоря, имеющиеся нуклеотидные цепи служат матрицей для синтеза новых цепей; в результате получаются две двухцепочечные молекулы ДНК, идентичные исходной молекуле. Такой способ репликации получил название полуконсервативного (в принципе возможен и другой механизм — консервативный, при котором вновь синтезируемая нуклеотидная цепь образуется прямо на двойной спирали ДНК, без ее раскручивания). Полуконсервативный механизм репликации ДНК нашел подтверждение в экспериментах с клетками кишечной палочки. Культуру Е. coli на протяжении нескольких поколений выращивали на среде, содержащей в качестве единственного источника азота 15NH4C1. После этого все вещества клеток Е. coli, в которые входит азот, содержали не обычный изотоп азота 14N, а тяжелый 15N. ДНК с 15N имеет большую плотность, чем ДНК с 14N, и это можно обнаружить методом центрифугирования (рис. 4.3). Если культуру, содержащую 151Ч-ДНК, пересеять на среду с немеченым азотом (14NH4C1), то ДНК клеток первого поколения имеет плотность, промежуточную между плотностями 15№ДНК и 14№ДНК; в клетках второго поколения обнаруживается два типа ДНК: с промежуточной плотностью и легкая (141Ч-ДНК). Эти результаты легко объясняются, если исходить из полуконсервативного механизма репликации ДНК (см. рис. 4.3). Позднее было установлено, что в клетках эукариот репликация ДНК происходит также полуконсервативным способом.
3. Ингибиторами ферментов называют вещества, снижающие их активность. Наибольший интерес представляют ингибиторы, взаимодействующие с активным центром фермента. Такие ингибиторы чаще всего являются структурными аналогами субстрата и, следовательно, комплементарны активному центру фермента. Поэтому они подавляют активность только одного фермента или группы ферментов с очень сходным устройством активного центра. Различают ингибиторы конкурентные и неконкурентные, обратимые и необратимые. Активаторы – вещества, которые повышают скорость ферментативных реакций, увеличивают активность ферментов. Они бывают органической и неорганической природы.
Активаторы органической природы: желчные кислоты (активируют поджелудочную ли пазу), энтерокиназа (активирует трипсиноген), глутатион, цистеин, витамин С (повышают активность оскидоредуктаз).
Активаторы неорганической природы: например, HCl активирует пепсиноген, ионы ме таллов (Na, Cl, K, Mg, Mn, Zn) активируют очень многие ферменты. Ионы металлов: а) спо собствуют образованию ферментсубстратного комплекса; б) служат донорами и акцептора ми электронов; в) принимают участие в образовании активного центра ферментов (Zn в со ставе карбангидразы, Fe – в составе цитохромов, каталазы, пероксидазы); г) выступают в ро ли аллостерических регуляторов.
4. Незаменимые аминокислоты — необходимые аминокислоты, которые не могут быть синтезированы в том или ином организме, в частности, в организме человека. Поэтому их поступление в организм с пищей необходимо.
Незаменимыми для взрослого здорового человека являются 8 аминокислот: валин, изолейцин, лейцин, лизин, метионин, треони́н, триптофан и фенилалани́н;
Для детей незаменимыми также являются аргинин и гистидин. полноценность белковых продуктов во многом определяется содержанием в них незаменимых аминокислот. Если в молекуле присутствуют все восемь незаменимых аминокислот, белки называются полноценными, они наиболее необходимы организму. Источники полноценных белков – это в основном продукты животного происхождения: молоко, яйца, рыба, мясо. Особенно ценны три незаменимые аминокислоты – триптофан, лизин, метионин. Повышенное количество триптофана содержится в молоке, мясе, зерновых продуктах; лизина – в мясе и продуктах из крови убойных животных, рыбе, твороге, яйцах; метионина – в твороге, мясе, горохе, фасоли, сое.
5. ХЕМИОСМОТИЧЕСКАЯ ТЕОРИЯ учение о механизме преобразования энергии в биол. мембранах при синтезе аденозинтрифосфорной к-ты (АТФ). Разработана П. Митчеллом в 1961—66. Согласно исходным представлениям Митчелла, запасание энергии в АТФ происходит вследствие предварительного, накопления зарядов на стенках мембраны, создания мембранного потенциала и разности концентраций протонов. Разность электрохимических. потенциалов ионов водорода на сопрягающих мембранах (внутренней мембраны митохондрий, тилакоиды хлоропластов, мембраны бактерий) возникает за счёт энергии, выделяемой при деятельности цепи окислит.-восстановит, ферментов, или за счёт поглощённых квантов света. Трансмембранные электрохимич. потенциалы ионов могут служить источником энергии не только для синтеза АТФ, на и для транспорта веществ, движения бактериальных клеток и др. энергозависимых процессов.
6. В организме человека и животных при недостаточном поступлении кислорода в клетки возможен, так называемый, анаэробный дихотомический путь катаболизма глюкозы (анаэробный гликолиз).
В интенсивно работающих скелетных мышцах, когда мощность механизма доставки кислорода в клетки оказываются недостаточными,
включаются анаэробные механизмы синтеза АТФ происходящие вне митохондрий и без участия митохондриальных ферментов.
В эритроцитах, где вообще отсутствуют митохондрии, потребность в АТФ удовлетворяется только за счет анаэробного гликолиза.
Интенсивный анаэробный гликолиз характерен и для опухолевых клеток.
7. Гиперлипопротеинемия - общее наименование пяти различных типов нарушений обмена веществ, при которых в крови больных обнаруживают жиры. Заболевание может быть наследственным. При некоторых формах гиперлипопротеинемий симптомы выражены слабо, от них можно избавиться, соблюдая диету. Тяжелое течение заболевания может привести к смерти.
Гиперлипопротеинемия обнаруживается примерно у каждого пятого человека с повышенным содержанием липидов и липопротеинов в крови. Это нарушение может быть также связано с наличием другого заболевания, например, диабета, болезни почек или поджелудочной и щитовидной желез.
Билет37
Роль биохимии в медицинской практике
Практически любое заболевание начинается с повреждения (нарушения) одной реакции в метаболизме клетки, а затем оно распространяется на ткань, орган и целый организм. Нарушение метаболизма ведет к нарушению гомеостаза в биологических жидкостях организма человека, что сопровождается изменением биохимических показателей.
Большое значение клинико-биохимических методов исследования биологических жидкостей велико в медицине и важно для подготовки медицинских лабораторных техников. Достаточно напомнить, что только в крови человека можно определить современными методами биохимических исследований около 1000 показателей метаболизма.
Вторичная структура белка. Связи, стабилизирующие вторичную структуру белка
В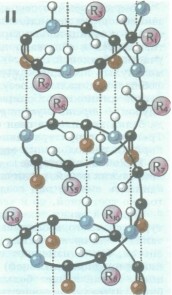 торичная
структура —полипептидная нить
закручена в спираль и образуются
водородные связи между СООН одного
виткаи NH2 другого витка, образуя
достаточно прочную структуру. Водородная,
пептидная связи
торичная
структура —полипептидная нить
закручена в спираль и образуются
водородные связи между СООН одного
виткаи NH2 другого витка, образуя
достаточно прочную структуру. Водородная,
пептидная связи
Коферменты ароматического ряда
Убихинон Химическое строение: Убихинон имеет бензольное кольцо, связанное с различными группами (2, 3-диметокси-метил-1,4-бензохинон с изопреновой цепью в шестом положении):
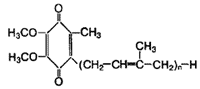
Убихинон — очень важный кофермент процессов биологического окисления питательных веществ и образования энергии в клетках. Входя в состав компонентов дыхательной цепи в митохондриях, он осуществляет перенос водорода через мембраны к цитохромам. Кофермент Q включен во многие пищевые смеси, которые используются для коррекции массы тела, повышения физической работоспособности, а также в растирочные препараты для улучшения энергообразования в суставах и мышцах.
Убихинон — весьма распространенный кофермент, отсюда его название — "вездесущий хинон". Он обнаружен во всех живых клетках. Внутри клеток убихинон локализован, по-видимому, только в митохондриях.
Строение , пищевые источники и биологические функции витамина С
А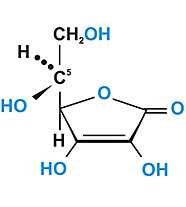 СКОРБИНОВАЯ
КИСЛОТА , С6Н8О6, водорастворимый
витамин. Синтезируется растениями (из
галактозы), животными (из глюкозы), за
исключением человека и приматов и
некоторых других животных, которые
получают аскорбиновую кислоту с пищей.
Биологическая роль аскорбиновой кислоты
связана с участием в окислительно-восстановительных
процессах клеточного дыхания.
СКОРБИНОВАЯ
КИСЛОТА , С6Н8О6, водорастворимый
витамин. Синтезируется растениями (из
галактозы), животными (из глюкозы), за
исключением человека и приматов и
некоторых других животных, которые
получают аскорбиновую кислоту с пищей.
Биологическая роль аскорбиновой кислоты
связана с участием в окислительно-восстановительных
процессах клеточного дыхания.
Влияет на различные функции организма: проницаемость капилляров, рост и развитие костной ткани, повышает иммунобиологическую сопротивляемость к неблагоприятным воздействиям, стимулирует продукцию гормонов надпочечников, способствует регенерации. Отсутствие аскорбиновой кислоты в пище человека понижает сопротивляемость к заболеваниям, вызывает цингу, или скорбут (язва во рту).
Суточная потребность в аскорбиновой кислоте составляет 60 мг — величина, не характерная для витаминов
Общие пути катаболизма. Окислительное декарбоксилирование альфа-кетоглутарата
- общие пути катаболизма - единые пути катаболизма для различных классов веществ, являющиеся продолжением специфических путей. С общими путями катаболизма, в основном, связаны главные биоэнергетические процессы, сопряженные с высвобождением и накоплением энергии в клетке.

Химизм и биологическое значение процесса резервирования гликогена
Механизм синтеза жиров в жировой ткани
В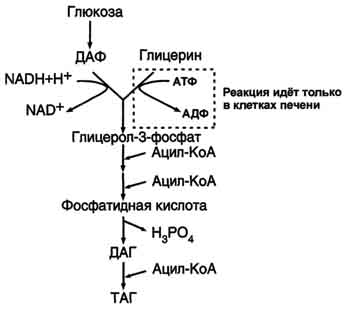 жировой ткани для синтеза жиров
используются в основном жирные кислоты,
освободившиеся при гидролизе жиров ХМ
и ЛПОНП (рис. 8-22). Жирные кислоты поступают
в адипоциты, превращаются в производные
КоА и взаимодействуют с глицерол-3-фосфатом,
образуя сначала лизофосфатидную кислоту,
а затем фосфатидную. Фосфатидная кислота
после дефосфорилирования превращается
в диацилглицерол, который ацилируется
с образованием триацилглицерола.
жировой ткани для синтеза жиров
используются в основном жирные кислоты,
освободившиеся при гидролизе жиров ХМ
и ЛПОНП (рис. 8-22). Жирные кислоты поступают
в адипоциты, превращаются в производные
КоА и взаимодействуют с глицерол-3-фосфатом,
образуя сначала лизофосфатидную кислоту,
а затем фосфатидную. Фосфатидная кислота
после дефосфорилирования превращается
в диацилглицерол, который ацилируется
с образованием триацилглицерола.
Кроме жирных кислот, поступающих в адипоциты из крови, в этих клетках идёт и синтез жирных кислот из продуктов распада глюкозы. В адипоцитах для обеспечения реакций синтеза жира распад глюкозы идёт по двум путям: гликолиз, обеспечивающий образование глицерол-3-фосфата и ацетил-КоА, и пентозофосфатный путь, окислительные реакции которого обеспечивают образование NADPH, служащего донором водорода в реакциях синтеза жирных кислот.
Молекулы жиров в адипоцитах объединяются в крупные жировые капли, не содержащие воды, и поэтому являются наиболее компактной формой хранения топливных молекул. Подсчитано, что, если бы энергия, запасаемая в жирах, хранилась в форме сильно гидратированных молекул гликогена, то масса тела человека увеличилась бы на 14-15 кг.
392
Билет38
