
- •1.Биохимия в решении проблем лечения и диагностики заболеваний.
- •2.Аминокислотный состав белковых молекул.
- •3.Структурно-функциональная организация клетки и функции ее компартментов.
- •4.Методы изучения обмена веществ.
- •5.Понятие об обмене веществ и энергии.Второй закон термодинамики и обмен веществ.
- •6.Переваривание углеводов пищи в ротовой полости.
- •7.Жирные кислоты важнейших липидов тканей человека.
- •1.Нобелевкие лауреаты.
- •2.Физико-химические свойства белков.
- •3.Структурная организация и функция клеточных мембран.
- •4.Состав пищи человека. Орг. И мин. Компоненты.
- •6.Переваривание углеводов в тонком кишечнике.
- •7.Структура и функции фосфолипидов тканей человека.
- •1.Объекты,цели и задачи статической биохимии.
- •2.Методы определения белков.
- •3.Механизмы действия и особенности ферметативного катализа.
- •5.Катаболические реакции.
- •6.Общая схема путей превращения глюкозы.
- •7.Состав и биологические функции транспортных липидов.
- •1. Объекты, цели и задачи динамической биохимии.
- •2. Уровни структурной организации белковых молекул.
- •3. Зависимость скорости ферментативных реакций от температуры и рН среды.
- •4. Незаменимые компоненты пищи (полиненасыщенные жирные кислоты).
- •5. Специфические и общие пути катаболизма.
- •6. Общая схема источников и путей превращения глюкозы в тканях.
- •7. Состав и биологические функции транспортных липидов.
- •1. Объекты, цели и задачи функциональной биохимии.
- •2. Зависимость биологических функций от структуры белков.
- •4. Регионарные патологии, связанные с недостатком микроэлементов.
- •5. Общие принципы регуляции метаболизма.
- •6. Химизм аэробного дихотомического пути распада глюкозы.
- •7 . Резервные и структурные липиды.
- •1. Биохимия в расшифровке механизмов физиологических функций клеток.
- •2. Классификация белков по их биологическим функциям.
- •8.Белки - биокатализаторы (ферменты).
- •3. Коферментные функции витамина в1. Витамин в1 (Тиамин)
- •4. Витамины – механизм их биологических эффектов.
- •5. Основные конечные продукты метаболизма у человека и пути их выведения.
- •6 . Челночные механизмы транспорта водорода надн в митохондрии.
- •7 . Переваривание жиров и всасывание продуктов переваривания липидов.
- •Единицы измерения активности и количества ферментов.
- •Пищевые источники и биологические функции витамина а.
- •Оксидазный тип катаболизма субстратов.
- •Химизм анаэробного пути распада углеводов.
- •Желчные кислоты. Строение и функции.
- •2. Строение и функции сложных белков
- •3.Влияние концентрации фермента и субстрата на ферментативный катализ.
- •6. Распространение и биологическая роль анаэробного гликолиза.
- •Место бх среди других наук в изучении материальных объектов.
- •Полиморфизм и гетерогенность белков в популяции человека
- •4.Полноценные и не полноценные белки
- •5. Макроэргические соединения – строение и функции.
- •6. Анаэробный гликолиз. Цикл кори.
- •7. Ресинтез липидов в кишечной стенке
- •2. Изменение белкового состава в онтогенезе и при болезнях.
- •3. Регуляция активности ферментов. Активаторы и ингибиторы.
- •5. Понятие о тканевом дыхании и биологическом окислении.
- •6. Химизм глюконеогенеза.
- •7. Бета-окисление как специфический путь катаболизм жирных кислот.
- •5. Структурная организация митохондриальной цепи переноса электронов и протонов.
- •6. Химизм и использование лактата сердечной мышцей.
- •7. Особенности метаболизма полиненасыщенных жирных кислот.
- •1. Роль биохимии в подготовке врача.
- •3. Характеристика ферментов класса оксидоредуктаз.
- •5. Анаэробные дегидрогеназы и первичные акцепторы водорода – над и надф.
- •6. Биологическая роль пентозофосфатного пути катаболизма глюкозы.
- •7. Карнитиновый челночный механизм транспорта жирных кислот в митохондрии
- •Структурная организация живого, свойства живых систем.
- •Структурная организация и функции хромосом и рибосом.
- •Характеристика ферментов класса трансфераз.
- •Строение, пищевые источники и биологические функции витамина рр.
- •Источники
- •Действие
- •Окислительное фосфорилирование, коэффициент р/0 и адф/0
- •Механизм резервирования и мобилизации жиров.
- •Билет14
- •Важнейшие этапы истории биохимии. Разделы биохимии.
- •Строение и функции генетического кода: код, кадон и антикадон.
- •Характеристика ферментов класса гидролаз.
- •Строение, пищевые источники и биологические функции витамина в12.
- •Разобщение тканевого дыхания и окислительного фосфорилирования.
- •Механизм мобилизации гликогена. Биологическая роль этого поцесса.
- •Синтез, использование и физиологическое значение кетоновых тел.
- •Формирование представлений о белках как о классе соединений и важнейшем компоненте организма.
- •3. Характеристика ферментов класса изомераз.
- •4. Строение, пищевые источники и биологические функции витамина к.
- •5. Терморегуляторная функция тканевого дыхания. Гипоэнергетические соединения.
- •7. Биосинтез жиров в жировой ткани.
- •2) Механизм репликации
- •Ферменты класс лиаз.
- •Витамин н-биотин, биос 2
- •5 ) Химизм окислительного декарбоксилирования пировиноградной кислоты.
- •7) Синтез жирных кислот в печени (на схеме сверху)
- •Важнейшие этапы развития биохимии. Разделы биохимии.
- •2) Процесс транскрипции
- •4) Витамин в3 – пантотеновая кислота
- •5) Гипо– и авитаминозы подразделяют на:
- •6) Наследственные нарушения обмена дисахаридов
- •7) Стероиды организма человека и их биологические функции.
- •3) Изоферменты. Органоспецифические ферменты
- •5) Причины и последствия вторичных авитаминозов.
- •6) Представители и биолог роль глюкозамингликанов
- •18Б, 7 вопрос
- •1. Структурная организация живого.
- •2. Зависимость биологических функций от структуры белков.
- •3. Типы транспорта веществ через клеточные мембраны.
- •4. Причины и последствия гипервитаминоза.
- •6. Структура и биологическая роль хондротинсульфатов.
- •7. Гиперхолестеринемия, причины и последствия.
- •1.Жизнь как существование белковых тел.
- •2.Химические связи и структура белковых молекл.
- •3.Наследственные энзимопатии.
- •4.Незаменимые органические компоненты пищи.
- •5.Химизм цтк.
- •6.Гиалуроновая кислота.
- •7.Биосинтез фосфолипидов.
- •2. Строение и функции рнк
- •4) Причины гипервитаминоза витамина д
- •1. Основные биохимические функции ж.В.
- •2. Понятия код, кодон, антикодон.
- •4 Гиповитаминоз pp -причины и последствия
- •5Механизмы трансформация энергии в клетке
- •6. Химизм метаболизма лактата в печени.
- •7. Понтие о сфонголипидозах.
- •Билет23
- •1)Функциональная биохимия
- •2. Типы генов днк и их функции
- •4. Гиповитаминоз с -причины и последствия
- •6)Состав и функции протеогликанов
- •Билет27
- •1. Основные биохимические функции ж.В.
- •2. Понятия код, кодон, антикодон.
- •3. Клеточные механизмы регуляции активности ферментов
- •4 Гиповитаминоз pp -причины и последствия
- •5Механизмы трансформация энергии в клетке
- •6. Химизм метаболизма лактата в печени.
- •7. Понтие о сфонголипидозах.
- •Билет23
- •1)Функциональная биохимия
- •2. Типы генов днк и их функции
- •4. Гиповитаминоз с -причины и последствия
- •5 Биоэнергетика митохондриального окисления дегидрогеназами
- •6)Состав и функции протеогликанов
- •1)Цели и задачи динамической биохимии.
- •2)Изоэлектрическое состояние и изоэлектрическая точка белков
- •7)Биохимические основы атеросклероза
- •Билет27
- •2. Уровни структурной организации
- •3, Особенности ферментативного катализа
- •2.Ферментативная реакция идет более "чисто", т.К. Фермент катализирует только одну реакцию не влияя на другие.
- •4,Строение, пищевые источники и биологические функции витамина к.
- •Билет31
- •6. Мобилизация гликогена.
- •Билет32
- •6. Фермент синтеза гликогена гликогенсинтетаза "а" (активная форма ), под воздействием цАмф-зависимой протеинкиназы переходит в неактивную гликогенсинтетазу "b".
- •Билет33
- •Объекты и методы статической биохимии
- •Т ретичная структура белка. Факторы, повреждающие третичную структуру белка
- •Коферменты алифатического ряда
- •Строение, пищевые источники и биологические функции витамина в6
- •Аденилатциклазный каскадный механизм мобилизации гликогена
- •Ресинтез триглицеридов в стенке кишечника. Значение. Химизм
- •Объекты и методы динамической биохимии
- •Четвертичная структура белка. Дайте определение и приведите примеры
- •Химизм и биоэнергетика реакции окисления изоцитрата в цтк
- •Билет42
- •Гидролазы –
- •Витамины группы е (токоферолы)
- •Билет43
- •6. Ключевая реакция апатомического пути катаболизма глюкозы
- •Билет44
- •1) Решение проблем сохранения здоровья человека;
- •2) Выяснение причин различных болезней и изыскание путей их эффективного лечения.
- •2. Химические связи в построении молекулы тетра- и пентопептидов.
- •6. При переходе в аэробные условия анаэробный гликолиз и накопление лактата прекращается, а скорость потребления глюкозы резко угнетается. Это явление носит
- •7. К стероидам относятся углеводороды производные циклопентан-пергидро-фенантрена, метилированные в положении 13 (эстран) или в положениях 10 и 13 (андростан)
Билет31
1.Динамическая биохимия изучает химические реакции, представляющие обмен веществ (метаболизм), а именно пути превращения молекул и механизмы происходящих между ними реакций. Простые молекулы и их производные (моносахариды, жирные кислоты, аминокислоты, нуклеотиды и др.), образующиеся в процессе метаболизма, называются метаболитами. В основе лежит фракционирование, анализ, изучение структуры и свойств отдельных компонентов живого вещества. Методы преимущественно формировались в XX веке; наиболее распространенными являются хроматография, центрифугирование и электрофорез.
2.Транскрипция - первая стадия реализации генетической информации в клетке. ) Процесс транскрипции
Для того чтобы хранящаяся в ДНК информация могла быть использована, ее необходимо переписать (транскрибировать) в последовательностьРНК. При этом ДНК служит только матрицей, т. е. она не меняется в процессе транскрипции. Транскрибируемые последовательности ДНК, т. е. участки ДНК, которые кодируют определенные белки, называются генами. Установлено, что геном млекопитающих содержит по крайней мере 50000 индивидуальных генов, которые вместе составляют менее 20% суммарной ДНК генома. Функция «избыточных» последовательностей ДНК до конца не установлена.
Как уже упоминалось, РНК-полимераза II связывается с 3'-концом промоторного участка. Последовательность, обеспечивающая это связывание, так называемый ТАТА-бокс, короткий А- и Т-обогащенный участок, последовательность которого слегка варьирует у разных генов. Типичная последовательность (каноническая) — ...ТАТААА... . Для взаимодействия полимеразы с этим участком необходимы несколько белков, основныхфакторов транскрипции. Дополнительные факторы могут либо стимулировать, либо ингибировать этот процесс (контроль транскрипции) (см. с.242).
После инициации синтеза (2), РНК-полимераза движется в направлении 3'→5' матричной цепи. В процессе инициации фермент разделяет короткий участок двойной спирали ДНК на две отдельные цепочки. Нуклеозидтрифосфаты связываются комплементарно на кодирующей цепочкеДНК водородными связями и шаг за шагом присоединяются к растущей молекуле РНК (3). Вскоре после начала элонгации 5'-конец транскрипта защищается «кэпом» (от англ. cap) (см. с. 242). Как только транскрипция доходит до сайта полиаденилирования (обычно это последовательность ...ААТААА...), транскрипт отщепляется (4). После этого полимераза прекращает транскрипцию и диссоциирует от ДНК.
3.Витамин B2 интенсифицирует процессы обмена веществ в организме, участвуя в метаболизме белков, жиров и углеводов. Рибофлавин необходим для образования красных кровяных телец и антител, для дыхания клеток и роста. Он облегчает поглощение кислорода клетками кожи, ногтей и волос. Он улучшает состояние органа зрения, принимая, наряду с витамином A, участие в процессах темновой адаптации, снижает усталость глаз и играет большую роль в предотвращении катаракты. Витамин B2 оказывает положительное воздействие на слизистые оболочки пищеварительного тракта. Рибофлавин сводит к минимуму негативное воздействие различных токсинов на дыхательные пути. Рибофлавин необходим для метаболизма триптофана, который превращается в организме в ниацин. Одним из ценнейших качеств рибофлавина является его способность ускорять в организме превращение пиридоксина - витамина B6 - в его активную форму. Флавиновые дегидрогеназы. Это также большая группа ферментов, катализирующая отнятие 2Н от различных субстратов. Простетической группой этих ферментов служат производные витамины В2 (рибофлавина) — флавинадениндинуклеотид (ФАД) и флавинмононуклеотид (ФМН). Активной частью флавиновых дегидрогеназ служит изоаллоксазиновое кольцо. В процессе восстановления именно к этой группировке присоединяется 2Н (2Н++2е) (рис.5). Простетическая группа у флавиновых дегидрогеназ прочно прикреплена к белковому носителю. Специфичность и в этом случае определяется белковой частью фермента.
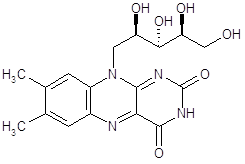
4.Авитамино́з — заболевание, являющееся следствием длительного неполноценного питания, в котором отсутствуют какие-либо витамины. Причины, вызывающие авитаминоз.
Нарушение поступления витаминов с пищей при неправильном питании, недостаточном или некачественном питании.Нарушение процессов пищеварения или нарушение работы органов, связанных непосредственно с пищеварением.Поступление в организм антивитаминов, например лекарственных препаратов синкумар, дикумарол, применяющихся при лечении повышенной свертываемости крови.Особенности детского обмена веществ.Особенности обмена веществ у пожилых людей
Впоследствии авитаминоз может привести к гораздо более плохим последствиям: проблемам с желудочно-кишечным трактом, ухудшению зрения.
Гиповитаминоз – это состояние неполного витаминного дефицита, когда количества потребляемого витамина достаточно, чтобы не развилась тяжелая болезнь, но недостаточно для полного обеспечения всех выполняемых данных витамином функций.
Причины любых гиповитаминозов можно подразделить на 2 группы – экзогенные и эндогенные. К первым относятся:
скудное содержание в пищевом рационе продуктов, выступающих основными источниками того или иного витамина;
разрушение витаминов вследствие длительного и неправильного хранения продуктов, нерациональной кулинарной обработки;
действие антивитаминных факторов (ферментов аскорбаксилазы, тиаминазы и др.), содержащихся в продуктах;
нарушение баланса химического состава рациона, неадекватное соотношение между витаминами и другими нутриентами;
антагонизм с некоторыми ЛС.
Среди эндогенных факторов развития гиповитаминозов, в свою очередь, можно выделить:
заболевания органов ЖКТ, перенесенные операции (например, резекция желудка), приводящие к нарушению всасывания витаминов;
нарушения всасывания витаминов вследствие их утилизации кишечными паразитами и патогенной кишечной микрофлорой;
наследственные либо приобретенные нарушения метаболизма витаминов и образования их активных форм.
Гиповитаминоз провоцирует головокружение, шум в голове, кровоточивость десен, ломкость ногтей и волос, бессонницу и многие другие недуги.
Гѝпервитамино́з — острое расстройство в результате интоксикации сверхвысокой дозой одного или нескольких витаминов (содержащихся в пище или витаминсодержащих лекарствах). Основные причины возникновения гипервитаминоза - изыточное потребление продуктов, богатых соответствующим витамином (например, печени белого медведя, моржа или кита, содержащих витамин А в очень больших количествах) или передозировка витаминосодержащих препаратов. Последствия гипервитаминоза: тошнота, рвота, потеря массы тела, запоры, головная боль и боль в мышцах тела.
5. Окислительное фосфорилирование. При окислении одной молекулы субстрата на один атом поглощенного митохондриями кислорода может использоваться от одного до трех молекул фосфорной кислоты и синтезироваться при этом 1, 2 или 3 молекулы АТФ.
Это процесс - процесс синтеза АТФ в реакциях биологического окисления субстратов получил название - окислительное фосфорилирование.
Для его количественной оценки был введен показатель окислительного фосфорилирования - коэффициент Р/О .
Коэффициент Р/О (АДФ/О) - это есть отношение количества молекул фосфорной кислоты (АДФ) к количеству атомов кислорода использованных митохондриями при окислении какого-либо субстрата. Согласно предложенной П. Митчелом гипотезе, движущей силой фосфорилирования АДФ служит энергия разности редокс-потенциалов, возникающая при переносе электронов от окисляемого субстрата по дыхательной цепи к кислороду и трансформируемая в энергию протонного электрохимического потенцила ( треугольник и мю H+).
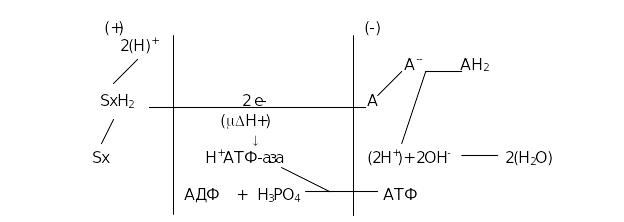
1.Ферменты дых. Цепи расположены в строго определенной последовательности : каждый последующий белок обладает большим сродством к электронам, чем предыдущий (он более электроположителен, т.е. обладает более положительным окислительно-восстановительным потенциалом). Это обеспечивает однонаправленное движение электронов.
2. Все атомы водорода, отщепленные дегидрогеназами от субстратов в аэробных условиях, достигают внутренней мембраны митохондрий в составе НАДН или ФАДН2.
3.Здесь атомы водорода (от НАДН и ФАДН2) передают свои электроны в дыхательную цепь , по которой электроны движутся (50-200 шт/сек )к своему конечному акцептору- кислороду. В результате образуется вода.
4.Поступающие в дыхательную цепь электроны богаты свободной энергией. По мере их продвижения по цепи они теряют энергию.
Часть энергии электронов используется в 1,3,4 комплексами дыхательных ферментов для перемещения ионов водорода через мембрану в межмембранное пространство. Другая часть рассеивается в виде тепла. Упрощенно сказанное представить в виде равенства:
Изменение энергии электронов=совершение работы+ выделение тепла
5. Перенос ионов водорода через мембрану (выкачивание) происходит неслучайно , а в строго определенных участках мембраны. Эти участки называются участки сопряжения (или, не совсем точно, пункты фосорилирования). Они представлены 1,3,4 комплексами дыхательных ферментов. В результате работы этих комплексов формируется градиент ионов водорода между внутренней и наружной поверхностями внутренней митохондриальной мембраны. Такой градиент обладает потенциальной энергией.
