
- •1.Биохимия в решении проблем лечения и диагностики заболеваний.
- •2.Аминокислотный состав белковых молекул.
- •3.Структурно-функциональная организация клетки и функции ее компартментов.
- •4.Методы изучения обмена веществ.
- •5.Понятие об обмене веществ и энергии.Второй закон термодинамики и обмен веществ.
- •6.Переваривание углеводов пищи в ротовой полости.
- •7.Жирные кислоты важнейших липидов тканей человека.
- •1.Нобелевкие лауреаты.
- •2.Физико-химические свойства белков.
- •3.Структурная организация и функция клеточных мембран.
- •4.Состав пищи человека. Орг. И мин. Компоненты.
- •6.Переваривание углеводов в тонком кишечнике.
- •7.Структура и функции фосфолипидов тканей человека.
- •1.Объекты,цели и задачи статической биохимии.
- •2.Методы определения белков.
- •3.Механизмы действия и особенности ферметативного катализа.
- •5.Катаболические реакции.
- •6.Общая схема путей превращения глюкозы.
- •7.Состав и биологические функции транспортных липидов.
- •1. Объекты, цели и задачи динамической биохимии.
- •2. Уровни структурной организации белковых молекул.
- •3. Зависимость скорости ферментативных реакций от температуры и рН среды.
- •4. Незаменимые компоненты пищи (полиненасыщенные жирные кислоты).
- •5. Специфические и общие пути катаболизма.
- •6. Общая схема источников и путей превращения глюкозы в тканях.
- •7. Состав и биологические функции транспортных липидов.
- •1. Объекты, цели и задачи функциональной биохимии.
- •2. Зависимость биологических функций от структуры белков.
- •4. Регионарные патологии, связанные с недостатком микроэлементов.
- •5. Общие принципы регуляции метаболизма.
- •6. Химизм аэробного дихотомического пути распада глюкозы.
- •7 . Резервные и структурные липиды.
- •1. Биохимия в расшифровке механизмов физиологических функций клеток.
- •2. Классификация белков по их биологическим функциям.
- •8.Белки - биокатализаторы (ферменты).
- •3. Коферментные функции витамина в1. Витамин в1 (Тиамин)
- •4. Витамины – механизм их биологических эффектов.
- •5. Основные конечные продукты метаболизма у человека и пути их выведения.
- •6 . Челночные механизмы транспорта водорода надн в митохондрии.
- •7 . Переваривание жиров и всасывание продуктов переваривания липидов.
- •Единицы измерения активности и количества ферментов.
- •Пищевые источники и биологические функции витамина а.
- •Оксидазный тип катаболизма субстратов.
- •Химизм анаэробного пути распада углеводов.
- •Желчные кислоты. Строение и функции.
- •2. Строение и функции сложных белков
- •3.Влияние концентрации фермента и субстрата на ферментативный катализ.
- •6. Распространение и биологическая роль анаэробного гликолиза.
- •Место бх среди других наук в изучении материальных объектов.
- •Полиморфизм и гетерогенность белков в популяции человека
- •4.Полноценные и не полноценные белки
- •5. Макроэргические соединения – строение и функции.
- •6. Анаэробный гликолиз. Цикл кори.
- •7. Ресинтез липидов в кишечной стенке
- •2. Изменение белкового состава в онтогенезе и при болезнях.
- •3. Регуляция активности ферментов. Активаторы и ингибиторы.
- •5. Понятие о тканевом дыхании и биологическом окислении.
- •6. Химизм глюконеогенеза.
- •7. Бета-окисление как специфический путь катаболизм жирных кислот.
- •5. Структурная организация митохондриальной цепи переноса электронов и протонов.
- •6. Химизм и использование лактата сердечной мышцей.
- •7. Особенности метаболизма полиненасыщенных жирных кислот.
- •1. Роль биохимии в подготовке врача.
- •3. Характеристика ферментов класса оксидоредуктаз.
- •5. Анаэробные дегидрогеназы и первичные акцепторы водорода – над и надф.
- •6. Биологическая роль пентозофосфатного пути катаболизма глюкозы.
- •7. Карнитиновый челночный механизм транспорта жирных кислот в митохондрии
- •Структурная организация живого, свойства живых систем.
- •Структурная организация и функции хромосом и рибосом.
- •Характеристика ферментов класса трансфераз.
- •Строение, пищевые источники и биологические функции витамина рр.
- •Источники
- •Действие
- •Окислительное фосфорилирование, коэффициент р/0 и адф/0
- •Механизм резервирования и мобилизации жиров.
- •Билет14
- •Важнейшие этапы истории биохимии. Разделы биохимии.
- •Строение и функции генетического кода: код, кадон и антикадон.
- •Характеристика ферментов класса гидролаз.
- •Строение, пищевые источники и биологические функции витамина в12.
- •Разобщение тканевого дыхания и окислительного фосфорилирования.
- •Механизм мобилизации гликогена. Биологическая роль этого поцесса.
- •Синтез, использование и физиологическое значение кетоновых тел.
- •Формирование представлений о белках как о классе соединений и важнейшем компоненте организма.
- •3. Характеристика ферментов класса изомераз.
- •4. Строение, пищевые источники и биологические функции витамина к.
- •5. Терморегуляторная функция тканевого дыхания. Гипоэнергетические соединения.
- •7. Биосинтез жиров в жировой ткани.
- •2) Механизм репликации
- •Ферменты класс лиаз.
- •Витамин н-биотин, биос 2
- •5 ) Химизм окислительного декарбоксилирования пировиноградной кислоты.
- •7) Синтез жирных кислот в печени (на схеме сверху)
- •Важнейшие этапы развития биохимии. Разделы биохимии.
- •2) Процесс транскрипции
- •4) Витамин в3 – пантотеновая кислота
- •5) Гипо– и авитаминозы подразделяют на:
- •6) Наследственные нарушения обмена дисахаридов
- •7) Стероиды организма человека и их биологические функции.
- •3) Изоферменты. Органоспецифические ферменты
- •5) Причины и последствия вторичных авитаминозов.
- •6) Представители и биолог роль глюкозамингликанов
- •18Б, 7 вопрос
- •1. Структурная организация живого.
- •2. Зависимость биологических функций от структуры белков.
- •3. Типы транспорта веществ через клеточные мембраны.
- •4. Причины и последствия гипервитаминоза.
- •6. Структура и биологическая роль хондротинсульфатов.
- •7. Гиперхолестеринемия, причины и последствия.
- •1.Жизнь как существование белковых тел.
- •2.Химические связи и структура белковых молекл.
- •3.Наследственные энзимопатии.
- •4.Незаменимые органические компоненты пищи.
- •5.Химизм цтк.
- •6.Гиалуроновая кислота.
- •7.Биосинтез фосфолипидов.
- •2. Строение и функции рнк
- •4) Причины гипервитаминоза витамина д
- •1. Основные биохимические функции ж.В.
- •2. Понятия код, кодон, антикодон.
- •4 Гиповитаминоз pp -причины и последствия
- •5Механизмы трансформация энергии в клетке
- •6. Химизм метаболизма лактата в печени.
- •7. Понтие о сфонголипидозах.
- •Билет23
- •1)Функциональная биохимия
- •2. Типы генов днк и их функции
- •4. Гиповитаминоз с -причины и последствия
- •6)Состав и функции протеогликанов
- •Билет27
- •1. Основные биохимические функции ж.В.
- •2. Понятия код, кодон, антикодон.
- •3. Клеточные механизмы регуляции активности ферментов
- •4 Гиповитаминоз pp -причины и последствия
- •5Механизмы трансформация энергии в клетке
- •6. Химизм метаболизма лактата в печени.
- •7. Понтие о сфонголипидозах.
- •Билет23
- •1)Функциональная биохимия
- •2. Типы генов днк и их функции
- •4. Гиповитаминоз с -причины и последствия
- •5 Биоэнергетика митохондриального окисления дегидрогеназами
- •6)Состав и функции протеогликанов
- •1)Цели и задачи динамической биохимии.
- •2)Изоэлектрическое состояние и изоэлектрическая точка белков
- •7)Биохимические основы атеросклероза
- •Билет27
- •2. Уровни структурной организации
- •3, Особенности ферментативного катализа
- •2.Ферментативная реакция идет более "чисто", т.К. Фермент катализирует только одну реакцию не влияя на другие.
- •4,Строение, пищевые источники и биологические функции витамина к.
- •Билет31
- •6. Мобилизация гликогена.
- •Билет32
- •6. Фермент синтеза гликогена гликогенсинтетаза "а" (активная форма ), под воздействием цАмф-зависимой протеинкиназы переходит в неактивную гликогенсинтетазу "b".
- •Билет33
- •Объекты и методы статической биохимии
- •Т ретичная структура белка. Факторы, повреждающие третичную структуру белка
- •Коферменты алифатического ряда
- •Строение, пищевые источники и биологические функции витамина в6
- •Аденилатциклазный каскадный механизм мобилизации гликогена
- •Ресинтез триглицеридов в стенке кишечника. Значение. Химизм
- •Объекты и методы динамической биохимии
- •Четвертичная структура белка. Дайте определение и приведите примеры
- •Химизм и биоэнергетика реакции окисления изоцитрата в цтк
- •Билет42
- •Гидролазы –
- •Витамины группы е (токоферолы)
- •Билет43
- •6. Ключевая реакция апатомического пути катаболизма глюкозы
- •Билет44
- •1) Решение проблем сохранения здоровья человека;
- •2) Выяснение причин различных болезней и изыскание путей их эффективного лечения.
- •2. Химические связи в построении молекулы тетра- и пентопептидов.
- •6. При переходе в аэробные условия анаэробный гликолиз и накопление лактата прекращается, а скорость потребления глюкозы резко угнетается. Это явление носит
- •7. К стероидам относятся углеводороды производные циклопентан-пергидро-фенантрена, метилированные в положении 13 (эстран) или в положениях 10 и 13 (андростан)
2. Уровни структурной организации
Первичная структура – это последовательность аминокислот в полипептидной цепи, соединенных пептидными связями. Пептидная связь – связь между аминогруппой одной аминокислоты и карбоксильной группой другой аминокислоты.
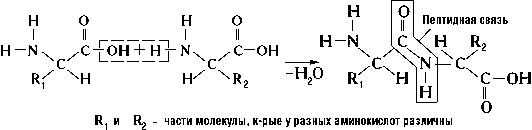
Вторичная структура - это комбинация:
-α-спиралей
-β-складок
-β-поворотов
- неупорядоченных участков молекулы
Третичная структура – расположение всех атомов, из которых состоит белок, в пространстве.
Четвертичная структура – когда белок состоит более чем из одной полипептидной цепи.
Каждая из полипептидных цепей имеет свою третичную структуру и называется в этом случае субъединицей.
3) Ферменты являются биокатализаторами, т.е. веществами биологического происхождения, ускоряющими химические реакции.
Весь процесс ферментативного катализа можно условно поделить на три этапа:
специфическое присоединение моле-кулы субстрата к ферменту (образование фермент-субстратного комплекса);
преобразование первичного промежуточного соединения в один или несколько последовательных (переходных) комплексов;
отделение конечных продуктов реакции от фермента, протекающее в одну или несколько стадий.
3, Особенности ферментативного катализа
Ферментативный катализ отличается целым рядом отличительных признаков:
1.Ферменты намного активнее чем неорганические катализаторы.
Так химотрипсин в 1 млн. раз превосходит щелочной и кислотный гидролиз белка. Одна молекула каталазы может за 1 минуту разрушить 18 млн. молекул Н2О2.
2.Ферментативная реакция идет более "чисто", т.К. Фермент катализирует только одну реакцию не влияя на другие.
Это свойство ферментов связано с их специфичностью.
- Специфичность бывает абсолютная и относительная.
- Абсолютная специфичность - фермент катализирует превращение только одного субстрата.
- Например, уреаза катализирует гидролиз только мочевины.
- Наиболее выражена абсолютная специфичность в виде стереохимической субстратной специфичности - фермент катализирует превращение только одного из всех возможных стереоизомеров одного субстрата.
- Например, фумараза действует только на фумаровую кислоту и не действует на ее стереоизомер малеиновую кислоту.
Витамин К
4,Строение, пищевые источники и биологические функции витамина к.
Источники: капуста, крапива, рябина, шпинат, тыква, арахисовое масло, печень.
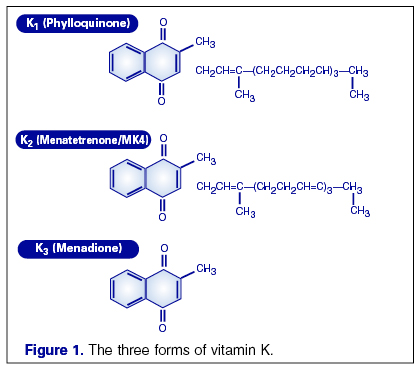
Строение. Витамины содержат нафтохиновое кольцо и алифатическую изопреноидую боковую цепь. Выделяют три формы витамина :витамин К1 (филлохинон), К2(менахинон), К3 (менадион).
![]() Витамин
K участвует в карбоксилировании остатков
глутаминовой кислоты в полипептидных
цепях некоторых белков. В результате
такого ферментативного процесса
происходит превращение остатков
глутаминовой кислоты в остатки
гамма-карбоксилглутаминовой кислоты
(сокращенно Gla-радикалы). Остатки
гамма-карбоксилглутаминовой кислоты
(Gla-радикалы), благодаря двум свободным
карбоксильным группам, участвуют в
связывании кальция. Gla-радикалы играют
важную роль в биологической активности
всех известных Gla-белков.[1]
Витамин
K участвует в карбоксилировании остатков
глутаминовой кислоты в полипептидных
цепях некоторых белков. В результате
такого ферментативного процесса
происходит превращение остатков
глутаминовой кислоты в остатки
гамма-карбоксилглутаминовой кислоты
(сокращенно Gla-радикалы). Остатки
гамма-карбоксилглутаминовой кислоты
(Gla-радикалы), благодаря двум свободным
карбоксильным группам, участвуют в
связывании кальция. Gla-радикалы играют
важную роль в биологической активности
всех известных Gla-белков.[1]
В настоящее время обнаружены 14 человеческих К-зависимых Gla-белков, играющих ключевые роли в регулировании следующих физиологических процессов:
свёртывание крови (протромбин (фактор II), факторы VII, IX, X, белок C, белок S и белок Z). [2]
метаболизм костей (остеокальцин, также названный Gla-белком кости, и матрицей gla белка (MGP)). [3]
сосудистая биология. [4]
5)ДЕГИДРИРОВАНИЕ СУБСТРАТОВ И ОКИСЛЕНИЕ ВОДОРОДА?????
 Основной
функцией этого процесса является
обеспечение организма энергией в
доступной для использования форме
(прежде всего в форме АТФ).
Основной
функцией этого процесса является
обеспечение организма энергией в
доступной для использования форме
(прежде всего в форме АТФ).
Основным топливом при биологическом окислении является ВОДОРОД.
Известно, что реакция окисления водорода кислородом в газовой среде сопровождается выделением большого количества энергии, сопровождаемым взрывом и пламенем. Эволюция живых организмов привела к тому, что реакция окисления водорода до воды оказалась разделенной на отдельные этапы, что обеспечивает постепенное высвобождение энергии в процессе биологического окисления. При этом часть полученной энергии рассеивается в виде тепла (около 60%) а другая часть (около 40%) аккумулируется в молекулах АТФ.
6)
7) В печени из холестерина образуются желчные кислоты. синтезируется 2,8 – 3,5 г в сутки.
играют важную роль в процессах переваривания и всасывания жиров; способствуют росту и функционированию нормальной кишечной микрофлоры.
Желчные кислоты — производные холановой кислоты С23Н39СООН, в молекуле которой к кольцевой структуре присоединены гидроксильные группы. Основными Ж. к., обнаруживаемыми в жёлчи (Жёлчь) человека, являются холевая кислота, хенодезоксихолевая кислота и дезоксихолевая кислота.
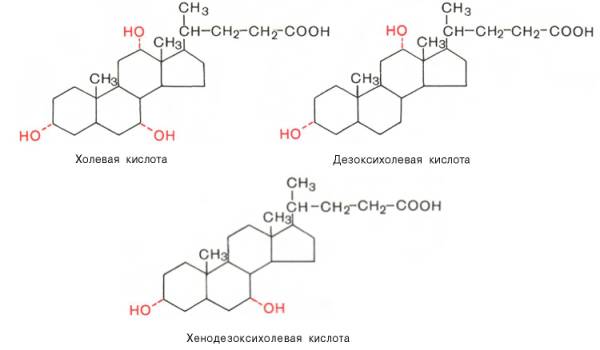
ЖЕЛЧНЫЕ КИСЛОТЫ,
монокарбоновые гидроксикислоты,
относящиеся к классу стероидов.
Почти все желчные кислоты -
производные прир. холановой к-ты (ф-ла
Iа).
Билет30
1) Клиническая химия (также известна как клиническая биохимия или медицинская биохимия) - область клинической лабораторной диагностики, использующая методы аналитической химии для исследования биологических объектов на предмет содержания определенных химических веществ с целью диагностики заболеваний или патологических состояний организма.
Медицинская биохимия- раздел биологической химии, изучающий изменение химического состава и обмена веществ в жидких средах, органах и тканях организма человека при различных патологических состояниях.
2)ЗАВИСИМОСТЬ БИОЛОГИЧЕСКИХ ФУНКЦИЙ ОТ СТРУКТУРЫ БЕЛКОВ
Первичная структура белка — последовательность расположения аминокислотных остатков в полипептидной цепи, составляющей молекулу белка. Связь между аминокислотами — пептидная.
Именно первичная структура белковой молекулы определяет свойства молекул белка и ее пространственную конфигурацию. Замена всего лишь одной аминокислоты на другую в полипептидной цепочке приводит к изменению свойств и функций белка. Например, замена в β-субъединице гемоглобина шестой глутаминовой аминокислоты на валин приводит к тому, что молекула гемоглобина в целом не может выполнять свою основную функцию — транспорт кислорода; в таких случаях у человека развивается заболевание — серповидноклеточная анемия. Вторичная структура — упорядоченное свертывание полипептидной цепи в спираль (имеет вид растянутой пружины). Витки спирали укрепляются водородными связями, возникающими между карбоксильными группами и аминогруппами. Практически все СО- и NН-группы принимают участие в образовании водородных связей. Они слабее пептидных, но, повторяясь многократно, придают данной конфигурации устойчивость и жесткость. На уровне вторичной структуры существуют белки: фиброин (шелк, паутина), кератин (волосы, ногти), коллаген (сухожилия)- СТРОИТЕЛЬНАЯ ФУНКЦИЯ.
Третичная структура — укладка полипептидных цепей в глобулы, возникающая в результате возникновения химических связей (водородных, ионных, дисульфидных) и установления гидрофобных взаимодействий между радикалами аминокислотных остатков. Основную роль в образовании третичной структуры играют гидрофильно-гидрофобные взаимодействия. У некоторых белков третичная структура стабилизируется дисульфидными ковалентными связями, возникающими между атомами серы двух остатков цистеина. На уровне третичной структуры существуют ферменты, антитела, некоторые гормоны-РЕГУЛЯТОРНАЯ, ЗАЩИТНАЯ ФУНКЦИИ.
Четвертичная структура характерна для сложных белков, молекулы которых образованы двумя и более глобулами. Субъединицы удерживаются в молекуле благодаря ионным, гидрофобным и электростатическим взаимодействиям. Иногда при образовании четвертичной структуры между субъединицами возникают дисульфидные связи. Наиболее изученным белком, имеющим четвертичную структуру, является гемоглобин. Он образован двумя α-субъединицами (141 аминокислотный остаток) и двумя β-субъединицами (146 аминокислотных остатков). С каждой субъединицей связана молекула гема, содержащая железо-ТРАНСПОРТНАЯ ФУНКЦИЯ.
Если по каким-либо причинам пространственная конформация белков отклоняется от нормальной, белок не может выполнять свои функции. Например, причиной «коровьего бешенства» (губкообразной энцефалопатии) является аномальная конформация прионов — поверхностных белков нервных клеток.
3)РЕГУЛЯЦИЯ АКТИВНОСТИ ФЕРМЕНТОВ.ИНГИБИТОРЫ И АКТИВАТОРЫ ФЕРМЕНТОВ
Активность ферментов в клетке непостоянна во времени. Она чутко реагирует на ситуацию, в которой оказывается клетка, на факторы, воздействующие на клетку как снаружи, так и изнутри. Главная цель этой реакции – отреагировать на изменение окружающей среды, приспособить клетку к новым условиям, дать должный ответ на гормональные и иные стимулы, а в некоторых ситуациях – получить шанс выжить.
Основными факторами, от которых зависит активность ферментов в клетке являются:
- количество фермента,
- локализация ферментов в клетке,
- изменения уровня рН, температуры,
- количество субстрата,
- наличие аллостерических эффекторов: активаторов и ингибиторов,
- ограниченный (частичный) протеолиз проферментов.
Вещества, повышающие активность ферментов и, следовательно, скорость ферментативной реакции, называются активаторами.
Активность ферментов могут повышать ионы металлов, кофакторы ферментов, субстраты.
Активация ферментов может осуществляться путем химической модификации структуры фермента, т.е. путем превращения неактивного профермента в фермент, путем присоединения какой-либо специфической модифицирующей группы к молекуле фермента, или путем диссоциации неактивного комплекса на активный фермент и связывающий комплекс.
Активирующее влияние на скорость ферментативной реакции оказывают разнообразные вещества органической и неорганической природы.
Ингибиторы – вещества, снижающие активность фермента.
Различают обратимое и необратимое ингибирование ферментов.
При определенных условиях при обратимом ингибировании возможно удаление ингибитора и восстановление активности фермента.
Обратимое ингибирование бывает двух видов: конкурентное и неконкурентное.
При конкурентном обратимом ингибировании ингибитор по своей структуре похож на субстрат, легко соединяется с субстратным центром фермента (контактная, якорная площадка), но не может прореагировать с ним.
Некоторые ингибиторы образуют комплекс не со свободным ферментом, а с ферментсубстратным комплексом: ES + I <====> ESI
В этих случаях повышение концентрации субстрата не уменьшает действие ингибитора. Такие ингибиторы называются неконкурентными.
4. Витамины – это низкомолекулярные органические соединения, не синтезируемые в организме человека, но, присутствуя в небольших количествах в некоторых продуктах питания, при поступлении в организм обеспечивают нормальный метаболизм и выполнение клетками соответствующих физиологических функций.
^ Классификация витаминов: Все витамины разделяют по растворимости на две группы: жирорастворимые – А, Д, Е, К и водорастворимые – С, Р, В1, В2, РР, (В3) В5, В6, В9(10), В12, Н. Отдельную группу составляют витаминоподобные вещества – холин, инозит, липоевая кислота, прааминобензойная кислота (ПАБК), убихинон (КоQ), пангамовая кислота и т.д.
^ Роль витаминов в обмене веществ. Витамины необходимы для нормального протекания различных биохимических и физиологических процессов. 1. Многие витамины являются предшественниками коферментов. Эту роль выполняют почти все водорастворимые витамины: - витамин В1 (Тимин) входит в состав ТДФ (тиаминдифосфата) кофермента декарбоксилаз альфа-кетокислот. - витамин В2 (рибофлавин) является компонентом ФМН (флавинмононуклеотида) и ФАД (флавинадениндинуклеотида) кофермента аминотрансфераз и декарбоксилаз аминокислот и т.д. 2. Некоторые витамины являются сильными антиоксидантами, препятствуют активации свободнорадикальных процессов (витамины Е, А – жирорастворимые антиоксиданты, витамины С и Р – водорастворимые антиоксиданты). 3. Производные жирорастворимых витаминов А и Д являются сигнальными молекулами, так как действуют через рецепторы. Витамин А (ретинол) превращается в организме в сигнальную молекулу - ретиноевую кислоту,а витамин Д (холекальциферол) - в гормон кальцитриол. 4.Некоторые витамины (аскорбиновая кислота) участвуют в образовании сигнальных молекул – нейромедиаторов и гормонов. 5.Отдельные витамины (ВС, В12) участвуют в синтезе незаменимых аминокислот (метионина). Авитаминоз – это патологическое состояние, вызванное отсутствием витамина в организме. Гиповитаминоз – патологическое состояние, вызванное недостатком витамина в организме. Чаще встречаются состояния, обусловленные дефицитом не одного, а нескольких витаминов в организме. Такие состояния называются полигиповитаминозы. Избыточное поступление витаминов и их накопление в организме может привести к развитию гипервитаминоза.
5.БИОЛОГИЧЕСКИЙ СМЫСЛ ТЕРМИНАЛЬНОГО МИТОХОНДРИАОЛЬНОГО ОКИСЛЕНИЯ??????
Способы окисления в организме человека
-Путем отнятия водорода от окисляемого субстрата:
1Митохон-дриальное окисление(оксидазный тип) Используется 80% кислорода
2 Внемитохон-дриальное окисление оксидазного типа(пероксидное)
- Путем присоединения кислорода к окисляемому субстрату: Внемитохондриальное
окисление оксигеназного типа(микросомальное окисление)
Внемитохондриальный тип окисления.На его долю приходится 5-10 % кислорода
6. пентозофосфатный путь распада глюкозы
Пентозофосфатный цикл начинается с окисления глюкозо-6-фосфата и последующего окислительного декарбоксилирования продукта (в результате от гексозофосфата отщепляется первый атом углерода). Это первая, так называемая окислительная, стадия пентозофосфатного цикла. Вторая стадия включает неокислительные превращения пентозофосфатов с образованием исходного глюкозо-6-фосфата (рис. 10.12). Реакции пен-тозофосфатного цикла протекают в цитозоле клетки.
Первая реакция – дегидрирование глюкозо-6-фосфата при участии фермента глюкозо-6-фосфатдегидрогеназы и кофермента НАДФ+. Образовавшийся в ходе реакции 6-фосфоглюконо-δ-лактон – соединение нестабильное и с большой скоростью гидролизуется либо спонтанно, либо с помощью фермента 6-фосфоглюконолактоназы с образованием 6-фос-фоглюконовой кислоты (6-фосфоглюконат):
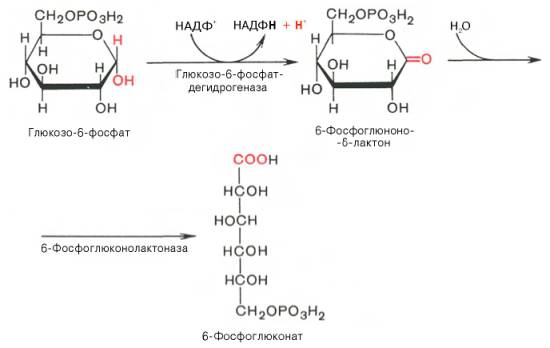
Во второй – окислительной – реакции, катализируемой 6-фосфоглюко-натдегидрогеназой (декарбоксилирующей), 6-фосфоглюконат дегидрируется и декарбоксилируется. В результате образуется фосфорилированная кетопентоза – D-рибулозо-5-фосфат и еще 1 молекула НАДФН:
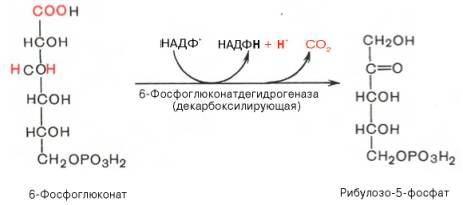
Под действием соответствующей эпимеразы из рибулозо-5-фосфата может образоваться другая фосфопентоза – ксилулозо-5-фосфат. Кроме того, рибулозо-5-фосфат под влиянием особой изомеразы легко превращается в рибозо-5-фосфат. Между этими формами пентозофосфатов устанавливается состояние подвижного равновесия:
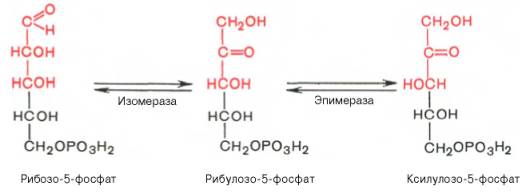
При определенных условиях пентозофосфатный путь на этом этапе может быть завершен. Однако при других условиях наступает так называемый неокислительный этап (стадия) пентозофосфатного цикла. Реакции этого этапа не связаны с использованием кислорода и протекают в анаэробных условиях. При этом образуются вещества, характерные для первой стадии гликолиза (фруктозо-6-фосфат, фруктозо-1,6-бисфосфат, фосфотрио-зы), а другие – специфические для пентозофосфатного пути (седогептуло-зо-7-фосфат, пентозо-5-фосфаты, эритрозо-4-фосфат).
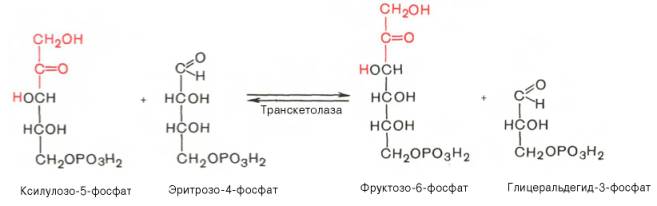
Основными реакциями неокислительной стадии пентозофосфатного цикла являются транскетолазная и трансальдолазная. Эти реакциикатализируют превращение изомерных пентозо-5-фосфатов:
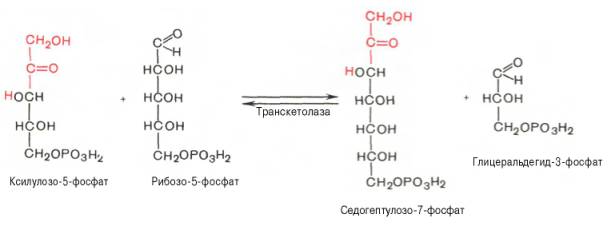
Коферментом в транскетолазной реакции служит ТПФ, играющий роль промежуточного переносчика гликольальдегидной группы от ксилулозо-5-фосфата к рибозо-5-фосфату. В результате образуется семиуглеродный моносахарид седогептулозо-7-фосфат и глицеральдегид-3-фосфат.
Транскетолазная реакция в пентозном цикле встречается дважды, второй раз – при образовании фруктозо-6-фосфата и триозофосфата в результате взаимодействия второй молекулы ксилулозо-5-фосфата с эритро-зо-4-фосфатом:
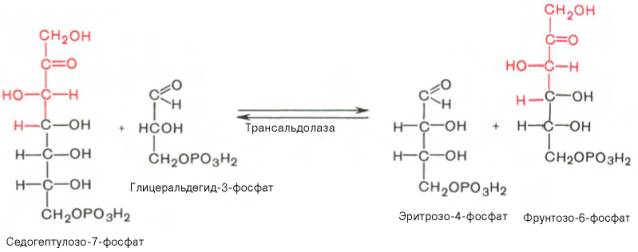
Фермент трансальдолаза катализирует перенос остатка диоксиацетона (но не свободного диоксиацетона) от седогептулозо-7-фосфата на гли-церальдегид-3-фосфат:
Шесть молекул глюкозо-6-фосфата, вступая в пентозофосфатный цикл, образуют 6 молекул рибулозо-5-фосфата и 6 молекул СО2, после чего из 6молекул рибулозо-5-фосфата снова регенерируется 5 молекул глюко-зо-6-фосфата (см. рис. 10.12). Однако это не означает, что молекулаглюкозо-6-фосфата, вступающая в цикл, полностью окисляется. Все 6 молекул СО2 образуются из С-1-атомов 6 молекул глюкозо-6-фосфата.
Валовое уравнение окислительной и неокислительной стадий пенто-зофосфатного цикла можно представить в следующем виде:
![]()
или
![]()
Образовавшийся НАДФН используется в цитозоле на восстановительные синтезы и, как правило, не участвует в окислительном фосфори-лировании, протекающем в митохондриях.
Биологическая роль пентозного цикла состоит в следующем:
1. В этом пути при окислении одной молекулы глюкозо-6-фосфата образуется 12 НАДФН2, которые используются клетками для синтеза жирных кислот, холестерина, стероидных гормонов, для обезвреживания ядов и др.
2. В этом процессе синтезируются различные пентозы, в том числе рибоза, необходимая для построения молекул нуклеотидов и нуклеиновых кислот.
3. В аэробных условиях, при переносе протонов и электронов с цитозольных 12 молекул НАДФН2 в митохондрии на ферменты дыхательной цепи, возможен синтез 36 молекул АТФ в реакциях окислительного фосфорилирования.

7. Установлено, что окисление жирных кислот протекает в печени (60%), почках, скелетных мышцах, жировой ткани. Около 70% О2, поглощаемого миокардом, используется для
окисления ЖК.


Биоэнергетика процесса бета-окисления жирных кислот складывается из произведения числа циклов бета-окисления на число молекул АТФ, синтезируемых в каждом цикле (5АТФ): (Сn/2 -1) 5 = Х (АТФ)
Например, при бета-окислении стеариновой кислоты (Cn=18) выход АТФ равен: (18/2-1)5= 40 АТФ.
Выход энергии при полном окислении жирных кислот до углекислого газа и воды складывается из суммы энергии, выделенной при бета-окислении (Cn/2-1)5, и энергии, высвобождаемой при окислении в цикле Кребса всех молекул ацетил-КоА, образовавшихся при бета-окислении данной жирной кислоты (Сn/2)12:
(Сn/2-1)5 + (Cn/2)12 = Х АТФ
Например, при полном окислении стеариновой кислоты (Cn=18) выход АТФ равен:
(18/2-1) 5 + (18/2)12= 40+108 = 148 АТФ.
