
- •1.Биохимия в решении проблем лечения и диагностики заболеваний.
- •2.Аминокислотный состав белковых молекул.
- •3.Структурно-функциональная организация клетки и функции ее компартментов.
- •4.Методы изучения обмена веществ.
- •5.Понятие об обмене веществ и энергии.Второй закон термодинамики и обмен веществ.
- •6.Переваривание углеводов пищи в ротовой полости.
- •7.Жирные кислоты важнейших липидов тканей человека.
- •1.Нобелевкие лауреаты.
- •2.Физико-химические свойства белков.
- •3.Структурная организация и функция клеточных мембран.
- •4.Состав пищи человека. Орг. И мин. Компоненты.
- •6.Переваривание углеводов в тонком кишечнике.
- •7.Структура и функции фосфолипидов тканей человека.
- •1.Объекты,цели и задачи статической биохимии.
- •2.Методы определения белков.
- •3.Механизмы действия и особенности ферметативного катализа.
- •5.Катаболические реакции.
- •6.Общая схема путей превращения глюкозы.
- •7.Состав и биологические функции транспортных липидов.
- •1. Объекты, цели и задачи динамической биохимии.
- •2. Уровни структурной организации белковых молекул.
- •3. Зависимость скорости ферментативных реакций от температуры и рН среды.
- •4. Незаменимые компоненты пищи (полиненасыщенные жирные кислоты).
- •5. Специфические и общие пути катаболизма.
- •6. Общая схема источников и путей превращения глюкозы в тканях.
- •7. Состав и биологические функции транспортных липидов.
- •1. Объекты, цели и задачи функциональной биохимии.
- •2. Зависимость биологических функций от структуры белков.
- •4. Регионарные патологии, связанные с недостатком микроэлементов.
- •5. Общие принципы регуляции метаболизма.
- •6. Химизм аэробного дихотомического пути распада глюкозы.
- •7 . Резервные и структурные липиды.
- •1. Биохимия в расшифровке механизмов физиологических функций клеток.
- •2. Классификация белков по их биологическим функциям.
- •8.Белки - биокатализаторы (ферменты).
- •3. Коферментные функции витамина в1. Витамин в1 (Тиамин)
- •4. Витамины – механизм их биологических эффектов.
- •5. Основные конечные продукты метаболизма у человека и пути их выведения.
- •6 . Челночные механизмы транспорта водорода надн в митохондрии.
- •7 . Переваривание жиров и всасывание продуктов переваривания липидов.
- •Единицы измерения активности и количества ферментов.
- •Пищевые источники и биологические функции витамина а.
- •Оксидазный тип катаболизма субстратов.
- •Химизм анаэробного пути распада углеводов.
- •Желчные кислоты. Строение и функции.
- •2. Строение и функции сложных белков
- •3.Влияние концентрации фермента и субстрата на ферментативный катализ.
- •6. Распространение и биологическая роль анаэробного гликолиза.
- •Место бх среди других наук в изучении материальных объектов.
- •Полиморфизм и гетерогенность белков в популяции человека
- •4.Полноценные и не полноценные белки
- •5. Макроэргические соединения – строение и функции.
- •6. Анаэробный гликолиз. Цикл кори.
- •7. Ресинтез липидов в кишечной стенке
- •2. Изменение белкового состава в онтогенезе и при болезнях.
- •3. Регуляция активности ферментов. Активаторы и ингибиторы.
- •5. Понятие о тканевом дыхании и биологическом окислении.
- •6. Химизм глюконеогенеза.
- •7. Бета-окисление как специфический путь катаболизм жирных кислот.
- •5. Структурная организация митохондриальной цепи переноса электронов и протонов.
- •6. Химизм и использование лактата сердечной мышцей.
- •7. Особенности метаболизма полиненасыщенных жирных кислот.
- •1. Роль биохимии в подготовке врача.
- •3. Характеристика ферментов класса оксидоредуктаз.
- •5. Анаэробные дегидрогеназы и первичные акцепторы водорода – над и надф.
- •6. Биологическая роль пентозофосфатного пути катаболизма глюкозы.
- •7. Карнитиновый челночный механизм транспорта жирных кислот в митохондрии
- •Структурная организация живого, свойства живых систем.
- •Структурная организация и функции хромосом и рибосом.
- •Характеристика ферментов класса трансфераз.
- •Строение, пищевые источники и биологические функции витамина рр.
- •Источники
- •Действие
- •Окислительное фосфорилирование, коэффициент р/0 и адф/0
- •Механизм резервирования и мобилизации жиров.
- •Билет14
- •Важнейшие этапы истории биохимии. Разделы биохимии.
- •Строение и функции генетического кода: код, кадон и антикадон.
- •Характеристика ферментов класса гидролаз.
- •Строение, пищевые источники и биологические функции витамина в12.
- •Разобщение тканевого дыхания и окислительного фосфорилирования.
- •Механизм мобилизации гликогена. Биологическая роль этого поцесса.
- •Синтез, использование и физиологическое значение кетоновых тел.
- •Формирование представлений о белках как о классе соединений и важнейшем компоненте организма.
- •3. Характеристика ферментов класса изомераз.
- •4. Строение, пищевые источники и биологические функции витамина к.
- •5. Терморегуляторная функция тканевого дыхания. Гипоэнергетические соединения.
- •7. Биосинтез жиров в жировой ткани.
- •2) Механизм репликации
- •Ферменты класс лиаз.
- •Витамин н-биотин, биос 2
- •5 ) Химизм окислительного декарбоксилирования пировиноградной кислоты.
- •7) Синтез жирных кислот в печени (на схеме сверху)
- •Важнейшие этапы развития биохимии. Разделы биохимии.
- •2) Процесс транскрипции
- •4) Витамин в3 – пантотеновая кислота
- •5) Гипо– и авитаминозы подразделяют на:
- •6) Наследственные нарушения обмена дисахаридов
- •7) Стероиды организма человека и их биологические функции.
- •3) Изоферменты. Органоспецифические ферменты
- •5) Причины и последствия вторичных авитаминозов.
- •6) Представители и биолог роль глюкозамингликанов
- •18Б, 7 вопрос
- •1. Структурная организация живого.
- •2. Зависимость биологических функций от структуры белков.
- •3. Типы транспорта веществ через клеточные мембраны.
- •4. Причины и последствия гипервитаминоза.
- •6. Структура и биологическая роль хондротинсульфатов.
- •7. Гиперхолестеринемия, причины и последствия.
- •1.Жизнь как существование белковых тел.
- •2.Химические связи и структура белковых молекл.
- •3.Наследственные энзимопатии.
- •4.Незаменимые органические компоненты пищи.
- •5.Химизм цтк.
- •6.Гиалуроновая кислота.
- •7.Биосинтез фосфолипидов.
- •2. Строение и функции рнк
- •4) Причины гипервитаминоза витамина д
- •1. Основные биохимические функции ж.В.
- •2. Понятия код, кодон, антикодон.
- •4 Гиповитаминоз pp -причины и последствия
- •5Механизмы трансформация энергии в клетке
- •6. Химизм метаболизма лактата в печени.
- •7. Понтие о сфонголипидозах.
- •Билет23
- •1)Функциональная биохимия
- •2. Типы генов днк и их функции
- •4. Гиповитаминоз с -причины и последствия
- •6)Состав и функции протеогликанов
- •Билет27
- •1. Основные биохимические функции ж.В.
- •2. Понятия код, кодон, антикодон.
- •3. Клеточные механизмы регуляции активности ферментов
- •4 Гиповитаминоз pp -причины и последствия
- •5Механизмы трансформация энергии в клетке
- •6. Химизм метаболизма лактата в печени.
- •7. Понтие о сфонголипидозах.
- •Билет23
- •1)Функциональная биохимия
- •2. Типы генов днк и их функции
- •4. Гиповитаминоз с -причины и последствия
- •5 Биоэнергетика митохондриального окисления дегидрогеназами
- •6)Состав и функции протеогликанов
- •1)Цели и задачи динамической биохимии.
- •2)Изоэлектрическое состояние и изоэлектрическая точка белков
- •7)Биохимические основы атеросклероза
- •Билет27
- •2. Уровни структурной организации
- •3, Особенности ферментативного катализа
- •2.Ферментативная реакция идет более "чисто", т.К. Фермент катализирует только одну реакцию не влияя на другие.
- •4,Строение, пищевые источники и биологические функции витамина к.
- •Билет31
- •6. Мобилизация гликогена.
- •Билет32
- •6. Фермент синтеза гликогена гликогенсинтетаза "а" (активная форма ), под воздействием цАмф-зависимой протеинкиназы переходит в неактивную гликогенсинтетазу "b".
- •Билет33
- •Объекты и методы статической биохимии
- •Т ретичная структура белка. Факторы, повреждающие третичную структуру белка
- •Коферменты алифатического ряда
- •Строение, пищевые источники и биологические функции витамина в6
- •Аденилатциклазный каскадный механизм мобилизации гликогена
- •Ресинтез триглицеридов в стенке кишечника. Значение. Химизм
- •Объекты и методы динамической биохимии
- •Четвертичная структура белка. Дайте определение и приведите примеры
- •Химизм и биоэнергетика реакции окисления изоцитрата в цтк
- •Билет42
- •Гидролазы –
- •Витамины группы е (токоферолы)
- •Билет43
- •6. Ключевая реакция апатомического пути катаболизма глюкозы
- •Билет44
- •1) Решение проблем сохранения здоровья человека;
- •2) Выяснение причин различных болезней и изыскание путей их эффективного лечения.
- •2. Химические связи в построении молекулы тетра- и пентопептидов.
- •6. При переходе в аэробные условия анаэробный гликолиз и накопление лактата прекращается, а скорость потребления глюкозы резко угнетается. Это явление носит
- •7. К стероидам относятся углеводороды производные циклопентан-пергидро-фенантрена, метилированные в положении 13 (эстран) или в положениях 10 и 13 (андростан)
Характеристика ферментов класса трансфераз.
2 класс ферментов — трансферазы. Ферменты этого класса катализируют перенос функциональных групп и делятся по этому принципу на 8 подклассов:
переносит одноуглеродные остатки (метил-, метелин-)
переносят альдегидные или кетоновые группы
переносят ацильные (кислотные) остатки
переносят гликозильные остатки
переносят алкильные или арильные группы
переносят азотсодержащие группы (амино-, амидино-)
переносят фофорсодержащие группы
переносят серосодержащие группы (тиогруппы)
Строение, пищевые источники и биологические функции витамина рр.
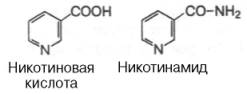
Витамин PP существует в двух формах - никотиновой кислоты и никотиномида.
Источники
Говяжья печень, дрожжи, брокколи, морковь, сыр, кукурузная мука, листья одуванчика, финики, яйца, рыба, молоко, арахис, свинина, картофель, помидоры, проростки пшеницы, продукты из цельных злаков.
Травы, богатые витамином PP: люцерна, корень лопуха, котовник кошачий, кайенский перец, ромашка, песчанка, очанка, семя фенхеля, пажитник сенной, женьшень, хмель, хвощ, коровяк, крапива, овес, петрушка, мята перечная, листья малины, красный клевер, плоды шиповника, шалфей, щавель.
Действие
Активное воздействие витамина PP на обменные процессы обусловлено его вхождением в состав ниацинамидадениндинуклеотида (НАД) и ниацинамидадениндинуклеотида фосфата (НАДФ), являющихся кофакторами ряда ферментов. В частности, ниацинамид входит в состав кодегидраз, являющихся переносчиками водорода к флавопротеиновым ферментам, и тем самым регулирует окислительно-восстановительные процессы в организме.
![]()
Окислительное фосфорилирование, коэффициент р/0 и адф/0
ОКИСЛИТЕЛЬНОЕ ФОСФОРИЛИРОВАНИЕ, синтез АТФ из аденозиндифосфата и неорг. фосфата, осуществляющийся в живых клетках, благодаря энергии, выделяющейся при окислении орг. в-в в процессе клеточного дыхания. В общем виде окислительное фосфорилирование и его место в обмене в-в можно представить схемой:
Энергия окисляющихся веществ используется для синетза АТФ из АДФ. В молекуле АТФ имеютсядве высокоэнергетические (макроэргические) связи:
![]()
В молекуле АДФ только одна высокоэнергетическая связь, в результате синтеза АТФ путем окислительного фосфорилирования добавляется еще одна , т.е. Энергия окисления субстрата трансформируется в энергию химических связей в молекуле АТФ. Т.е. Главный путь синтеза АТФ из АДФ — окислительное фосфорилирование, при этом Адф фосфорилируется неорганическим фосфатом:
АДФ + Н3 РО4 + энергия --- АТФ + Н2 О
Синтез АТФ осуществляется на уроне трех участков дыхательной цепи митохондрий, где имеется достаточной величины разность редокс-потенциалов. Первый участок м/у НАД и ФМН (0,21в), второй — м/у b и c (0,22в), третий м/у цитохромоксидазой(а+а3) и кислородом (0,29в).
Для качественной оценки был введен покзатель окислительного фосфолирирования- коэффициент Р/0 — отношение количества молекул фосфорной кислоты к количеству атомов кислорода использованных митоондриями при окислении какого-либо субстрата.
Другим показателем, характеризующим активность митохондрий в 3-м состоянии, является коэффициент АДФ/О. Величина АДФ/О характеризует функциональную организацию механизмов, определяющих процесс фосфорилирования АДФ в митохондриальной мембране и связь их с активностью терминальной дыхательной цепи.
Чем больше величина АДФ/О, тем меньше затрачивается кислорода на фосфорилирование, тем соответственно выше коэффициент полезного действия митохондрий с точки зрения запасания энергии для дальнейших внутриклеточных метаболических процессов.
Биосинтез гликогена. Биологичечкая роль этого процесса.
Значительная часть глюкозы, поступающей в клетки при пищеварении, превращается в гликоген — запасной полисахарид, используемый в интервалах м/у приемами пищи. Синтез осуществляется во всех клетках организма,но особенно активно потекает в скелетных мышцах и печени.
Ключевым ферментом синтеза гикогена является активная форма — гликогенсинтетаза «а», которая цАМФ зависимой протеинкиназой переводит ее в неактивную форму — гликогенсинтетазу «b».
Гликоген по строению сходен с крахмалом. Непосредственным донором глюкозных остатков при биосинтезе гликогена служит УДФ-глюкоза, которая образуется из УТФ и глюкозо-1-фосфата под воздействием фермента глюкозо-1-фосфат-уридил-трансферазы: глюкозо-у-фосфат + УТФ —УДФ-глюкоза + Н3РО4
Под воздействием гликогенсинтетазы (1,4-гликозилтрансферазы) происходит перенос остатков глюкозы с УДФ-глюкозы на олигосахаридный фермент (гликоген-затравка). Врезультате синтезируется линейная цепь гликогена, остатки глюкозы соеденены друг с другом 1-4 альфа-гликозидной связью:
УДФ-глюкоза + n(глюкоза)--- УДФ + 1,4-гликоген
Ветвления в молекуле гликогена возникают в результате действия фермента ветвления — амило-1,4-->1,6 гликозилтрансферазы, который переносит фрагмент (олигосахарид) из 5-7 мономеров от 1,4-гликогена и присоединяет его к центру оставшейся линейной цепи гликогена 1,6- гликозидной связью:
(1,4)-гликоген ----- 1,4-1,6-гликоген
РОЛЬ: необходимость превращения глюкозы в гликоген при запасании энергетического материала обусловлена тем, что накопление легкорастворимой глюкозы в клетках могло бы привести к осмотическому шоку- разрушению клеточной мембраны.
