
- •1.Биохимия в решении проблем лечения и диагностики заболеваний.
- •2.Аминокислотный состав белковых молекул.
- •3.Структурно-функциональная организация клетки и функции ее компартментов.
- •4.Методы изучения обмена веществ.
- •5.Понятие об обмене веществ и энергии.Второй закон термодинамики и обмен веществ.
- •6.Переваривание углеводов пищи в ротовой полости.
- •7.Жирные кислоты важнейших липидов тканей человека.
- •1.Нобелевкие лауреаты.
- •2.Физико-химические свойства белков.
- •3.Структурная организация и функция клеточных мембран.
- •4.Состав пищи человека. Орг. И мин. Компоненты.
- •6.Переваривание углеводов в тонком кишечнике.
- •7.Структура и функции фосфолипидов тканей человека.
- •1.Объекты,цели и задачи статической биохимии.
- •2.Методы определения белков.
- •3.Механизмы действия и особенности ферметативного катализа.
- •5.Катаболические реакции.
- •6.Общая схема путей превращения глюкозы.
- •7.Состав и биологические функции транспортных липидов.
- •1. Объекты, цели и задачи динамической биохимии.
- •2. Уровни структурной организации белковых молекул.
- •3. Зависимость скорости ферментативных реакций от температуры и рН среды.
- •4. Незаменимые компоненты пищи (полиненасыщенные жирные кислоты).
- •5. Специфические и общие пути катаболизма.
- •6. Общая схема источников и путей превращения глюкозы в тканях.
- •7. Состав и биологические функции транспортных липидов.
- •1. Объекты, цели и задачи функциональной биохимии.
- •2. Зависимость биологических функций от структуры белков.
- •4. Регионарные патологии, связанные с недостатком микроэлементов.
- •5. Общие принципы регуляции метаболизма.
- •6. Химизм аэробного дихотомического пути распада глюкозы.
- •7 . Резервные и структурные липиды.
- •1. Биохимия в расшифровке механизмов физиологических функций клеток.
- •2. Классификация белков по их биологическим функциям.
- •8.Белки - биокатализаторы (ферменты).
- •3. Коферментные функции витамина в1. Витамин в1 (Тиамин)
- •4. Витамины – механизм их биологических эффектов.
- •5. Основные конечные продукты метаболизма у человека и пути их выведения.
- •6 . Челночные механизмы транспорта водорода надн в митохондрии.
- •7 . Переваривание жиров и всасывание продуктов переваривания липидов.
- •Единицы измерения активности и количества ферментов.
- •Пищевые источники и биологические функции витамина а.
- •Оксидазный тип катаболизма субстратов.
- •Химизм анаэробного пути распада углеводов.
- •Желчные кислоты. Строение и функции.
- •2. Строение и функции сложных белков
- •3.Влияние концентрации фермента и субстрата на ферментативный катализ.
- •6. Распространение и биологическая роль анаэробного гликолиза.
- •Место бх среди других наук в изучении материальных объектов.
- •Полиморфизм и гетерогенность белков в популяции человека
- •4.Полноценные и не полноценные белки
- •5. Макроэргические соединения – строение и функции.
- •6. Анаэробный гликолиз. Цикл кори.
- •7. Ресинтез липидов в кишечной стенке
- •2. Изменение белкового состава в онтогенезе и при болезнях.
- •3. Регуляция активности ферментов. Активаторы и ингибиторы.
- •5. Понятие о тканевом дыхании и биологическом окислении.
- •6. Химизм глюконеогенеза.
- •7. Бета-окисление как специфический путь катаболизм жирных кислот.
- •5. Структурная организация митохондриальной цепи переноса электронов и протонов.
- •6. Химизм и использование лактата сердечной мышцей.
- •7. Особенности метаболизма полиненасыщенных жирных кислот.
- •1. Роль биохимии в подготовке врача.
- •3. Характеристика ферментов класса оксидоредуктаз.
- •5. Анаэробные дегидрогеназы и первичные акцепторы водорода – над и надф.
- •6. Биологическая роль пентозофосфатного пути катаболизма глюкозы.
- •7. Карнитиновый челночный механизм транспорта жирных кислот в митохондрии
- •Структурная организация живого, свойства живых систем.
- •Структурная организация и функции хромосом и рибосом.
- •Характеристика ферментов класса трансфераз.
- •Строение, пищевые источники и биологические функции витамина рр.
- •Источники
- •Действие
- •Окислительное фосфорилирование, коэффициент р/0 и адф/0
- •Механизм резервирования и мобилизации жиров.
- •Билет14
- •Важнейшие этапы истории биохимии. Разделы биохимии.
- •Строение и функции генетического кода: код, кадон и антикадон.
- •Характеристика ферментов класса гидролаз.
- •Строение, пищевые источники и биологические функции витамина в12.
- •Разобщение тканевого дыхания и окислительного фосфорилирования.
- •Механизм мобилизации гликогена. Биологическая роль этого поцесса.
- •Синтез, использование и физиологическое значение кетоновых тел.
- •Формирование представлений о белках как о классе соединений и важнейшем компоненте организма.
- •3. Характеристика ферментов класса изомераз.
- •4. Строение, пищевые источники и биологические функции витамина к.
- •5. Терморегуляторная функция тканевого дыхания. Гипоэнергетические соединения.
- •7. Биосинтез жиров в жировой ткани.
- •2) Механизм репликации
- •Ферменты класс лиаз.
- •Витамин н-биотин, биос 2
- •5 ) Химизм окислительного декарбоксилирования пировиноградной кислоты.
- •7) Синтез жирных кислот в печени (на схеме сверху)
- •Важнейшие этапы развития биохимии. Разделы биохимии.
- •2) Процесс транскрипции
- •4) Витамин в3 – пантотеновая кислота
- •5) Гипо– и авитаминозы подразделяют на:
- •6) Наследственные нарушения обмена дисахаридов
- •7) Стероиды организма человека и их биологические функции.
- •3) Изоферменты. Органоспецифические ферменты
- •5) Причины и последствия вторичных авитаминозов.
- •6) Представители и биолог роль глюкозамингликанов
- •18Б, 7 вопрос
- •1. Структурная организация живого.
- •2. Зависимость биологических функций от структуры белков.
- •3. Типы транспорта веществ через клеточные мембраны.
- •4. Причины и последствия гипервитаминоза.
- •6. Структура и биологическая роль хондротинсульфатов.
- •7. Гиперхолестеринемия, причины и последствия.
- •1.Жизнь как существование белковых тел.
- •2.Химические связи и структура белковых молекл.
- •3.Наследственные энзимопатии.
- •4.Незаменимые органические компоненты пищи.
- •5.Химизм цтк.
- •6.Гиалуроновая кислота.
- •7.Биосинтез фосфолипидов.
- •2. Строение и функции рнк
- •4) Причины гипервитаминоза витамина д
- •1. Основные биохимические функции ж.В.
- •2. Понятия код, кодон, антикодон.
- •4 Гиповитаминоз pp -причины и последствия
- •5Механизмы трансформация энергии в клетке
- •6. Химизм метаболизма лактата в печени.
- •7. Понтие о сфонголипидозах.
- •Билет23
- •1)Функциональная биохимия
- •2. Типы генов днк и их функции
- •4. Гиповитаминоз с -причины и последствия
- •6)Состав и функции протеогликанов
- •Билет27
- •1. Основные биохимические функции ж.В.
- •2. Понятия код, кодон, антикодон.
- •3. Клеточные механизмы регуляции активности ферментов
- •4 Гиповитаминоз pp -причины и последствия
- •5Механизмы трансформация энергии в клетке
- •6. Химизм метаболизма лактата в печени.
- •7. Понтие о сфонголипидозах.
- •Билет23
- •1)Функциональная биохимия
- •2. Типы генов днк и их функции
- •4. Гиповитаминоз с -причины и последствия
- •5 Биоэнергетика митохондриального окисления дегидрогеназами
- •6)Состав и функции протеогликанов
- •1)Цели и задачи динамической биохимии.
- •2)Изоэлектрическое состояние и изоэлектрическая точка белков
- •7)Биохимические основы атеросклероза
- •Билет27
- •2. Уровни структурной организации
- •3, Особенности ферментативного катализа
- •2.Ферментативная реакция идет более "чисто", т.К. Фермент катализирует только одну реакцию не влияя на другие.
- •4,Строение, пищевые источники и биологические функции витамина к.
- •Билет31
- •6. Мобилизация гликогена.
- •Билет32
- •6. Фермент синтеза гликогена гликогенсинтетаза "а" (активная форма ), под воздействием цАмф-зависимой протеинкиназы переходит в неактивную гликогенсинтетазу "b".
- •Билет33
- •Объекты и методы статической биохимии
- •Т ретичная структура белка. Факторы, повреждающие третичную структуру белка
- •Коферменты алифатического ряда
- •Строение, пищевые источники и биологические функции витамина в6
- •Аденилатциклазный каскадный механизм мобилизации гликогена
- •Ресинтез триглицеридов в стенке кишечника. Значение. Химизм
- •Объекты и методы динамической биохимии
- •Четвертичная структура белка. Дайте определение и приведите примеры
- •Химизм и биоэнергетика реакции окисления изоцитрата в цтк
- •Билет42
- •Гидролазы –
- •Витамины группы е (токоферолы)
- •Билет43
- •6. Ключевая реакция апатомического пути катаболизма глюкозы
- •Билет44
- •1) Решение проблем сохранения здоровья человека;
- •2) Выяснение причин различных болезней и изыскание путей их эффективного лечения.
- •2. Химические связи в построении молекулы тетра- и пентопептидов.
- •6. При переходе в аэробные условия анаэробный гликолиз и накопление лактата прекращается, а скорость потребления глюкозы резко угнетается. Это явление носит
- •7. К стероидам относятся углеводороды производные циклопентан-пергидро-фенантрена, метилированные в положении 13 (эстран) или в положениях 10 и 13 (андростан)
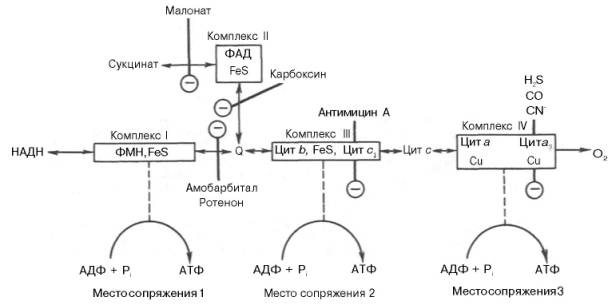
5. Структурная организация митохондриальной цепи переноса электронов и протонов.
В клетках эукариот дыхательная цепь расположена во внутренней мембранемитохондрий, у дышащих бактерий – в цитоплазматической мембране и специализированных структурах – мезосомах, или тилакоидах.
Компоненты дыхательной цепи во внутренней мембране михохондрий формируют комплексы: I комплекс (НАДН-КоQН2-редуктаза) – принимает электороны от митохондриального НАДН и транспортирует их на КоQ. Протоны транспортируются в межмембранное пространство. Промежуточным акцептором и переносчиком протонов и электронов являются ФМН и железосерные белки. I комплекс разделяет поток электронов и протонов. II комплекс – сукцинат – КоQ - редуктаза – включает ФАД- зависимые дегидрогеназы и железосерные белки. Он транспортирует электроны и протоны от флавинзависимых субстратов на убихинон, с образованием промежуточного ФАДН2. Убихинон легко перемещается по мембране и передает электроны на III комплекс. III комплекс – КоQН2 - цитохром с - редуктаза – имеет в своем составе цитохромы b и с1, а также железосерные белки. Функционирование КоQ с III комплексом приводит к разделению потока протонов и электронов: протоны из матрикса перекачиваются в межмембранное пространство митохондрий, а электроны транспортируются далее по ЦТД. IV комплекс – цитохром а - цитохромоксидаза – содержит цитохромоксидазу и транспортирует электроны на кислород с промежуточного переносчика цитохрома с, который является подвижным компонентом цепи. Существует 2 разновидности ЦТД: Полная цепь – в нее вступают пиридинзависимые субстраты и предают атомы водорода на НАД-зависимые дегидрогеназы Неполная (укороченная или редуцированная) ЦТД в которой атомы водорода передаются от ФАД-зависимых субстратов, в обход первого комплекса.
6. Химизм и использование лактата сердечной мышцей.
Во время мышечной деятельности происходит усиление и учащение сердечных сокращений, что требует большего количества энергии по сравнению с состоянием покоя. Во время интенсивной работы, сопровождающейся увеличением концентрации лактата в крови, миокард извлекает из крови лактат и окисляет его до углекислого газа и воды. При окислении одной молекулы молочной кислоты синтезируется до 18 молекул АТФ. Способность миокарда окислять лактат имеет большое биологическое значение. Использование лактата в качестве источника энергии позволяет дольше поддерживать в крови необходимую концентрацию глюкозы, что очень существенно для биоэнергетики нервных клеток, для которых глюкоза является почти единственным субстратом окисления. Окисление лактата в сердечной мышце также способствует нормализации кислотно-щелочного баланса, так как при этом в крови снижается концентрация этой кислоты.
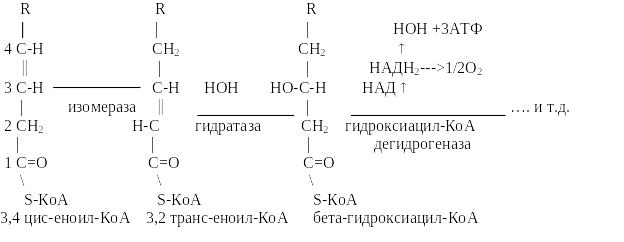
7. Особенности метаболизма полиненасыщенных жирных кислот.
Природные ненасыщенные жирные кислоты имеют цис-конфигурацию, тогда как при окислении насыщенных жирных кислот образующийся еноил-КоА в находится в транс-конфигурации.
В этой связи, ненасыщенные жирные кислоты до места расположения двойной связи окисляются как насыщенные.
Затем под воздействием 4,3-цис-2,3-транс-изомеразы двойная связь из положения 3-4 перемещается в положение 3-2 и приобретает транс-форму, а далее процесс идет обычным путем.
Схема окисления ненасыщ ирных кислот
Синтез простогландинов
Арахидоновая кислота как источник простагландинов подвергается действию фермента циклооксигеназы, входящей в состав полиферментного комплекса - простагландинсинтетазы.
Циклооксигеназа катализирует этот процесс только в присутствии кислорода.
В результате образуются биологически активные промежуточные продукты - эндопероксиды простагландинов, называемые также простагландины G2 и Н2 (ПГG2, ПГН2 ).
В стенке сосудов из эндопероксида типа ПГG2 синтезируется простациклин I (ПГI2) - сильнейший природный ингибитор агрегации тромбоцитов.
В большинстве тканей из ПГН2 синтезируются простагландины типа ПГЕ2, ПГF2a, ПГА2, ПГD2 и тромбоксаны. При изомеризации двойной связи в циклопентановом кольце ПГА2 образуются ПГС2 и ПГВ2.
В лейкоцитах метаболизм арахидоновой кислоты идет по иному пути.
С участием фермента липооксигеназы она превращается в нециклические ненасыщенные производные, которые получили название лейкотриенов (ЛТ) типа А,В,С,D,Е (ЛТА, ЛТВ, ЛТС, ЛТD, ЛТЕ).
Билет12
