
- •1.Биохимия в решении проблем лечения и диагностики заболеваний.
- •2.Аминокислотный состав белковых молекул.
- •3.Структурно-функциональная организация клетки и функции ее компартментов.
- •4.Методы изучения обмена веществ.
- •5.Понятие об обмене веществ и энергии.Второй закон термодинамики и обмен веществ.
- •6.Переваривание углеводов пищи в ротовой полости.
- •7.Жирные кислоты важнейших липидов тканей человека.
- •1.Нобелевкие лауреаты.
- •2.Физико-химические свойства белков.
- •3.Структурная организация и функция клеточных мембран.
- •4.Состав пищи человека. Орг. И мин. Компоненты.
- •6.Переваривание углеводов в тонком кишечнике.
- •7.Структура и функции фосфолипидов тканей человека.
- •1.Объекты,цели и задачи статической биохимии.
- •2.Методы определения белков.
- •3.Механизмы действия и особенности ферметативного катализа.
- •5.Катаболические реакции.
- •6.Общая схема путей превращения глюкозы.
- •7.Состав и биологические функции транспортных липидов.
- •1. Объекты, цели и задачи динамической биохимии.
- •2. Уровни структурной организации белковых молекул.
- •3. Зависимость скорости ферментативных реакций от температуры и рН среды.
- •4. Незаменимые компоненты пищи (полиненасыщенные жирные кислоты).
- •5. Специфические и общие пути катаболизма.
- •6. Общая схема источников и путей превращения глюкозы в тканях.
- •7. Состав и биологические функции транспортных липидов.
- •1. Объекты, цели и задачи функциональной биохимии.
- •2. Зависимость биологических функций от структуры белков.
- •4. Регионарные патологии, связанные с недостатком микроэлементов.
- •5. Общие принципы регуляции метаболизма.
- •6. Химизм аэробного дихотомического пути распада глюкозы.
- •7 . Резервные и структурные липиды.
- •1. Биохимия в расшифровке механизмов физиологических функций клеток.
- •2. Классификация белков по их биологическим функциям.
- •8.Белки - биокатализаторы (ферменты).
- •3. Коферментные функции витамина в1. Витамин в1 (Тиамин)
- •4. Витамины – механизм их биологических эффектов.
- •5. Основные конечные продукты метаболизма у человека и пути их выведения.
- •6 . Челночные механизмы транспорта водорода надн в митохондрии.
- •7 . Переваривание жиров и всасывание продуктов переваривания липидов.
- •Единицы измерения активности и количества ферментов.
- •Пищевые источники и биологические функции витамина а.
- •Оксидазный тип катаболизма субстратов.
- •Химизм анаэробного пути распада углеводов.
- •Желчные кислоты. Строение и функции.
- •2. Строение и функции сложных белков
- •3.Влияние концентрации фермента и субстрата на ферментативный катализ.
- •6. Распространение и биологическая роль анаэробного гликолиза.
- •Место бх среди других наук в изучении материальных объектов.
- •Полиморфизм и гетерогенность белков в популяции человека
- •4.Полноценные и не полноценные белки
- •5. Макроэргические соединения – строение и функции.
- •6. Анаэробный гликолиз. Цикл кори.
- •7. Ресинтез липидов в кишечной стенке
- •2. Изменение белкового состава в онтогенезе и при болезнях.
- •3. Регуляция активности ферментов. Активаторы и ингибиторы.
- •5. Понятие о тканевом дыхании и биологическом окислении.
- •6. Химизм глюконеогенеза.
- •7. Бета-окисление как специфический путь катаболизм жирных кислот.
- •5. Структурная организация митохондриальной цепи переноса электронов и протонов.
- •6. Химизм и использование лактата сердечной мышцей.
- •7. Особенности метаболизма полиненасыщенных жирных кислот.
- •1. Роль биохимии в подготовке врача.
- •3. Характеристика ферментов класса оксидоредуктаз.
- •5. Анаэробные дегидрогеназы и первичные акцепторы водорода – над и надф.
- •6. Биологическая роль пентозофосфатного пути катаболизма глюкозы.
- •7. Карнитиновый челночный механизм транспорта жирных кислот в митохондрии
- •Структурная организация живого, свойства живых систем.
- •Структурная организация и функции хромосом и рибосом.
- •Характеристика ферментов класса трансфераз.
- •Строение, пищевые источники и биологические функции витамина рр.
- •Источники
- •Действие
- •Окислительное фосфорилирование, коэффициент р/0 и адф/0
- •Механизм резервирования и мобилизации жиров.
- •Билет14
- •Важнейшие этапы истории биохимии. Разделы биохимии.
- •Строение и функции генетического кода: код, кадон и антикадон.
- •Характеристика ферментов класса гидролаз.
- •Строение, пищевые источники и биологические функции витамина в12.
- •Разобщение тканевого дыхания и окислительного фосфорилирования.
- •Механизм мобилизации гликогена. Биологическая роль этого поцесса.
- •Синтез, использование и физиологическое значение кетоновых тел.
- •Формирование представлений о белках как о классе соединений и важнейшем компоненте организма.
- •3. Характеристика ферментов класса изомераз.
- •4. Строение, пищевые источники и биологические функции витамина к.
- •5. Терморегуляторная функция тканевого дыхания. Гипоэнергетические соединения.
- •7. Биосинтез жиров в жировой ткани.
- •2) Механизм репликации
- •Ферменты класс лиаз.
- •Витамин н-биотин, биос 2
- •5 ) Химизм окислительного декарбоксилирования пировиноградной кислоты.
- •7) Синтез жирных кислот в печени (на схеме сверху)
- •Важнейшие этапы развития биохимии. Разделы биохимии.
- •2) Процесс транскрипции
- •4) Витамин в3 – пантотеновая кислота
- •5) Гипо– и авитаминозы подразделяют на:
- •6) Наследственные нарушения обмена дисахаридов
- •7) Стероиды организма человека и их биологические функции.
- •3) Изоферменты. Органоспецифические ферменты
- •5) Причины и последствия вторичных авитаминозов.
- •6) Представители и биолог роль глюкозамингликанов
- •18Б, 7 вопрос
- •1. Структурная организация живого.
- •2. Зависимость биологических функций от структуры белков.
- •3. Типы транспорта веществ через клеточные мембраны.
- •4. Причины и последствия гипервитаминоза.
- •6. Структура и биологическая роль хондротинсульфатов.
- •7. Гиперхолестеринемия, причины и последствия.
- •1.Жизнь как существование белковых тел.
- •2.Химические связи и структура белковых молекл.
- •3.Наследственные энзимопатии.
- •4.Незаменимые органические компоненты пищи.
- •5.Химизм цтк.
- •6.Гиалуроновая кислота.
- •7.Биосинтез фосфолипидов.
- •2. Строение и функции рнк
- •4) Причины гипервитаминоза витамина д
- •1. Основные биохимические функции ж.В.
- •2. Понятия код, кодон, антикодон.
- •4 Гиповитаминоз pp -причины и последствия
- •5Механизмы трансформация энергии в клетке
- •6. Химизм метаболизма лактата в печени.
- •7. Понтие о сфонголипидозах.
- •Билет23
- •1)Функциональная биохимия
- •2. Типы генов днк и их функции
- •4. Гиповитаминоз с -причины и последствия
- •6)Состав и функции протеогликанов
- •Билет27
- •1. Основные биохимические функции ж.В.
- •2. Понятия код, кодон, антикодон.
- •3. Клеточные механизмы регуляции активности ферментов
- •4 Гиповитаминоз pp -причины и последствия
- •5Механизмы трансформация энергии в клетке
- •6. Химизм метаболизма лактата в печени.
- •7. Понтие о сфонголипидозах.
- •Билет23
- •1)Функциональная биохимия
- •2. Типы генов днк и их функции
- •4. Гиповитаминоз с -причины и последствия
- •5 Биоэнергетика митохондриального окисления дегидрогеназами
- •6)Состав и функции протеогликанов
- •1)Цели и задачи динамической биохимии.
- •2)Изоэлектрическое состояние и изоэлектрическая точка белков
- •7)Биохимические основы атеросклероза
- •Билет27
- •2. Уровни структурной организации
- •3, Особенности ферментативного катализа
- •2.Ферментативная реакция идет более "чисто", т.К. Фермент катализирует только одну реакцию не влияя на другие.
- •4,Строение, пищевые источники и биологические функции витамина к.
- •Билет31
- •6. Мобилизация гликогена.
- •Билет32
- •6. Фермент синтеза гликогена гликогенсинтетаза "а" (активная форма ), под воздействием цАмф-зависимой протеинкиназы переходит в неактивную гликогенсинтетазу "b".
- •Билет33
- •Объекты и методы статической биохимии
- •Т ретичная структура белка. Факторы, повреждающие третичную структуру белка
- •Коферменты алифатического ряда
- •Строение, пищевые источники и биологические функции витамина в6
- •Аденилатциклазный каскадный механизм мобилизации гликогена
- •Ресинтез триглицеридов в стенке кишечника. Значение. Химизм
- •Объекты и методы динамической биохимии
- •Четвертичная структура белка. Дайте определение и приведите примеры
- •Химизм и биоэнергетика реакции окисления изоцитрата в цтк
- •Билет42
- •Гидролазы –
- •Витамины группы е (токоферолы)
- •Билет43
- •6. Ключевая реакция апатомического пути катаболизма глюкозы
- •Билет44
- •1) Решение проблем сохранения здоровья человека;
- •2) Выяснение причин различных болезней и изыскание путей их эффективного лечения.
- •2. Химические связи в построении молекулы тетра- и пентопептидов.
- •6. При переходе в аэробные условия анаэробный гликолиз и накопление лактата прекращается, а скорость потребления глюкозы резко угнетается. Это явление носит
- •7. К стероидам относятся углеводороды производные циклопентан-пергидро-фенантрена, метилированные в положении 13 (эстран) или в положениях 10 и 13 (андростан)
1. Объекты, цели и задачи функциональной биохимии.
Функциональная биохимия изучает биохимические реакции, лежащие в основе физиологических функций. Она изучает биохимические основы переваривания питательных веществ в желудочно-кишечном тракте; механизмы мышечного сокращения, проведения нервного импульса, дыхательной функции крови, регуляции кислотно-щелочного равновесия, функции печени и почек, иммунной системы и др., зависимость биологических функций от структуры белков.
2. Зависимость биологических функций от структуры белков.
Простые белки.
1.Протамины и гистоны - это обширная группа белков щелочного характера, поскольку в составе в большом количестве присутствуют диамино-монокарбоновые кислоты (лиз, арг, гис). Это белки с небольшой молекулярной массой, хорошо гидратируются. Гистоны принимают участие в формировании хромосом и являются регуляторами функций генов оперона.
2.Проламины и глютелины являются растительными белками, проявляют свойства энзимов и являются резервными белками семян растений. Это белки клейковины пшеницы - глиадин и глютенин, белок риса - оризеин, ячменя - гордеин, кукурузы - зеин. Глютелины ни в воде, ни в разбавленном нейтральном солевом растворе не растворяются. Протамины не растворяются в чистой воде и растворяются в слабых солевых растворах и в 70% спирте.
3.Протеиноиды или склеропротеины это не растворимые в воде белки опорных тканей. Они почти не подвергаются действию пищеварительных энзимов в желудочно-кишечном тракте и поэтому не пригодны в пищу человеку. К этой группе относится белок коллаген и эластин соединительной ткани, кератин волос, ногтей, перьев. При длительном кипячении коллагена с водой свойства коллагена меняются, и он становится водо-растворимым, способным к гелеобразованию (желатинированию). Этот видоизмененный коллаген называется желатин.
4.Альбумины и глобулины - наиболее широко распространенная группа простых белков.
К ним относятся белки молока, сыворотки крови, яичный белок, белки мышц и др.
Альбумины и глобулины отличаются друг от друга разной растворимостью, что можно использовать для их выделения и фракционирования:
Сложные белки
1.Фосфопротеиды состоят из простого белка и простетической группы представленной радикалом фосфорной кислоты, присоединенной к апопротеину через ОН- группу серина эфирной связью. К фосфопротеидам относится казениноген молока, ововителин и фосвитин яичного желтка, овальбумин, пепсин, фосфорилазы и др. белки.
2.Хромопротеиды , простетическая группа представлена различными окрашенными соединениями. К этой группе белков относится гемоглобин, миоглобин и цитохромы, у которых гем и его производные являются небелковым компонентом. К хромопротеидам относятся флавопротеиды, простетическая группа которых представлена производными рибофлавина, родопсин - светочувствительный белок сетчатки, простетическая группа которого - ретиналь (вит А).
3.Нуклеопротеиды - простетическая группа представлена нуклеиновыми кислотами.
Различают два типа нуклеопротеидов:
дезоксирибонуклеопротеиды, простетическая группа которых представлена ДНК и
рибонуклеопротеиды, простетическая группа которых представлена РНК
Апопротеины нуклеопротеидов представлены протаминами или гистонами - простыми белками щелочного характера.
4.Липопротеиды (протеолипиды) представляют комплексы белков и жироподобными соединениями, структура которых крайне неустойчива.
Липопротеиды принимают участие в формировании мембран и образуют транспортные формы в сыворотке крови: альфа и бета-липопротеиды.
- Гликопротеиды это белки, простетическая группа которых представлена в основном нейтральными мукополисахаридами (сиаловыми кислотами).
К ним относятся некоторые гормоны, ферменты и белки плазмы крови (ФСГ, ГТГ, холинэстераза, протромбин, фибриноген, иммуноглобулины, группоспецифические белки крови и др.).
-Протеогликаны (гликопротеиды) представлены муцинами и мукоидами.
К муцинам относятся муцин слюны и муцины слизистой желудочно-кишечного тракта. Простетическая группы у этих белков представлена гиалуроновой кислотой.
Мукоиды образуют в воде очень вязкий раствор и встречаются в основном веществе соединительной ткани, в выделениях слизистых оболочек, в синовиальных жидкостях, в стекловидном теле глаза, в яичном белке.
К мукоидам относятся овомукоиды, остеомукоиды, хондромукоиды, гиаломукоиды. Простетическая группа этих белков образована хондроитинсульфатами.
Мукоид - гепаринфибринолизин содержит мукополисахарид - гепарин.
6. Металлопротеиды - белки, в состав которых входят металлы.
К этой группе относится трансферрин, ферритин - содержащие железо, церулоплазмин - содержащий медь и другие белки.
3. Коферментные функции витамина В2.
Витамин В2 (Рибофлавин)
В основе молекулы рибофлавина лежит гетероциклическое соединение — изоаллоксазин (сочетание бензольного, пиразинового и пиримидинового колец), к которому в положении 9 присоединен пятиатомный спирт рибитол. Химическое название «рибофлавин» отражает наличие рибитола и желтой окраски препарата ; рациональное название его 6,7-диметил-9-В-ри6итилизоаллоксазин:
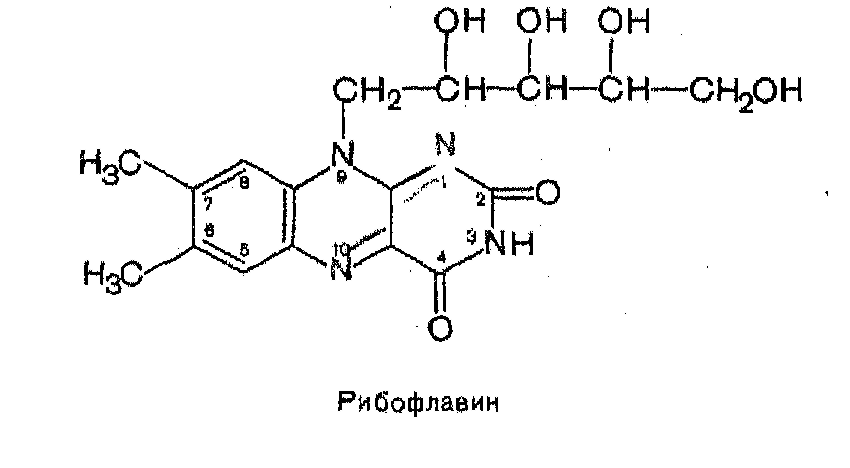
Рибофлавин входит в состав флавиновых коферментов, в частности ФМН и ФАД1, являющихся в свою очередь простетическими группами ферментов-флавопротеинов. Различают два типа химических реакций, катализируемых этими ферментами. К первому относятся реакции, в которых фермент осуществляет прямое окисление с участием кислорода, т. е. дегидрирование (отщепление электронов и протонов) исходного субстрата или промежуточного метаболита. К ферментам этой группы относятся оксидазы L- и D-аминокислот, глициноксидаза, альдегидоксидаза, ксантиноксидаза и др. Вторая группа реакций, катализируемых флавопротеинами, характеризуется переносом электронов и протонов не от исходного субстрата, а от восстановленных пиридиновых коферментов. Ферменты этой группы играют главную роль в биологическом окислении. В каталитическом цикле изоаллоксазиновый остаток ФАД и ФМН подвергается обратимому восстановлению с присоединением атомов водорода к N1 и N10.
ФМН синтезируется в организме животных из свободного рибофлавина и АТФ при участии специфического фермента - рибофлавинкиназы:
![]()
Образование ФАД в тканях также протекает при участии специфического АТФ-зависимого фермента ФМН-аденилилтрансферазы. Исходным веществом для синтеза является ФМН:
![]()
