
- •Предмет и роль органической химии. Теория химического строения органических соединений а.М. Бутлерова и ее значение.
- •Явление изомерии органических соединений, ее типы.
- •Электронные представления в органической химии. Строение атома углерода. Гибридизация орбиталей (валентные состояния атома углерода). Ковалентная связь и ее виды (простая, или δ- и кратные).
- •Классификация органических реакций (по характеру химических превращений и по механизму протекания). Гомолитические (радикальные) и гетеролитические (ионные) реакции.
- •Получение.
- •1. Галогенирование
- •2. Нитрование алканов
- •Строение алкадиенов: а) молекулярное
- •Алкины. Гомологический ряд ацетиленовых углеводородов, общая формула. Изомерия, номенклатура, получение. Строение, химические свойства. Практическое использование ацетилена и винилацетилена.
- •Получение:
- •1) В промышленном масштабе для технических целей ацетилен получают высокотемпературным пиролизом метана.
- •Реакции присоединения:
- •1) Гидрирование. Гидрирование алкинов осуществляется при нагревании с теми же металлическими катализаторами (Ni, Pd или Pt), что и в случае алкенов, но с меньшей скоростью.
- •Спирты. Предельные одноатомные спирты. Классификация, изомерия, номенклатура, получение. Физические и химические свойства.
- •Химические свойства спиртов.
- •Многоатомные спирты. Классификация. Этиленгликоль и глицерин. Получение. Химические свойства, идентификация. Практическое использование.
- •Фенолы. Изомерия и номенклатура. Химические свойства. Химическая идентификация фенола. Практическое использование в синтезе высокомолекулярных органических соединений.
- •Химические свойства
- •1. Реакции с участием гидроксильной группы
- •2. Реакции с участием бензольного кольца
- •Предельные двухосновные карбоновые кислоты. Номенклатура. Химические свойства. Адипиновая и терефталевая кислоты, практическое использование в синтезе полимеров.
- •Номенклатура. Систематические названия двухосновных предельных карбоновых кислот даются по названию соответствующего алкана с добавлением суффикса -диовая и слова кислота.
- •Амины. Классификация. Изомерия, номенклатура. Способы получения. Строение аминов и химические свойства. Практическое использование.
- •Классификация По радикалу:
- •По функциональным группам
- •Имеют структуру типа rch(nh2)co2h.
- •Общие химические свойства
- •Пептид — семейство веществ, молекулы которых построены из остатков α-аминокислот, соединённых в цепь пептидными (амидными) связями —c(o)nh—.
- •Углеводы. Химическая природа. Классификация. Распространение в природе, биологическая роль и практическое значение.
- •Биологическая роль углеводов:
- •Углеводы. Моносахариды (глюкоза, фруктоза). Строение (открытая и циклическая формы). Способы получения. Химическая идентификация (восстанавливающие свойства).
- •Получение углеводов
- •В растениях углеводы образуются из двуокиси углерода и воды в процессе сложной реакции фотосинтеза, осуществляемой за счет солнечной энергии с участием зелёного пигмента растений - хлорофилла.
- •Дисахариды (мальтоза, целлобиоза, сахароза). Строение. Получение. Химические свойства. Химическая идентификация восстанавливающих дисахаридов.
- •Целлобиоза — состоит из двух остатков глюкозы.
- •Способы получения дисахаридов:
- •Химические свойства
- •Отличительные особенности полимерного состояния вещества. Физические свойства полимеров и геометрическая форма макромолекул.
- •Методы синтеза полимеров. Реакция полимеризации, основные закономерности. Реакция поликонденсации, отличительные особенности. Примеры получения полимеризационных и поликонденсационных полимеров.
- •Химические превращения полимеров. Полимераналогичные реакции и их практическое использование.
- •Химические превращения полимеров. Макромолекулярные реакции (межмолекулярные и деструктивные). Деструкция полимеров, ее виды. Стабилизация полимеров и виды стабилизаторов.
- •Волокна. Общая характеристика. Строение макромолекул и свойства. Натуральные волокна (белковые и целлюлозные). Природные источники, химический состав, свойства и применение.
- •Искусственные волокна (ацетатные, вискозное), синтетические волокна (полиамидные, полиэфирные, полиакрилонитрильные, поливинилхлоридные). Свойства и применение.
Строение алкадиенов: а) молекулярное
C4H6 – бутадиен
б) структурное
CH2 = CH– CH= CH2 - бутадиен-1,3
Напомним, что свойства алкадиенов с изолированными двойными связями мало отличаются от свойств алкенов. Алкадиены с сопряженными связями обладают некоторыми особенностями.
Реакции присоединения. Алкадиены способны присоединять водород, галогены, галогеноводороды.
Реакции полимеризации. Важнейшим свойством диенов является способность полимеризоваться под воздействием катионов или свободных радикалов.
Дивинил (бутадиен) - один из основных мономеров синтетического каучука, используемый в производстве резины, исходя из бутадиен-стирольного каучука.
Существуют два принципиальных технологических подхода к получению дивинила. Это дегидрирование бутан-бутиленовой фракции нефти и традиционная реакция В. Н. Ипатьева - С.В. Лебедева, основанная на одновременном отщеплении водорода и воды из двух молекул этанола.
Полимеризацией бутадиена получают синтетические каучуки.
Сополимеризацией бутадиена с акрилонитрилом и стиролом получают АБС-пластик.
Изопрен — ненасыщенный углеводород диенового ряда (CnH2n−2). В нормальных условиях бесцветная жидкость.
В промышленном масштабе освоены шесть методов получения изопрена:
- из изобутилена и формальдегида;
- дегидрированием изопентана;
- окислительным дегидрированием изопентана;
- из пропилена;
- из ацетилена и ацетона;
- жидкофазным окислением углеводородов.
Изопрен применяют для получения синтетического каучука.
Каучук имеет громадное значение в народном хозяйстве. Синтез проходит в две стадии.
1. Получение бутадиена из этилового спирта в присутствии катализатора (Аl2О3, ZnO):
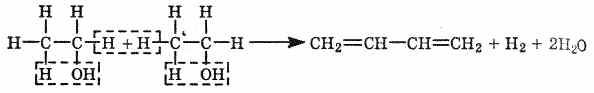 2.
Полимеризация бутадиена в присутствии
металлического натрия:
2.
Полимеризация бутадиена в присутствии
металлического натрия:
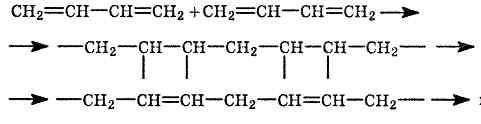 Строение
бутадиенового каучука описывается
формулой (-СН2-СН=СН-СН2-)n
Строение
бутадиенового каучука описывается
формулой (-СН2-СН=СН-СН2-)n
№10.
Алкины. Гомологический ряд ацетиленовых углеводородов, общая формула. Изомерия, номенклатура, получение. Строение, химические свойства. Практическое использование ацетилена и винилацетилена.
Алкины — углеводороды, содержащие тройную связь между атомами углерода, образующие гомологический ряд с общей формулой CnH2n-2.
Гомологический ряд алкинов:
Этин: C2H2
Пропин: C3H4
Бутин: C4H6
Пентин: C5H8
Гексин: C6H10
Гептин: C7H12
Октин: C8H14
Нонин: C9H16
Децин: C10H18
Алкинам свойственна изомерия углеродного скелета (начиная с C5H8), изомерия положения тройной связи (начиная с C4H6) и межклассовая изомерия с алкадиенами.
По номенклатуре IUPAC названия алкинов образуются от названий соответствующих алканов заменой суффикса «-ан» на «-ин»; положение тройной связи указывается арабскими цифрами. Углеводородные радикалы, образованные от алкинов имеют суффикс «-инил», так CH≡C- называется «этинил».
Получение:
1) В промышленном масштабе для технических целей ацетилен получают высокотемпературным пиролизом метана.
2CH4 ––1500°C→ HC≡CH + 3H2
2) Алкины можно получить из дигалогенопроизводных парафинов отщеплением галогеноводорода при действии спиртового раствора щелочи. Атомы галогена при этом могут быть расположены как у соседних атомов углерода, так и у одного углеродного атома.
3) Ацетилен получают также из ацетиленида (карбида) кальция при разложении его водой.
Углеродные атомы в молекуле ацетилена находятся в состоянии sp-гибридизации. Это означает, что каждый атом углерода обладает двумя гибридными sp- орбиталями, оси которых расположены на одной линии под углом 180° друг к другу, а две p- орбитали остаются негибридными.
![]() sp-
Гибридные орбитали двух атомов углерода
в состоянии, предшествующем образованию
тройной связи и связей C–H
sp-
Гибридные орбитали двух атомов углерода
в состоянии, предшествующем образованию
тройной связи и связей C–H
По одной из двух гибридных орбиталей каждого атома углерода взаимно перекрываются, приводя к образованию s- связи между атомами углерода. Каждая оставшаяся гибридная орбиталь перекрывается с s- орбиталью атома водорода, образуя s- связь С–Н.

 Схематическое
изображение строения молекулы ацетилена
(ядра атомов углерода и водорода на
одной прямой,
две p-
связи между атомами углерода находятся
в двух взаимно перпендикулярных
плоскостях)
Схематическое
изображение строения молекулы ацетилена
(ядра атомов углерода и водорода на
одной прямой,
две p-
связи между атомами углерода находятся
в двух взаимно перпендикулярных
плоскостях)
Две негибридные p- орбитали каждого атома углерода, расположенные перпендикулярно друг другу и перпендикулярно направлению s- связей, взаимно перекрываются и образуют две p- связи. Таким образом, тройная связь характеризуется сочетанием одной s- и двух p- связей.
Для алкинов характерны все реакции присоединения, свойственные алкенам, однако у них после присоединения первой молекулы реагента остается еще одна p- связь (алкин превращается в алкен), которая вновь может вступать в реакцию присоединения со второй молекулой реагента.
