
- •Предмет и роль органической химии. Теория химического строения органических соединений а.М. Бутлерова и ее значение.
- •Явление изомерии органических соединений, ее типы.
- •Электронные представления в органической химии. Строение атома углерода. Гибридизация орбиталей (валентные состояния атома углерода). Ковалентная связь и ее виды (простая, или δ- и кратные).
- •Классификация органических реакций (по характеру химических превращений и по механизму протекания). Гомолитические (радикальные) и гетеролитические (ионные) реакции.
- •Получение.
- •1. Галогенирование
- •2. Нитрование алканов
- •Строение алкадиенов: а) молекулярное
- •Алкины. Гомологический ряд ацетиленовых углеводородов, общая формула. Изомерия, номенклатура, получение. Строение, химические свойства. Практическое использование ацетилена и винилацетилена.
- •Получение:
- •1) В промышленном масштабе для технических целей ацетилен получают высокотемпературным пиролизом метана.
- •Реакции присоединения:
- •1) Гидрирование. Гидрирование алкинов осуществляется при нагревании с теми же металлическими катализаторами (Ni, Pd или Pt), что и в случае алкенов, но с меньшей скоростью.
- •Спирты. Предельные одноатомные спирты. Классификация, изомерия, номенклатура, получение. Физические и химические свойства.
- •Химические свойства спиртов.
- •Многоатомные спирты. Классификация. Этиленгликоль и глицерин. Получение. Химические свойства, идентификация. Практическое использование.
- •Фенолы. Изомерия и номенклатура. Химические свойства. Химическая идентификация фенола. Практическое использование в синтезе высокомолекулярных органических соединений.
- •Химические свойства
- •1. Реакции с участием гидроксильной группы
- •2. Реакции с участием бензольного кольца
- •Предельные двухосновные карбоновые кислоты. Номенклатура. Химические свойства. Адипиновая и терефталевая кислоты, практическое использование в синтезе полимеров.
- •Номенклатура. Систематические названия двухосновных предельных карбоновых кислот даются по названию соответствующего алкана с добавлением суффикса -диовая и слова кислота.
- •Амины. Классификация. Изомерия, номенклатура. Способы получения. Строение аминов и химические свойства. Практическое использование.
- •Классификация По радикалу:
- •По функциональным группам
- •Имеют структуру типа rch(nh2)co2h.
- •Общие химические свойства
- •Пептид — семейство веществ, молекулы которых построены из остатков α-аминокислот, соединённых в цепь пептидными (амидными) связями —c(o)nh—.
- •Углеводы. Химическая природа. Классификация. Распространение в природе, биологическая роль и практическое значение.
- •Биологическая роль углеводов:
- •Углеводы. Моносахариды (глюкоза, фруктоза). Строение (открытая и циклическая формы). Способы получения. Химическая идентификация (восстанавливающие свойства).
- •Получение углеводов
- •В растениях углеводы образуются из двуокиси углерода и воды в процессе сложной реакции фотосинтеза, осуществляемой за счет солнечной энергии с участием зелёного пигмента растений - хлорофилла.
- •Дисахариды (мальтоза, целлобиоза, сахароза). Строение. Получение. Химические свойства. Химическая идентификация восстанавливающих дисахаридов.
- •Целлобиоза — состоит из двух остатков глюкозы.
- •Способы получения дисахаридов:
- •Химические свойства
- •Отличительные особенности полимерного состояния вещества. Физические свойства полимеров и геометрическая форма макромолекул.
- •Методы синтеза полимеров. Реакция полимеризации, основные закономерности. Реакция поликонденсации, отличительные особенности. Примеры получения полимеризационных и поликонденсационных полимеров.
- •Химические превращения полимеров. Полимераналогичные реакции и их практическое использование.
- •Химические превращения полимеров. Макромолекулярные реакции (межмолекулярные и деструктивные). Деструкция полимеров, ее виды. Стабилизация полимеров и виды стабилизаторов.
- •Волокна. Общая характеристика. Строение макромолекул и свойства. Натуральные волокна (белковые и целлюлозные). Природные источники, химический состав, свойства и применение.
- •Искусственные волокна (ацетатные, вискозное), синтетические волокна (полиамидные, полиэфирные, полиакрилонитрильные, поливинилхлоридные). Свойства и применение.
Классификация органических реакций (по характеру химических превращений и по механизму протекания). Гомолитические (радикальные) и гетеролитические (ионные) реакции.
Реакции классифицируют по характеру химических превращений или по механизму их протекания.
I. По характеру химических превращений органические реакции делят на следующие типы:
Реакции замещения. Один атом (или группа атомов) замещается на другой атом (или группу атомов) с образованием новой молекулы:
Реакции присоединения. Из двух или нескольких молекул образуется одно новое вещество. Как правило, в таких реакциях происходит присоединение различных реагентов к кратным связям. К реакциям присоединения также можно отнести реакции восстановления. Частным случаем реакций восстановления являются реакции гидрирования – присоединения водорода:
Реакции отщепления, или элиминирования. В результате этой реакции образуется новое вещество, молекулы которого часто содержат кратную связь.
Реакции перегруппировки, или изомеризации. Такие реакции приводят к внутримолекулярным перемещениям атомов или групп атомов без изменения формулы веществ, участвующих в реакциях.
Окисление. Реакция, при которой под действием окисляющего реагента образуется одно или несколько новых кислородсодержащих веществ.
Реакции конденсации и поликонденсации являются также частным случаем реакции присоединения. В результате соединения нескольких молекул друг с другом, сопровождающегося выделением простых веществ (Н20, NH3, НСl и др.), образуется сложное вещество с высокой молекулярной массой.
Реакции разложения (расщепления) приводят к образованию новых веществ более простого строения.
II. По механизму протекания органические реакции делят на следующие типы:
Г
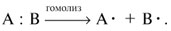 омолитические,
или радикальные, реакции идут
с участием атакующих реагентов свободных
радикалов – частиц с неспаренным
электроном. Каждый
фрагмент (осколок) молекулы получает
по одному электрону от прежней пары.
Частицы
(атомы или группы атомов), имеющие
неспаренные электроны, называют
радикалами
(или
свободными радикалами).
омолитические,
или радикальные, реакции идут
с участием атакующих реагентов свободных
радикалов – частиц с неспаренным
электроном. Каждый
фрагмент (осколок) молекулы получает
по одному электрону от прежней пары.
Частицы
(атомы или группы атомов), имеющие
неспаренные электроны, называют
радикалами
(или
свободными радикалами).
Г
 етеролитические,
или ионные, реакции идут
с участием ионов, а также частиц с
неподеленной парой электронов или
вакантной орбиталью, то есть нуклеофилов
и электрофилов. Если атакующая частица
(реагент) является нуклеофилом, то
говорят, что реакция нуклеофильная.
Если атакующая частица является
электрофилом, то реакция считается
электрофильной. Разрыв
химической связи, при котором оба
связывающих электрона переходят к
одной из образующихся частиц.
етеролитические,
или ионные, реакции идут
с участием ионов, а также частиц с
неподеленной парой электронов или
вакантной орбиталью, то есть нуклеофилов
и электрофилов. Если атакующая частица
(реагент) является нуклеофилом, то
говорят, что реакция нуклеофильная.
Если атакующая частица является
электрофилом, то реакция считается
электрофильной. Разрыв
химической связи, при котором оба
связывающих электрона переходят к
одной из образующихся частиц.
№6.
Элементный состав органических соединений. Качественный элементный анализ органических соединений, его роль в идентификации углеводов (простых и сложных), белков и изделий из полимерных материалов (природных и синтетических) методом разрушающего химического контроля.
Качественный элементный анализ — это совокупность методов, позволяющих установить, из каких элементов состоит органическое соединение. Для определения элементного состава органическое вещество предварительно путем окисления или минерализации (сплавлением со щелочными металлами) превращают в неорганические соединения, которые затем исследуют обычными аналитическими методами.
№7.
Алканы. Гомологический ряд предельных углеводов, общая формула. Изомерия, номенклатура, способы получения. Строение молекулы метана. Химические свойства (реакции замещения, цепной радикальный механизм; окисление, дегидрирование, крекинг).
Алканы — ациклические углеводороды линейного или разветвлённого строения, содержащие только простые связи и образующие гомологический ряд с общей формулой CnH2n+2.
Гомологический ряд алканов |
||
Метан |
CH4 |
CH4 |
Этан |
CH3—CH3 |
C2H6 |
Пропан |
CH3—CH2—CH3 |
C3H8 |
Бутан |
CH3—CH2—CH2—CH3 |
C4H10 |
Пентан |
CH3—CH2—CH2—CH2—CH3 |
C5H12 |
Гексан |
CH3—CH2—CH2—CH2—CH2—CH3 |
C6H14 |
Гептан |
CH3—CH2—CH2—CH2—CH2—CH2—CH3 |
C7H16 |
Октан |
CH3—CH2—CH2—CH2—CH2—CH2—CH2—CH3 |
C8H18 |
Нонан |
CH3—CH2—CH2—CH2—CH2—CH2—CH2—CH2—CH3 |
C9H20 |
Декан |
CH3—CH2—CH2—CH2—CH2—CH2—CH2—CH2—CH2—CH3 |
C10H |
Изомерия предельных углеводородов обусловлена простейшим видом структурной изомерии — изомерией углеродного скелета.

По рациональной номенклатуре алканы рассматривают как производные простейшего углеводорода — метана, в молекуле которого один или несколько водородных атомов замещены на радикалы. Эти заместители (радикалы) называют по старшинству (от менее сложных к более сложным). Если эти заместители одинаковые, то указывают их количество. В основу названия включают слово "метан".
При отрыве атома водорода от молекулы алкана образуются одновалентные частицы, называемые углеводородными радикалами. Названия одновалентных радикалов производятся от названий соответствующих углеводородов с заменой окончания –ан на -ил.
Одновалентные радикалы |
|||
Метил |
CH 3 - |
Гексил |
C 6 H 13 - |
Этил |
C 2 H 5 - |
Гептил |
C 7 H 15 - |
Пропил |
C 3 H 7 - |
Октил |
C 8 H 17 - |
Бутил |
C 4 H 9 - |
Нонил |
C 9 H 19 - |
Пентил |
C 5 H 11 - |
Децил |
C 10 H 21 - |
