- •1. Законы Ньютона
- •2. Законы изменения и сохранения импульса механической системы.
- •3. Работа силы, мощность. Консервативные и неконсервативные силы.
- •4. Универсальная связь между потенциальной энергией и силой (градиент). Закон сохранения и изменения механической энергии.
- •6. Теорема Штейнера. Работа силы при вращении. Кинетическая энергия при вращательном и плоском движении тела.
- •7. Преобразования Галилея. Кинематика относительного движения. Абсолютное, относительное и переносное ускорение частиц. Силы инерции. Центробежная сила.
- •8. Механика жидкостей. Уравнение Бернулли.
- •9. Постулаты специальной теории относительности Эйнштейна. Преобразования Лоренца. Относительность пространства и времени.
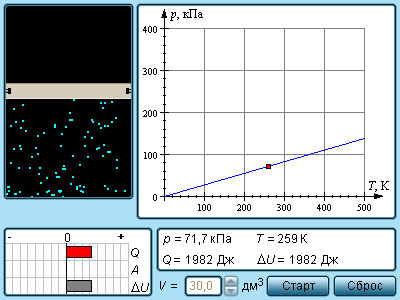
- •10. Идеальный газ. Изопроцессы. Уравнение состояния идеального газа (уравнение Клапейрона–Менделеева).
- •12. Работа расширения. Первое начало термодинамики
- •13. Теплоемкость. Уравнение Майера. Адиабатический процесс. Уравнение Пуассона
- •14. Семейство политропных процессов. Теплоемкость газа в политропных процессах. Работа и теплота в политропных процессах
- •15. Закон распределения молекул по скоростям и кинетическим энергиям (распределение Максвелла).
- •16. Барометрическая формула. Закон распределения частиц во внешнем потенциальном поле (распределение Больцмана).
- •18. Прямой и обратный круговые процессы (циклы). Принцип действия теплового двигателя и холодильной машины. Цикл Карно. Термический кпд цикла Карно
- •19. Энтропия. Второе начало термодинамики. Основное уравнение термодинамики (термодинамическое тождество).
- •20. Термодинамическая вероятность состояния. Формула Больцман
- •21. Термодинамические потенциалы.
- •22. Вандерваальсовский газ. Уравнение Ван-дер-Ваальса.
- •23. Внутренняя энергия вандерваальсовского газа. Адиабатный дроссельный эффект Джоуля -Томсона.
- •24. Фазовые переходы первого рода. Уравнение Клапейрона - Клаузиуса для однокомпонентных систем. Простейшие диаграммы состояния (pT-диаграммы). Тройная точка. Критическая точка
- •25. Поверхностное натяжение. Смачивание жидкостей.
- •26. Избыточное давление над искривленной поверхностью жидкости. Капиллярные явления.
- •27. Полупроницаемые мембраны. Явление осмоса.
10. Идеальный газ. Изопроцессы. Уравнение состояния идеального газа (уравнение Клапейрона–Менделеева).
Соотношение
p = nkT, |
связывающее давление газа с его температурой и концентрацией молекул, получено в §3.2 для модели идеального газа, молекулы которого взаимодействуют между собой и со стенками сосуда только во время упругих столкновений. Это соотношение может быть записано в другой форме, устанавливающей связь между макроскопическими параметрами газа – объемом V, давлением p, температурой T и количеством вещества ν. Для этого нужно использовать равенства
|
Здесь N – число молекул в сосуде, NА – постоянная Авогадро, m – масса газа в сосуде, M – молярная масса газа. В итоге получим:
|
Произведение постоянной Авогадро NА на постоянную Больцмана k называется универсальной газовой постоянной и обозначается буквой R. Ее численное значение в СИ есть:
R = 8,31 Дж/моль·К. |
Соотношение
|
|
(*) |
называется уравнением состояния идеального газа.
Для одного моля любого газа это соотношение принимает вид:
|
Если температура газа равна Tн = 273,15 К (0 °С), а давление pн = 1 атм = 1,013·105 Па, то говорят, что газ находится при нормальных условиях. Как следует из уравнения состояния идеального газа, один моль любого газа при нормальных условиях занимает один и тот же объем V0, равный
V0 = 0,0224 м3/моль = 22,4 дм3/моль. |
Это утверждение называется законом Авогадро.
Для смеси невзаимодействующих газов уравнение состояния принимает вид
|
где ν1, ν2, ν3 и т. д. – количество вещества каждого из газов в смеси.
Уравнение, устанавливающее связь между давлением, объемом и температурой газа было получено в середине XIX века французским физиком Б. Клапейроном, в форме (*) оно было впервые записано Д. И. Менделеевым. Поэтому уравнение состояния газа называется уравнением Клапейрона–Менделеева.
Следует отметить, что задолго до того, как уравнение состояния идеального газа было теоретически получено на основе молекулярно-кинетической модели, закономерности поведения газов в различных условиях были хорошо изучены экспериментально. Поэтому уравнение (*) можно рассматривать как обобщение опытных фактов, которые находят объяснение в молекулярно-кинетической теории.
Газ может участвовать в различных тепловых процессах, при которых могут изменяться все параметры, описывающие его состояние (p, V и T). Если процесс протекает достаточно медленно, то в любой момент система близка к своему равновесному состоянию. Такие процессы называются квазистатическими. В привычном для нас масштабе времени эти процессы могут протекать и не очень медленно. Например, разрежения и сжатия газа в звуковой волне, происходящие сотни раз в секунду, можно рассматривать как квазистатический процесс. Квазистатические процессы могут быть изображены на диаграмме состояний(например, в координатах p, V) в виде некоторой траектории, каждая точка которой представляет равновесное состояние.
Интерес представляют процессы, в которых один из параметров (p, V или T) остается неизменным. Такие процессы называются изопроцессами.
Изотермический процесс (T = const)
Изотермическим процессом называют квазистатический процесс, протекающий при постоянной температуре T. Из уравнения (*) состояния идеального газа следует, что при постоянной температуре T и неизменном количестве вещества ν в сосуде произведение давления p газа на его объем V должно оставаться постоянным:
|
![]()
|
Модель. Изотермический процесс |
На плоскости (p, V) изотермические процессы изображаются при различных значениях температуры T семейством гипербол p ~ 1 / V, которые называютсяизотермами. Так как коэффициент пропорциональности в этом соотношении увеличивается с ростом температуры, изотермы, соответствующие более высоким значениям температуры, располагаются на графике выше изотерм, соответствующих меньшим значениям температуры (рис. 3.3.1). Уравнение изотермического процесса было получено из эксперимента английским физиком Р. Бойлем (1662 г.) и независимо французским физиком Э. Мариоттом (1676 г.). Поэтому это уравнение называют законом Бойля–Мариотта.
|
Рисунок 3.3.1. Семейство изотерм на плоскости (p, V).T3 > T2 > T1 |
Изохорный процесс (V = const)
Изохорный процесс – это процесс квазистатического нагревания или охлаждения газа при постоянном объеме V и при условии, что количество вещества ν в сосуде остается неизменным.
Как следует из уравнения (*) состояния идеального газа, при этих условиях давление газа p изменяется прямо пропорционально его абсолютной температуре: p ~ Tили
|
|
Модель. Изохорный процесс |
На плоскости (p, T) изохорные процессы для заданного количества вещества ν при различных значениях объема V изображаются семейством прямых линий, которые называются изохорами. Большим значениям объема соответствуют изохоры с меньшим наклоном по отношению к оси температур (рис. 3.3.2).
|
Рисунок 3.3.2. Семейство изохор на плоскости (p, T).V3 > V2 > V1 |
Экспериментально зависимость давления газа от температуры исследовал французский физик Ж. Шарль (1787 г.). Поэтому уравнение изохорного процесса называется законом Шарля.
Уравнение изохорного процесса может быть записано в виде:

где p0 – давление газа при T = T0 = 273,15 К (т. е. при температуре 0 °С). Коэффициент α, равный (1/273,15) К–1, называют температурным коэффициентом давления.
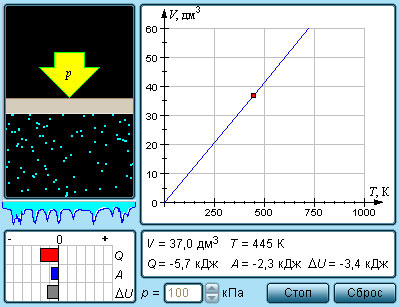
Изобарный процесс (p = const)
Изобарным процессом называют квазистатический процесс, протекающий при неизменным давлении p.
Уравнение изобарного процесса для некоторого неизменного количества вещества ν имеет вид:
|
где V0 – объем газа при температуре 0 °С. Коэффициент α равен (1/273,15) К–1. Его называют температурным коэффициентом объемного расширения газов.
|
Модель. Изобарный процесс |
На плоскости (V, T) изобарные процессы при разных значениях давления p изображаются семейством прямых линий (рис. 3.3.3), которые называются изобарами.
|
Рисунок 3.3.3. Семейство изобар на плоскости (V, T).p3 > p2 > p1 |
Зависимость объема газа от температуры при неизменном давлении была экспериментально исследована французским физиком Ж. Гей-Люссаком (1862 г.). Поэтому уравнение изобарного процесса называют законом Гей-Люссака.
Экспериментально установленные законы Бойля–Мариотта, Шарля и Гей-Люссака находят объяснение в молекулярно-кинетической теории газов. Они являются следствием уравнения состояния идеального газа.
Для этого используют уравнение состояния идеального газа (его также называют уравнением Клапейрона-Менделеева):
PV = nRT
где n – число молей газа;
P – давление газа (например, в атм;
V – объем газа (в литрах);
T – температура газа (в кельвинах);
R – газовая постоянная (0,0821 л·атм/моль·K).
Например, в колбе объемом 2,6 л находится кислород при давлении 2,3 атм и температуре 26 оС. Вопрос: сколько молей O2содержится в колбе?
Из газового закона найдем искомое число молей n:

11. Основное уравнение молекулярно-кинетической теории. Внутренняя энергия идеального газа.1
Так принято называть выводимое из м.к.т. уравнение, определяющее давление газа. Важным здесь является выяснение молекулярно-кинетического понятия температуры. Для дальнейшего нам понадобится понятие концентрации молекул. Будем называть концентрацией n число молекул в единице объема.
|
(10.1) |
Первая формула справедлива всегда, вторая – в случае, если концентрация всюду в объеме постоянна.
Через
концентрацию можно выразить и давление
газа ![]() .
Используя введенную ранее постоянную
Больцмана
.
Используя введенную ранее постоянную
Больцмана ![]() запишем
запишем ![]() .
Итак, получим
.
Итак, получим
|
(10.2) |
Необходимо вывести это же уравнение из молекулярно-кинетической теории, иными словами, найти давление газа на стенку. Давление – результат ударов молекул. Импульс, переданный всеми молекулами за секунду, – это и есть сила давления т.е. PS, где S – площадь стенки. Поскольку при каждом соударении молекул полный импульс сохраняется, для расчета давления не нужно учитывать соударения молекул между собой.

Рассмотрим
молекулу (рис.10.1), движущуюся между
стенками сосуда, расстояние между
которыми L. При ударе о верхнюю стенку
меняется только составляющая скорости ![]() .
Эта составляющая меняется на
.
Эта составляющая меняется на ![]() .
.
Изменение
импульса молекулы при ударе (т.е.
передаваемый стенке импульс) равно δp=2mvz .
Это изменение импульса приходится на
время ![]() ,
протекающее между двумя ударами о
верхнюю стенку, которое равно
,
протекающее между двумя ударами о
верхнюю стенку, которое равно ![]() .
.
Итак, средняя сила, действующая со стороны одной молекулы на стенку, равна
![]()
У разных
молекул разные скорости, поэтому
вместо ![]() надо
записать
надо
записать ![]() ,
где i – номер молекулы. Полная сила со
стороны всех молекул
,
где i – номер молекулы. Полная сила со
стороны всех молекул ![]() .
Для того чтобы найти давление, нужно
эту силу разделить на площадь стенки
S:
.
Для того чтобы найти давление, нужно
эту силу разделить на площадь стенки
S:
![]() Запишем
теперь
Запишем
теперь
![]() просуммируем
по всем N молекулам
просуммируем
по всем N молекулам
![]()
Ввиду равноправия осей x,y,z при т.д.р. три суммы справа должны быть (при большом числе молекул) равны между собой, откуда
![]() .
.
Введем понятие среднеквадратичной скорости (она называется еще тепловой скоростью vi ). Для этого необходимо найти средний квадрат скорости. Он, очевидно, равен
|
(10.3) |
Выражение (10.3) вполне аналогично выражению для средней арифметической скорости
|
(10.4) |
только в (10.4) складываются абсолютные величины скоростей молекул, а в (10.3) – квадраты скоростей.
Среднеквадратичной, или тепловой скоростью называется корень квадратный из выражения (10.3):
|
(10.5) |
Заметим,
что ![]() всегда
больше средней арифметической скорости
(10.4). Это легко проверить, подставляя
вместо
всегда
больше средней арифметической скорости
(10.4). Это легко проверить, подставляя
вместо ![]() любые
(неравные) числа.
любые
(неравные) числа.
Возвращаясь к выводу уравнения м.к.т. газов, запишем, пользуясь уравнением (10.3):
![]() .
.
Подставляя полученное выражение в выражение для P, получим
![]() .
.
Наконец,
учитывая, что ![]() -
концентрация, и замечая, что
-
концентрация, и замечая, что
![]()
есть средняя кинетическая энергия поступательного движения молекул, получим
|
(10.6) |
Это и есть
основное уравнение м.к.т. идеальных
газов. Оно читается так: давление
газа равно ![]() кинетической
энергии поступательного движения
молекул, заключенных в единице объема.
кинетической
энергии поступательного движения
молекул, заключенных в единице объема.
Сравнивая (10.6) с (10.2), получим очень важное равенство
|
(10.7) |
Это выражение объясняет молекулярно-кинетический смысл понятия температуры.
Температура – это средняя кинетическая энергия движения молекул (выраженная в других единицах).
В этом определении очень важным является слово «средняя». Если изъять из газа наиболее медленные молекулы, полная кинетическая энергия всех молекул уменьшится, но температура повысится, так как увеличится средняя энергия.
Записывая
|
(10.8) |
найдем среднеквадратичную скорость молекул
|
(10.9) |
Эта скорость пропорциональна корню квадратному из температуры.
Можно записать (10.9) в виде
|
(10.10) |
Для молекулы кислорода (μ=0,032 кг/моль) при Т=300К 483 м/с. Для молекулы водорода (μ=0,002 кг/моль) при этой же температуре скорость равна vТ=1932 м/с, т. е. она больше, чем у молекулы кислорода, в 4 раза.
Весьма важным является то обстоятельство, что в условиях т. д. р., которые рассматриваются, средняя кинетическая энергия молекулы (10.8) не зависит от массы молекулы. Если мешать несколько газов, например Н2, О2 и газ с молекулами, в сотни раз более тяжелыми, чем молекулы водорода, то при условии, что смесь будет находиться в состоянии т. д. р., средняя кинетическая энергия молекул всех газов будет одинакова. Тяжелые молекулы будут двигаться с малыми скоростями, такими, чтобы их средняя кинетическая энергия как раз равнялась энергии легких молекул.
Средняя кинетическая энергия броуновых частиц в жидкости, несмотря на огромную (по сравнению с молекулами) массу этих частиц, такая же, как у молекул.
Можно рассматривать тяжелый и легкий газ как две системы, находящиеся в т. д. р. друг с другом. Термодинамическое равновесие предполагает равенство температур этих систем. Иначе тепло будет передаваться от более горячей системы к более холодной.
В теории идеального газа потенциальная энергия взаимодействия молекул считается равной нулю. Поэтому внутренняя энергия идеального газа определяется кинетической энергией движения всех его молекул. Средняя энергия движения одной молекулы равна
![]()
Так как в
одном киломоле содержится ![]() молекул,
то внутренняя энергия одного киломоля
газа будет
молекул,
то внутренняя энергия одного киломоля
газа будет
![]() Учитывая,
что
Учитывая,
что ![]() ,
получим
,
получим
![]()
Для любой
массы m газа, т.е. для любого числа
киломолей ![]() внутренняя
энергия
внутренняя
энергия
|
(10.12) |
Из этого выражения следует, что внутренняя энергия является однозначной функцией состояния и, следовательно, при совершении системой любого процесса, в результате которого система возвращается в исходное состояние, полное изменение внутренней энергии равно нулю. Математически это записывается в виде тождества
![]()