
- •1. Законы Ньютона
- •2. Законы изменения и сохранения импульса механической системы.
- •3. Работа силы, мощность. Консервативные и неконсервативные силы.
- •4. Универсальная связь между потенциальной энергией и силой (градиент). Закон сохранения и изменения механической энергии.
- •6. Теорема Штейнера. Работа силы при вращении. Кинетическая энергия при вращательном и плоском движении тела.
- •7. Преобразования Галилея. Кинематика относительного движения. Абсолютное, относительное и переносное ускорение частиц. Силы инерции. Центробежная сила.
- •8. Механика жидкостей. Уравнение Бернулли.
- •9. Постулаты специальной теории относительности Эйнштейна. Преобразования Лоренца. Относительность пространства и времени.
- •10. Идеальный газ. Изопроцессы. Уравнение состояния идеального газа (уравнение Клапейрона–Менделеева).
- •12. Работа расширения. Первое начало термодинамики
- •13. Теплоемкость. Уравнение Майера. Адиабатический процесс. Уравнение Пуассона
- •14. Семейство политропных процессов. Теплоемкость газа в политропных процессах. Работа и теплота в политропных процессах
- •15. Закон распределения молекул по скоростям и кинетическим энергиям (распределение Максвелла).
- •16. Барометрическая формула. Закон распределения частиц во внешнем потенциальном поле (распределение Больцмана).
- •18. Прямой и обратный круговые процессы (циклы). Принцип действия теплового двигателя и холодильной машины. Цикл Карно. Термический кпд цикла Карно
- •19. Энтропия. Второе начало термодинамики. Основное уравнение термодинамики (термодинамическое тождество).
- •20. Термодинамическая вероятность состояния. Формула Больцман
- •21. Термодинамические потенциалы.
- •22. Вандерваальсовский газ. Уравнение Ван-дер-Ваальса.
- •23. Внутренняя энергия вандерваальсовского газа. Адиабатный дроссельный эффект Джоуля -Томсона.
- •24. Фазовые переходы первого рода. Уравнение Клапейрона - Клаузиуса для однокомпонентных систем. Простейшие диаграммы состояния (pT-диаграммы). Тройная точка. Критическая точка
- •25. Поверхностное натяжение. Смачивание жидкостей.
- •26. Избыточное давление над искривленной поверхностью жидкости. Капиллярные явления.
- •27. Полупроницаемые мембраны. Явление осмоса.
23. Внутренняя энергия вандерваальсовского газа. Адиабатный дроссельный эффект Джоуля -Томсона.
ДЖОУЛЯ-ТОМПСОНА ЭФФЕКТ (Джоуля-Келвина эффект), снижение температуры, имеющее место при выходе газа через небольшое отверстие в зону низкого давления. Это происходит потому, что при выходе газ должен противостоять межмолекулярным силам. На этом эффекте основан принцип работы холодильников. Назван по имени его открывателей, Джеймса Джоуля и Уильяма Томпсона Келвина.



24. Фазовые переходы первого рода. Уравнение Клапейрона - Клаузиуса для однокомпонентных систем. Простейшие диаграммы состояния (pT-диаграммы). Тройная точка. Критическая точка
Для Фазовый переход 1 рода характерно существование области метастабильного равновесия вблизи кривой Фазовый переход 1 рода (например, жидкость можно нагреть до температуры выше точки кипения или переохладить ниже точки замерзания). Метастабильные состояния существуют достаточно долго по той причине, что образование новой фазы с меньшим значением Ф (термодинамически более выгодной) начинается с возникновения зародышей этой фазы. Выигрыш в величине Ф при образовании зародыша пропорционален его объёму, а проигрыш – площади поверхности (значению поверхностной энергии). Возникшие маленькие зародыши увеличивают Ф, и поэтому с подавляющей вероятностью они будут уменьшаться и исчезнут. Однако зародыши, достигшие некоторого критического размера, растут, и всё вещество переходит в новую фазу. Образование зародыша критического размера – очень маловероятный процесс и происходит достаточно редко. Вероятность образования зародышей критического размера увеличивается, если в веществе имеются чужеродные включения макроскопических размеров (например, пылинки в жидкости). Вблизи критической точки разница между равновесными фазами и поверхностная энергия уменьшаются, легко образуются зародыши больших размеров и причудливой формы, что отражается на свойствах вещества (см. Критические явления).
КЛАПЕЙРОНА - КЛАУЗИУСА УРАВНЕНИЕ
устанавливает связь между изменениями равновесных значений темп-ры Т и давления р однокомпонентной системы (чистого в-ва) при фазовых переходах первого рода (плавление, испарение, полиморфные превращения и т. п.). Имеет вид: dp/dT=L/(TДV),где ДV - изменение объёма системы при фазовом переходе, L - теплота перехода. Производная dp/dT рассчитывается как тангенс угла наклона касательной к кривой сосуществования фаз на фазовой диаграмме. Уравнение получено Б.П.Э. Клапейроном в 1834 при рассмотрении конденсации пара, обобщено Р. Клаузиусом в 1850.
Однокомпонентной системой является любое простое вещество или химическое соединение, обладающее строго определенным составом в газообразном, жидком и твердом состояниях. Диаграмму состояния обычно строят на плоскости в координатах T-p (рис. 1). Фазовые поля (области существования) пара V, жидкости L и твердой фазы Sдивариантны, т.е. допускают одновременное изменение двух параметров состояния - Т и р.
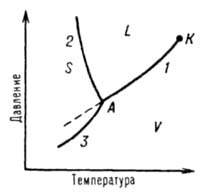
Рис. 1. Диаграмма состояния однокомпонентной системы. S, L и V - соответственно области существования твердой, жидкой и паровой фаз; 1, 2 и 3 - кривые кипения (испарения), плавления и возгонки (сублимации) соответственно, К - критическая точка; А - тройная точка.
Тройна́я то́чка — точка на фазовой диаграмме, где сходятся три линии фазовых переходов. Тройная точка — это одна из характеристик химического вещества. Обычно тройная точка определяется значением температуры и давления, при котором вещество может равновесно находиться в трёх (отсюда и название) агрегатных состояниях — твёрдом, жидком и газообразном. В этой точке сходятся линии плавления,кипения и сублимации.
В более общем случае могут рассматриваться и другие фазы вещества, не соответствующие различнымагрегатным состояниям. На достаточно богатых фазовых диаграммах может быть несколько тройных точек. Вещество в тройной точке в состоянии термодинамического равновесия может частично находиться во всех трёх фазах. На многомерных фазовых диаграммах (то есть если кроме температуры и давленияприсутствуют иные интенсивные величины) могут существовать четверные и т. д. точки.

