
- •Будова атома. Склад ядер атомів. Ізотопи.
- •Валентність та ступінь окислення. Показати валентні можливості для s.
- •Водневий зв’язок. Його особливості.
- •Гідроліз солей. Рівняння ступінчатого гідролізу.
- •Еквівалент. Визначення мас еквівалентів складних речовин.
- •Еквівалент. Закон еквівалентів.
- •Електролітична дисоціація води. Іонний добуток води. Водневий показник (рН).
- •Ковалентний зв’язок (полярний, неполярний, донорно-акцепторний).
- •Кристалічний та аморфний стан речовини. Типи кристалічних граток.
- •Аморфные вещества
- •Кристаллические вещества
- •В зависимости от того, из каких частицы Типы кристаллических решеток
- •Металевий зв’язок, його особливості.
- •Оксиди (основні, кислотні, амфотерні). Приклади.
- •Основні класи неорганічних сполук. Визначення та приклади.
- •Основні класи неорганічних сполук. Навести приклади.
- •Основні поняття атомно-молекулярної теорії. Атом, молекула, хімічний елемент.
- •Періодична система елементів (псе). Залежність властивостей металів та неметалів від їх положення в псе.
- •Періодичний закон і періодична система елементів. Дати визначення – атомна маса, молекулярна маса, моль.
- •Періодичний закон і система елементів. S -, p -, d -, f – елементи. Зміна властивостей елементів по періодах і групах.
- •Ряд напруг металів. Рівняння Нернста.
- •Солі ( основні, кислі та середні ). Приклади.
- •Хімічна та електрохімічна корозія металів.
- •Хімічний зв’язок. Види зв’язку. Полярність та направленість зв’язку.
- •Який підрівень раніше заповнюється електронами 3d, 4s, 4p, 3p? Доведіть це за допомогою правил Клечковського.
М О Д У Л Ь 1
Будова атома. Ізотопи.
{
Атом
складається з позитивно зарядженого
ядра и негативно зарядженого електрона.
Заряд
електрона становить e=
1,602*![]() Кл.
Атом є
електронейтральним, у ядрі зосереджено
основну масу атома, ядро складається з
протонів і нейтронів.
Оскількі
ці маси дуже малі для них прийнято атомну
одиницю маси яка дорівнює
Кл.
Атом є
електронейтральним, у ядрі зосереджено
основну масу атома, ядро складається з
протонів і нейтронів.
Оскількі
ці маси дуже малі для них прийнято атомну
одиницю маси яка дорівнює
![]() маси ізотопу
маси ізотопу
![]()
![]() .
У цих
одиницях виражається маса атома і
молекули.
Заряд ядра
визначається кількістью в ньому протонів,
а масове число сумою протонів і
нейтронів.M=P+N.
.
У цих
одиницях виражається маса атома і
молекули.
Заряд ядра
визначається кількістью в ньому протонів,
а масове число сумою протонів і
нейтронів.M=P+N.
Ізотоп – це різновид атомів, що має одноковий заряд ядра, але різнку кількість нейтронів у ядрі.}
Будова атома. Квантово-механічна модель атома.
{n - головне квантове число, яке визначає запас енергії в електронах на певному енергетичному рівні.n=1,2,3,4 …..Відповідає номеру періода.
L –орбітальне або побічне квантове число, яке визначає кількість енергетичних підрівнів та форму орбіта лей, L=n-1.
m- магнітне квантове число визначає кількість комірок, та описує орієнтацію орбіта лей в просторі m= буває від –l{L} до +l{L} m=2L+1.
s- спінове квантове число описує направленість оберту електрона в магнітному полі. Є
-![]() ,
+
,
+
Квантове число- це енергетичний параметр який визначає стан електрона и тип атомної орбіта лі на якій вона знаходится. Квантові числа необхідні для опису стану кожного електрона в атомі.}
Будова атома. Склад ядер атомів. Ізотопи.
Третие практически тоже самое что и перове.
Валентність та ступінь окислення. Показати валентні можливості для s.
{Cтупінь окиснення дорівнює - заряду атома елемента в сполуці
1) Ступінь окиснення атомів, що входить до складу простих речовин дорівнює 0
2) Алгеброїчна сума дорівнює нулю а для іонів їхньому заряду
3) Ступінь окиснення s-елементів дорівнює +1
4) Гідроген в сполуках має ступінь окиснення +1, виняток становлять гідрати металів, гідроген в них має -1(NaH, CaH)
5) Оксиген у більшості сполуках має ступінь окиснення -2, виняток становить пероксиди, су пероксиди та інші. Максимальний ступінь окиснення змінюється періодично зі збільшення порядкового номеру.
Валентність- це здатність даного елементу приєднувати до себе інші елементі або заміщати певну кількість атомів. Кількість валентності визначається числом хімічних зв’язків, які устворюються атомами.
- Спочатку вимірюється по водню
- Валентність визначається числом електронів, які атом віддає для утворення спільних електронних пар }
Водневий зв’язок. Його особливості.
{ Водневий зв’язко з'являється при утворенні об’єднаних електонами атома водню однієї молекули води с неподільною електроною парою атомів кисню другої молекули води. Для утворення водневого зв’язку необхідно щоб один або декілька атомів водню були зв’язані з невеликими по електронегативності атомами(N,F,O) }
Гідроліз солей. Рівняння ступінчатого гідролізу.
{ Гідроліз солей-це взаємодія речовини з водою при якому складові частини речовини з’єднуються з складовими частинами води. Гідроліз- це розкладання водою. У реакції приймають учать солі які утворені слабкою кислотою та слабкою основою.
1)
Солі утворені сильною кислотою ті
сильною основою –гідролізу не піддаються
і знаходяться в нейтральному середо
віші тому що pH=![]()
![]()
2) Cолі утворені слабкою кислотою і сильною основою, будуть знаходитися у лужному середовищі тому що pH> .Супроводжуються отриманням OH
![]()
![]()
3)Солі утворені сильною кислотою і слабою основою, будуть знаходитися у кислому середовищі тому що pH < .Супроводжується отриманням H
![]()
![]() }
}
Еквівалент. Визначення мас еквівалентів складних речовин.
{ Еквівалент-це така кількість речовини яка відповідає одному молю атомів гідрогену в обмінних реакціях і одному електрону в окисно-відновних реакціях.
Є а) молярна маса еквівалента оксиду
 M-малярна
масса оксиду, В- валентність
елемента, n-його
кількість
M-малярна
масса оксиду, В- валентність
елемента, n-його
кількість
б) молярна маса еквіваленту кислоти
 ,
z-
визначається
по кількості атомів гідрогену
(H).
,
z-
визначається
по кількості атомів гідрогену
(H).
в) молярна маса еквіваленту гідрооксиду
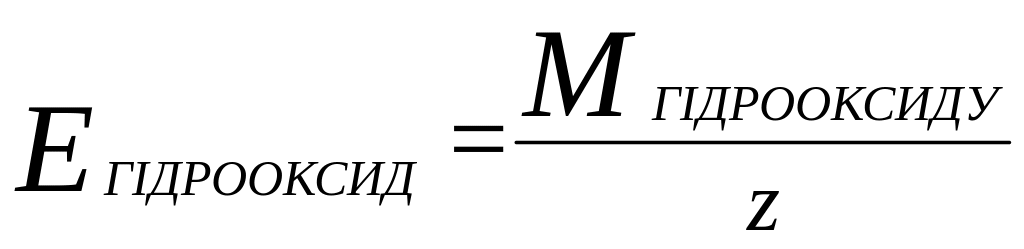 ,
z- визначається
кількістю атомів гідрооксиду (OH)
,
z- визначається
кількістю атомів гідрооксиду (OH)
г) молярна маса еквівалента солі
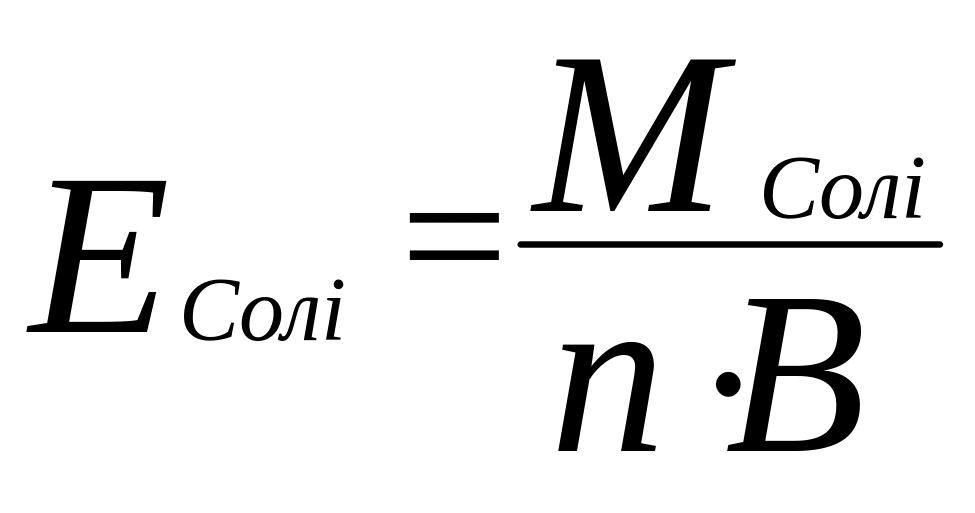 ,
B- добуток
валентності металу, (n)-на
його кількість
}
,
B- добуток
валентності металу, (n)-на
його кількість
}
Еквівалент. Закон еквівалентів.
{ Закон Еквівалента- маса реагуючих речовин співвідноситься як молярні маси еквівалентів цих речовин
 }
}
Електролітична дисоціація води. Іонний добуток води. Водневий показник (рН).
{
Електрична
дисоціація- це розпад молекули на іони.
Іонний добуток води- це добуток
концентрації іонів гідрогену і гідроксиду
за даної температури.
![]()
Водневий показник:
![]() >
>
![]() -
буде лужне
середовище(виділиться гідрооксид OH)
-
буде лужне
середовище(виділиться гідрооксид OH)
= - , буде нейтральне середовище
< - буде кисле середовище(виділиться гідроген H)
Гідрогенний
показник або pH-
називається десятковим логарифмом
концентрації іонів гідрогену у розчині
взятий з протилежним знаком.
![]() }
}
Електролітична дисоціація. Константа дисоціації.
{
Константа
дисоціації-характерезує
здатність електроліта дисоціювати на
іони.
Чим більше
константа тим легше електроліти
розпадаються на іони.
![]() }
}
Електролітична дисоціація. Ступінь і константа дисоціації.
{
Ступінь
дисоціації- це величина яка характеризує
стан рівноваги в реакціях дисоціації
в гамогених або однорідних системах.
Вона дорівнює добутку концентрації
іонів, що утворилися поділену на
концентрацію недисоційованих іонів. .
Константу дисоціації можна виразити
через концентрацію
електроліта
[c]
і ступінь
дисоціації [L].
K=L*C.}
.
Константу дисоціації можна виразити
через концентрацію
електроліта
[c]
і ступінь
дисоціації [L].
K=L*C.}
Закон Авогадро та наслідки з нього.
{ Був винайдений у 1811 році. Закон Авогадра - однакові об’єми різних газів при стандартних умовах мають однакову кількість частинок. Перший наслідок 1 моль будь-якого газу при стандартних умовах(T=273K, P=101,3 кПа ) заповнює об’єм 22,4 літра.
Другий наслідок- за однакових умов густини різних газів пропорційні їх молярним масам.
 .
Число Авагадра дорівнює
.
Число Авагадра дорівнює
![]() =
6,022*
=
6,022*![]() }
}
Іонний добуток води. Водневий показник (рН). Шкала кислотно-лужних відношень.
Уже давал на это ответ в 9 номере
Іонний зв’язок. Особливості іонного зв’язку.
{ Іонний зв'язок- це хімічний зв'язок який виникає завдяки електростатичному притяганню різнойменно зарядженних іонів, також утворюється між атомами які мають велику різницю електронегативності, при якій спільна електронна пара переходить до атому с більшою електронегативністю. З'єднання з чисто іонним зв’язком немає. Він також немає направленості и насичуваності }
Кислоти. Класифікація кислот.
Кислота-
це сполука, що складається х одного або
декількох атомів гідрогену і кислотного
залишку. Вони дисоціюють з утворенням
позитивно зарядженого гідрогену (H)
та негативно
зарядженим кислотнім залишком
![]() .
Номенклатура
для безоксигшенових кислот використовується
слово –“гідрогенна
”
наприклад: HCl-хлоридгыдрогену.
Класифікація: а) за вмістом оксисену в
сладі кислоти є безокисгеновмістна(HCl,H2S,)
і
оксигеновмістна(
.
Номенклатура
для безоксигшенових кислот використовується
слово –“гідрогенна
”
наприклад: HCl-хлоридгыдрогену.
Класифікація: а) за вмістом оксисену в
сладі кислоти є безокисгеновмістна(HCl,H2S,)
і
оксигеновмістна(![]() ).
За кількістю
атомів визначають її основність
).
За кількістю
атомів визначають її основність
-одноосновна(HCl)
-двоосновна(H2S)
-триосновна(![]() ).
).
За
силою
поділяються на слабкі та сильні кислоти.
Силу можна визначити щза правилом
Полінга.
![]() .
Чим більше
буде (m-n)
тим сильніше буде кислота, якщо m=3
то кислота
вважається сильною якщо 0 то дуже слабкою
а якщо 1 просто слабкою.
.
Чим більше
буде (m-n)
тим сильніше буде кислота, якщо m=3
то кислота
вважається сильною якщо 0 то дуже слабкою
а якщо 1 просто слабкою.
