
- •22. Реальные газы. Уравнение Ван-дер-Ваальса.
- •23.Изотермы Ван-дер-Ваальса. Отношение масс газообразной и жидкой фаз на двухфазном участке изотермы Ван-дер-Ваальса.
- •24. Фазовый переход, критическое состояние, условие равновесия фаз. Тройная точка.
- •25. Фазовые переходы. Уравнение Клапейрона-Клаузиуса.
- •26. Длина свободного пробега молекулы. Длина свободного пробега в одном направлении.
- •27. Уравнение стационарных процессов переноса.













10. Закон сохранения полной механической энергии системы. Работа диссипативных сил.
Полная механическая энергия системы E=Eсоб+Uвнеш
E=K+Uсоб+Uвнеш
Закон сохранения полной механической энергии систем, находящейся во внешнем стационарном поле: если на систему частиц не действуют внешние сторонние силы и нет внутренних диссипативных сил, то полная механическая энергия системы остается постоянной:
E=Eсоб+Uвнеш=const – только в инерциальных системах отсчета
Работа диссипативных сил
Диссипативные силы – силы трения и сопротивления. Любая диссипативная сила может быть представлена в виде F=-k(u)v, v – скорость 1 тела относительно 2 тела, с которым оно взаимодейств.,
k(u) – положительный коэффициент, зависящий от скорости. F¯v. Суммарная работа всех диссипативных сил в системе – всегда отрицательная величина, независимо от системы отсчета.
 .
Внутр.
диссипат. силы в данной системе встречаются
по парам(А1=
-А2)
.
Внутр.
диссипат. силы в данной системе встречаются
по парам(А1=
-А2)
 ,
F2=-F1,
F1=-kv,
v=v1-v2
– скорость 1 тела отн второго.
,
F2=-F1,
F1=-kv,
v=v1-v2
– скорость 1 тела отн второго.

Авнутр=
















Механика. Вопрос 18. Твердое тело. Разделение движения твердого тела на поступательное и вращательное. Преобразование поступательной и угловой скорости при переходе межу инерциальными системами отсчета.



Механика. Вопрос 19. Вращение твердого теле вокруг неподвижной оси. Момент инерции. Примеры вычисления момента инерции. Теорема Штейнера




Т![]() еоре́ма
Ште́йнера:
момент инерции J
тела относительно
произвольной оси равен сумме момента
инерции этого тела Jc
относительно
параллельной ей оси, проходящей через
центр масс тела, и произведения массы
тела
еоре́ма
Ште́йнера:
момент инерции J
тела относительно
произвольной оси равен сумме момента
инерции этого тела Jc
относительно
параллельной ей оси, проходящей через
центр масс тела, и произведения массы
тела
![]() на квадрат расстояния
на квадрат расстояния
![]() между осями:
J
= Jc
+ m²d
между осями:
J
= Jc
+ m²d
Момент инерции, по определению:
Радиус-вектор
![]() можно расписать как сумму двух векторов:
можно расписать как сумму двух векторов:
![]()
где
![]() —
радиус-вектор расстояния между старой
и новой осью вращения. Тогда выражение
для момента инерции примет вид:
—
радиус-вектор расстояния между старой
и новой осью вращения. Тогда выражение
для момента инерции примет вид:
![]()
В
ынося
за сумму , получим:
![]()
Поскольку
старая ось проходит через центр масс,
то суммарный импульс тела будет равен
нулю:
![]()
Т![]() огда:
огда:
Откуда
и следует искомая формула:
![]()
Примеры вычисления момента инерции

Механика. Вопрос 20. Кинетическая энергия вращающегося тела в системе центра инерции и в лабораторной системе.



Механика. Вопрос 21. Тензор инерции. Главные моменты инерции




Механика. Вопрос 22. Уравнения Эйлера
ЭЙЛЕРА УРАВНЕНИЯ в механике твердого тела. Динамические Э. у. представляют собой дифференц. ур-ния движения твёрдого тела вокруг неподвижной точки и имеют вид
 где
где![]() -моменты
инерции тела относительно гл. осей
инерции, проведённых из неподвижной
точки; wx,
wy,
W2-проекции
мгновенной угл. скорости тела на эти
оси;
-моменты
инерции тела относительно гл. осей
инерции, проведённых из неподвижной
точки; wx,
wy,
W2-проекции
мгновенной угл. скорости тела на эти
оси;
![]() -
гл. моменты
сил,
действующих на тело, относительно тех
же осей;
-
гл. моменты
сил,
действующих на тело, относительно тех
же осей;![]() -производные
по времени от
-производные
по времени от![]() Кинематические
Э. у. дают выражения
Кинематические
Э. у. дают выражения![]()
![]() через Эйлера
углы
через Эйлера
углы![]() и
имеют вид
и
имеют вид

Система ур-ний (1) и (2) позволяет, зная закон движения тела, определить момент действующих на него сил и наоборот, зная действующие на тело силы, определить закон его движения.
Механика. Вопрос 23. Неинерциальные системы отсчета. Силы инерции. Движение в поступательно движущейся НСО.



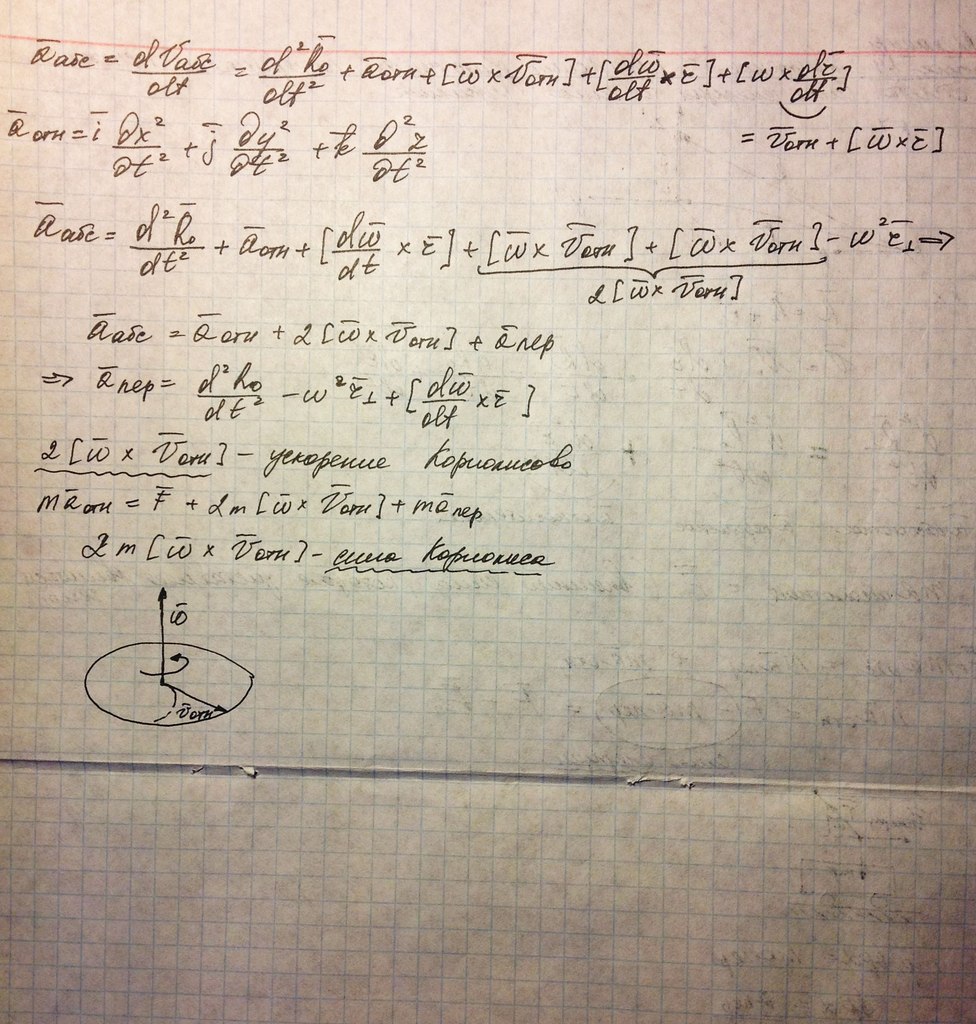




































10. Распределение Больцмана. Распределение частиц в сосуде в однородном поле тяжести. Барометрическая формула.
Распределение Больцмана: В силу независимости событий (произведение вероятностей) для молекул иметь определенные значения кинетической и потенциальной энергий можно рассматривать отдельно распределение частиц во внешнем поле U(x,y,z)
dP(U)=B*exp(-U(x,y,z)/T)*dxdydz
Это соотношение дает вероятность того, что частица обладает потенциальной энергией U(x,y,z) и
находится в элементе объема dV= dxdydz вблизи точки с координатами (x,y,z). Так как вероятность
можно определить через отношение числа частиц, которые попадают в этот объем к полному числу частиц dP(U)=dP(x,y,z)=dN/N, то число молекул в объеме dV определяется формулой:
dNx,y,z=N*B*e-U(x,y,z)/Tdxdydz
Смысл множителя N*B легко понять, если рассмотреть число частиц в единице объема, т.е. плотность (концентрацию) числа частиц: dNx,y,z/(dxdydz)=n(x,y,z)=N*B*e-U(x,y,z)/T
видно, что произведение N*B равно плотности числа частиц, где потенциальная энергия
равна нулю U = 0, эту плотность обозначим n0
n(x,y,z)=n0*e-U(x,y,z)/T – распределение Больцмана
Примечание: Если отсчет по энергии идет от точки, где U=U0, тогда распределение Больцмана имеет вид:
n(x,y,z)=n0*exp(-(U(x,y,z)-U0)/T) (1)
Распределение частиц в сосуде по высоте в однородном поле тяжести.Будем считать,
что g=const, T= const. Для Земли однородное поле тяжести получаем для небольших высот h << Rз
(Rз - радиус Земли), когда раскладываем потенциальную энергию в ряд по степеням отношения h/R:

U(h)-U(0)=

M – масса Земли, а m - масса молекулы. Тогда подставляя в (1), получаем известную формулу
Больцмана, определяющую зависимость концентрации молекул от высоты:
n(h)=n(0)*exp(-mgh/T)=n(0)*exp(-mgh/kTk)=n(0)*exp(-mgh/RTk)
Здесь n(0) – концентрация молекул у дна сосуда (поверхности Земли), m-молярная масса газа
(m=mNA), R - универсальная газовая постоянная. Концентрация частиц убывает с высотой,
причем концентрация более тяжелых частиц убывает с высотой быстрее. Это создает подъемную силу – силу Архимеда для более легких объектов (воздушные шары, аэростаты, дирижабли).
Воспользовавшись формулой для идеального газа: p=nkT
получаем барометрическую формулу Больцмана: p=p0*exp(-mgh/kTk)
Для более высоких температур распределение молекул по высоте сосуда становится более
равномерным. При этом полное число частиц в сосуде N постоянно и определяется
выражением:

здесь DS – площадь сечения сосуда, L – полная высота.
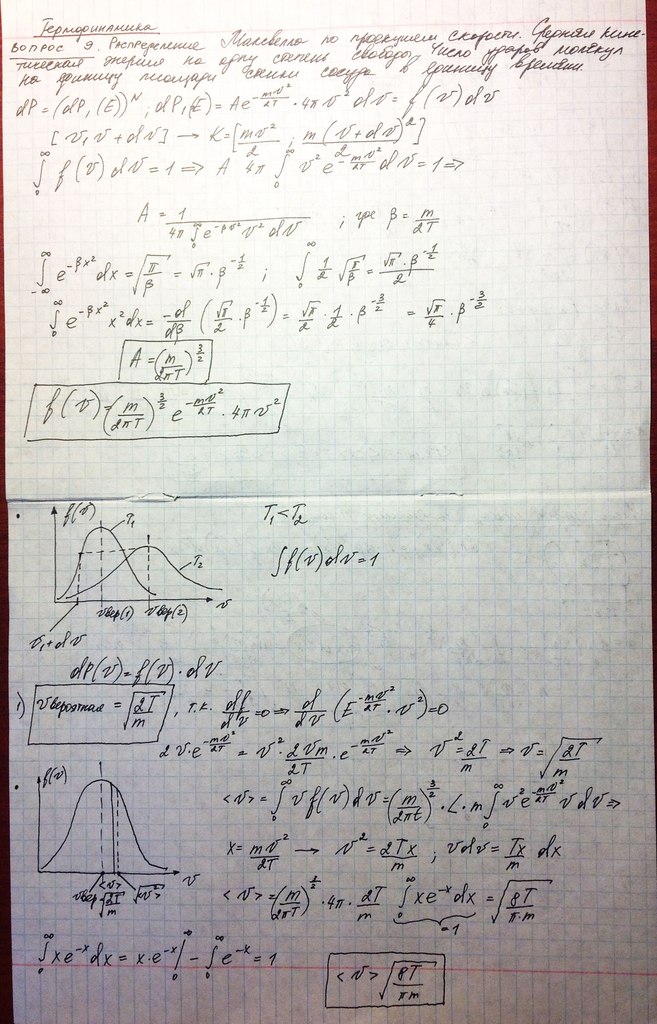
11. Распределение Максвелла-Больцмана. Средняя энергия на колебательную степень свободы.
Распределение Максвелла-Больцмана:
Для классической подсистемы полная энергия равна сумме
кинетической и E=K+U. И поскольку кинетическая энергия есть функция скоростей, а потенциальная энергия - функция координат, то вероятность иметь для подсистемы
полную энергию Е равна:
dP(E)=dP(K)dP(U)
Если в качестве подсистемы выбираем одну частицу, то для одной частицы имеем следующее распределение по энергиям:
dP(E)=Aexp dpxdpydpzdxdydz
– распределение
Максвелла-Больцмана
dpxdpydpzdxdydz
– распределение
Максвелла-Больцмана
Средняя энергия, приходящаяся на колебательную степень свободы.
Распределение Максвелла-Больцмана позволяет получить среднюю энергию, приходящуюся на
колебательную степень свободы. Равновесное состояние кристалла - периодическое расположение атомов в пространстве. Однако, атомы не находятся в покое, они совершают малые тепловые колебания относительно положений равновесия. Пусть колебания совершаются вдоль оси 0x, тогда энергия такого осциллятора(то, что совершает колебания) равна: E=mvx2/2+kx2/2, где m масса атома, k- упругая постоянная. Статистическое описание атомов с энергией Е можно вести с помощью распределения Максвелла-Больцмана, которое для одного одномерного осциллятора имеет вид:

Здесь А нормировочная постоянная, она состоит из произведения 2-х постоянных: А = А 1 А 2 , которые равны
соответственно:


Найдем среднюю энергию тела, колеблющегося по оси x, по стандартным формулам:

Очень сложными путями пришли к такому:
 ,Tk-температура
в Кельвинах
,Tk-температура
в Кельвинах
Итак, на 1 колебательную степень свободы приходится энергия, равная Т = kTk. Из расчета видно, что одна Т/2 возникла из-за усреднения кинетической энергии колебательного движения, а другая Т/2 - из-за потенциальной энергии колебательного движения.
12. Идеальный газ. Связь энергии и давления, закон Паскаля. Термодинамическое соотношение Гиббса. Условие механического равновесия(равенство давлений для подсистем замкнутой системы).
Идеальный газ — математическая модель газа, в которой предполагается, что потенциальной энергией молекул можно пренебречь по сравнению с их кинетической энергией. Между молекулами не действуют силы притяжения или отталкивания, соударения частиц между собой и со стенками сосуда абсолютно упруги, а время взаимодействия между молекулами пренебрежимо мало по сравнению со средним временем между столкновениями.
Связь давления и энергии.
Рассмотрим замкнутую систему, состоящую из тела и среды, при этом объем этой системы постоянен
V=V1+V2=const. Пусть теплообмена между подсистемами нет, при этом энтропии подсистем S1 и S2
постоянны.
E1=E(S1,V1)
Итак, если нет теплообмена, то энтропия постоянна S1 = const и всякое изменение объема V1
сопровождается изменением энергии Е1 .
Чтобы описать механическое взаимодействие объема V 1 с окружающей средой, построим на границе площадку размером dydz, перпендикулярную оси x. Пусть изнутри объема V1 на эту площадку действует сила Fx . Под действием этой силы тело (газ) совершает работу при перемещении этой площадки на расстояние dx:
dAгаз=Fxdx
Работа приводит к уменьшению внутренней энергии тела на
величину:
-dE=Fxdx, Fx=-dE/dx
Учитывая, что элемент объема равен dV=dxdydz:

А налогично
для Fy,
Fz:
налогично
для Fy,
Fz:

 (1)
(1)

- закон Паскаля: средняя сила, действующая на элементарную площадку в жидкости (газе, твердого тела), пропорциональна ее площади и направлена по нормали к ней.
Термодинамическое тождество.
Полное изменение внутренней энергии E=E(S,V) - есть полный дифференциал:
 - термодинамическое
тождество или термодинамическое
соотношение Гиббса
- термодинамическое
тождество или термодинамическое
соотношение Гиббса
Условие механического равновесия.
Тела 1 и 2 составляют замкнутую систему, следовательно, в состоянии равновесия можно записать:
E=E1+E2=const; V=V1+V2=const; S=S1(V1,E1)+S2(V2,E2)
Т.к.
 и
и
 то p1/T1=p2/T2
то p1/T1=p2/T2
Если тела в тепловом равновесии, то p1=p2
При увеличении давления энтропия растет, при уменьшении давления возрастанию энтропии соответствует сжатие тела.
13. Квазистатические процессы(изотермический, изобарический, изохорический, политропический) и работа, совершаемая идеальным газом.
Элементарная работа газа dA=pdV, а конечная работа при расширении газа от V1 до V2:

pV=NT=NkTk , для одного моля: Nk=NAk=R – газовая постоянная. Тогда pV=nRTk (для n молей) – уравнение Менделеева-Клапейрона
Изотермический процесс: процесс, при котором температура остается неизменной T=const.
Работа n молей газа по расширению от объема V 1 до объема V 2 определяется уравнением:

Работа газа равна площади под кривой изотермы на графике P(V) от точки 1 до точки 2.
Изобарический процесс: процесс, при котором давление в газе остается неизменным p=const.
Работа n молей газа по расширению от объема V 1 до объема V 2 определяется очевидным соотношением (как площадь под графиком между объемами):
A12=p(V2-V1)
Изохорический процесс: процесс, при котором объем газа остается неизменным V=const. Поскольку
изменение объема равно нулю dV= 0 , то и работа газа в этом процессе равна 0: A=0.
Политропический процесс определяется уравнением pVn=const.
Пусть эта постоянная равна B. Тогда работа:

В зависимости от величины показателя политропы n работа газа при расширении может быть положительной и отрицательной.
14. Работа и количество тепла. Первое начало термодинамики.
Если тело испытывает теплообмен и механическое взаимодействие с окружающей средой, то изменение внутренней энергии определяется двумя причинами:
1)Работой внешних сил dA’
2) теплообменом, т.е. обменом той частью энергии, которая называется количеством теплоты dQ.
П олучаем:
dE=dQ+dA’
=> dQ=TdS
олучаем:
dE=dQ+dA’
=> dQ=TdS
dE=TdS-pdV
Количество тепла зависит от способа перехода тела из одного состояния в другое. Так, совершая круговой процесс, получаем, что изменение внутренней энергии равно DE = 0, поскольку внутренняя энергия есть функция состояния. Однако, вследствие соотношения dE=dQ+dA’ можно получить работу и количество тепла, отличное от нуля. Т.е. возможно превращение работы в тепло и тепла в
работу при совершении кругового процесса.
Единицы теплоты: система СГС – Эрг, система СИ – Дж. Существует внесистемная
единица теплоты - калория (количество тепла при нагревании 1г воды на 1К): 1кал = 4.184 Дж
Таким образом, в равенстве
dE=dQ+dA’ выражается закон сохранения энергии, который носит название первого начала термодинамики. Для системы невзаимодействующей с окружающей средой имеем: dQ = 0, dA’= 0 и dE = 0, т.е. E = const.
Следует, что если теплоизолированное тело (dQ = 0) участвует в круговом процессе (dE = 0), то в этом процессе и dA = 0. Иначе: в отсутствие взаимодействия с окружающими телами нельзя провести процесс, единственным результатом которого было бы получение работы. Невозможно построить вечный двигатель первого рода.
Первое начало термодинамики можно записать: dQ=TdS=dE+pdV.

















22. Реальные газы. Уравнение Ван-дер-Ваальса.
Реальный газ — газ, который не описывается уравнением состояния идеального газа Клапейрона — Менделеева.
При низких давлениях сжать реальный газ легче, чем идеальный, а при высоких давлениях - реальный газ сжимается труднее идеального. Т.е. опыт показывает, что между молекулами газа существуют силы притяжения и отталкивания. Их необходимо учитывать, чтобы описать поведение газа в более широком интервале. Так, идеальный газ не превращается в жидкость или в твердое тело, а реальные газы испытывают такие превращения, и причина тому - взаимодействие между молекулами.
В основе межмолекулярного взаимодействия лежат силы электромагнитной природы, эти силы на малых расстояниях имеют характер отталкивания, а на больших – характер притяжения. Впервые взаимодействие между атомами и молекулами рассматривал и учитывал при определении уравнения состояния реального газа И. Ван-дер-Ваальс.
Уравнение Ван-дер-Ваальса.
Уравнение Ван-дер-Ваальса для описания состояния реального газа является наиболее простым и удобным обобщением уравнения состояния идеального газа. Оно было получено опытным путем и отличается от уравнения состояния идеального газа поправками к давлению и объему газа. Эти поправки происходят от учета в рамках простейших модельных представлениях отталкивания молекул на малых расстояниях и притяжения на больших.
1). Учтем отталкивание на малых расстояниях.
Если
заменить объем в уравнении состояния
идеального газа на (V-b),
то получиться:![]()
т.е. при увеличении давления р газ можно сжать лишь до минимального объема, равного b (дальше возникает сильнейшее отталкивание).
2). Если учесть притяжение между молекулами. Поправку к давлению можно записать в виде:
 где
a - некоторая постоянная величина.
где
a - некоторая постоянная величина.
Окончательно
уравнение Ван-дер-Ваальса для одного
моля записывается в виде:

23.Изотермы Ван-дер-Ваальса. Отношение масс газообразной и жидкой фаз на двухфазном участке изотермы Ван-дер-Ваальса.
Изотермы Ван-дер-Ваальса.
Преобразуем уравнение Ван-дер-Ваальса для одного моля и запишем его по степеням объема, считая постоянной температуру:
![]()

При температурах, ниже некоторого значения Ткр, в уравнении имеется 3 вещественных корня. При этом изотерма имеет дополнительные максимум и минимум
в отличие от изотерм идеального газа. При Т < Ткр эта колоколообразная область немонотонной зависимости изображена на рис. 2.1 пунктирной линией, она сужается с ростом температуры Т и при Т = Ткр исчезает, а изотермы превращаются в кривые, близкие к изотермам идеального газа.
Итак, при Т = Ткр имеется точка перегиба, где все три решения для V сливаются в одно и мы
п олучаем
одинаковые корни уравнения (4.2.1). Эта
температура Ткр
называется
критической
температурой.
Соответствующая этой температуре
изотерма также называется критической.
олучаем
одинаковые корни уравнения (4.2.1). Эта
температура Ткр
называется
критической
температурой.
Соответствующая этой температуре
изотерма также называется критической.
Отношение масс газообразной и жидкой фаз на двухфазном участке изотермы Ван-дер-Ваальса.
Изотерма имеет плоский участок, на котором осуществляется превращение одной фазы в другую. То есть с сокращением объема газ переходит в жидкость при постоянном давлении. Причем газ и
жидкость все время находятся в равновесии, т.е. при данном объеме мы имеем постоянное количество насыщенного пара над постоянным количеством жидкости. С молекулярной точки зрения – это динамическое равновесие: молекулы непрерывно переходят из одной фазы в другую. В крайней левой точке плоского участка мы получаем, что весь газ перешел в жидкость, т.е. получаем объем жидкости (Vж). Напротив, в правой точке этого участка мы получаем только объем газа (Vг, см рис. 2.3).
Получим отношение масс жидкости и пара при произвольном объеме на двухфазном участке.
![]() или
или
![]()
