
- •Предмет химической термодинамики. Термодинамические системы, виды термодинамических систем, параметры состояния, параметры процесса
- •Первый закон термодинамики. Функции состояния системы и их свойства.
- •Закон Гесса. Следствия из закона Гесса. Тепловые эффекты химических процессов и методы их вычисления. Стандартные энтальпии образования и сгорания веществ.
- •4. Предмет химической кинетики. Скорость химических реакций и факторы ее определяющие. Закон действия масс.
- •5. Влияние температуры на скорость химической реакции:
- •6. Понятия о катализе, катализаторах и ингибиторах. Природа
- •7. Практическое использование гетерогенного катализа на примере производства аммиака или серной кислоты.
- •8. Биологические катализаторы и их особенности. Явление комплементарности.
- •9. Колебательные реакции. Реакция Белоусова-Жаботинского.
- •10. Фазовое равновесие. Правило фаз.
- •11. Понятия об обратимых и необратимых химических процессах, химическом равновесии. Константа равновесия и ее вычисление.
- •12. Принцип Ле Шателье и его использование для управления химико-технологическими процессами.
- •13. Основные законы стехиометрии. Атомные и молекулярные массы, количество вещества, молярная масса и молярный объем, плотность одного газа по отношению к другому, парциальное давление газа.
- •1. Закон сохранения массы веществ:
- •14. Материальный баланс химического процесса. Понятие о выходе.
- •15. Химический эквивалент. Количество вещества эквивалентов, число эквивалентности для различных типов реакций. Закон эквивалентов.
- •16. Периодический закон Менделеева, историческая и современная формулировка. Физический смысл порядкового номера элемента. Явление периодичности и электронная структура атомов
- •17. Квантовые числа и порядок заполнения энергетических уровней и орбиталей в атомах. Правила Клечковского
- •1. Принцип Паули
- •3. Принцип минимума энергии (Правила в.М. Клечковского, 1954)
- •18. Методы моделирования химических связей: метод валентных связей и метод молекулярных орбиталей.
- •19. Количественная оценка полярности связи и полярности молекулы.
- •20. Растворы и их природа. Способы выражения состава растворов (молярная концентрация, массовая доля растворенного вещества).
- •21. Растворы неэлектролитов и их свойства. Закон Генри.
- •22. Законы Рауля. Вычисление температур кипения и замерзания растворов.
- •Повышение температуры кипения растворов
- •23. Осмос. Роль осмоса в природе и технике. Вычисление осмотического давления.
- •24. Теория электролитической диссоциации. Изотонический коэффициент, степень диссоциации, константа диссоциации электролита.
- •2 Ch3cooh ↔ (ch3cooh)2
- •25. Вода как растворитель. Использование воды в технологических процессах. Процесс водоподготовки.
- •26. Ионное произведение воды, водородный показатель. Регулирование водородного показателя в технологических процессах.
- •27. Произведение растворимости. Управление растворимостью веществ.
- •28. Дисперсные системы. Строение, классификация, молекулярно-кинетические и оптические свойства дисперсных систем.
- •29. Строение мицелл золя. Электрокинетические явления (электрофорез и электроосмос) и их практическое использование.
- •34. Электрохимические системы. Межфазный скачек потенциала. Стандартные электродные потенциалы и их измерение.
- •35. Электрохимический ряд напряжений. Уравнение Нернста.
- •36. Гальванические элементы. Вычисление эдс. Современные химические источники тока.
- •37. Электролиз. Количественные расчеты с использованием законов Фарадея.
- •38. Гальванопластика и гальваностегия как примеры технического использования электролиза.
- •39. Коррозия металлов и ее типы. Механизм электрохимической коррозии и методы борьбы с ней.
- •40. Полимеры и олигомеры. Зависимость свойств полимерных материалов от состава и структуры. Использование полимерных материалов в современных технологических процессах. Переработка полимеров.
- •41. Качественный и количественный анализ. Аналитический сигнал. Их роль в технологических процессах.
- •42. Физико-химический анализ. Физический анализ. Их роль в технологических процессах.
40. Полимеры и олигомеры. Зависимость свойств полимерных материалов от состава и структуры. Использование полимерных материалов в современных технологических процессах. Переработка полимеров.
Вещества полимерного строения (полимеры) – состоят из молекул, характеризующихся многократным повторением одного или более составных звеньев и обладают такими свойствами, что они остаются практически неизменными при добавлении или удалении одного или нескольких составных звеньев.
Вещества неполимерного строения (олигомеры) также включают определенное число (не более 100) повторяющихся составных звеньев, но любое изменение их числа приводит к изменению свойств.
Свойства полимеров определяются размером и строением макромолекул:
-[-СЗ-]n
где: СЗ – составное звено;
n – степень полимеризации.
Неорганические полимеры
Самые распространенные – природные силикаты и алюмосиликаты, составляющие основу земной коры:
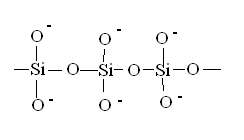
Рис. 24. Полимерные кремнекислородные цепочки в составе силикатов
Органические полимеры
Органические полимеры - основа большинства пластических масс.
![]()
Полиэтилен – один из наиболее распространенных промышленных полимеров. Обладает высокой химической стойкостью, водо- и газонепроницаемостью. Используется как электроизолятор, а также для производства упаковочных пленок, шлангов и т.п.
Недостатки: низкая прочность и устойчивость к свету, растворителям (бензин).
41. Качественный и количественный анализ. Аналитический сигнал. Их роль в технологических процессах.
Аналитический сигнал (признак) – визуально наблюдаемое, инструментально фиксируемое изменение свойств веществ (фазовое состояние, оптические и электрохимические параметры и т. д.).
К аналитическим сигналам (признакам) относят:
1. Образование (или растворение) осадка с определенными свойствами – цветом, растворимостью в определенных растворителях, формой кристаллов.
Пример: образование белого творожистого осадка хлорида серебра
AgNO3 + HCl → AgCl↓ + HNO3
Получение при действии реактива окрашенного растворимого соединения.
Пример: образование синего аммиаката меди
CuCl2 + 4NH3 → [Cu(NH3)4]Cl 2
Качественный анализ
Задачей качественного анализа является обнаружение отдельных элементов или ионов, входящих в состав смеси.
Эта задача может быть решена с помощью химических, физико-химических и физических методов анализа.
Пример: мокрый химический анализ
Разделение катионов на аналитические группы Порядок выделения групп катионов
1. Пятая группа
Выделяется под действием соляной кислоты (групповой реагент), в результате чего образуются нерастворимые в кислотах осадки хлоридов серебра, свинца и ртути (I).
2. Четвертая группа
Выделяется под действием сероводорода (групповой реагент), в результате чего в осадок выпадают сульфиды меди, кадмия, висмута, ртути (II), сурьмы (III, V) и мышьяка (III, V), которые не растворяются в минеральных кислотах, но хорошо растворимы в HNO3 (кроме НgS).
3. Третья группа
Выделяется под действием раствора сульфида аммония (групповой реагент) в присутствии аммонийной буферной смеси (pH 9). При этом образуются малорастворимые гидроксиды алюминия и хрома, а также сульфиды железа (II, III), кобальта, никеля, марганца и цинка, растворимые в разбавленных минеральных кислотах.
4. Вторая группа
Осаждается под действием раствора карбоната аммония (групповой реагент) при pH около 9. В осадок выпадают карбонаты катионов второй аналитической группы – кальция, стронция и бария, хорошо растворимые в кислотах, в том числе и уксусной.
5. Первая группа
После отделения карбонатов второй группы в растворе остаются катионы аммония, натрия калия и магния, относящиеся к первой аналитической группе и не имеющие группового реагента.
Определение катионов в составе каждой группы проводится с использованием реагентов специфических для отдельных катионов.
Количественный анализ
Количественный анализ позволяет определить концентрацию (массу или количество) идентифицируемого вещества в пробе.
Используются химические и инструментальные (физические и физико-химические) методы.
Методы количественного анализа
1. Гравиметрические
2. Титриметрические
3. Оптические
4. Электрохимические
Гравиметрические методы анализа
Определяемый компонент выделяют из раствора в виде труднорастворимого соединения (метод осаждения) или летучего соединения (метод отгонки). Затем осаждаемую форму переводят в гравиметрическую форму, массу которой определяют взвешиванием.
Например, при количественном определении ионов Ca2+, осаждаемой формой является оксалат кальция CaC2O4, а гравиметрической CaO.
При определении в образце кристаллизационной воды методом отгонки, его навеску высушивают и прокаливают. О массе кристаллизационной воды можно судить по уменьшению массы образца или увеличению массы поглотителя водяных паров.
Методы гравиметрии обладают высокой точностью, но трудоемки и длительны, поэтому заменяются методами титриметрии и др.
Титриметрические методы анализа
Титрование осуществляется путем проведения реакций между определенным объемом стандартного раствора (раствора точно известной
концентрации), с раствором содержащим неизвестное количество определяемого вещества.
Стандартный раствор называется титрантом. Объем титранта, затрачиваемый на титрование, измеряют с помощью бюретки. Если объем и концентрация титранта известны, можно рассчитать количество определяемого (титруемого) вещества.
Оптические методы анализа
Спектрофотометрия – метод, основанный на избирательном поглощении раствором электромагнитного излучения в ультрафиолетовой, видимой или инфракрасной областях спектра.
