
- •Физико-химические особенности наноструктурированных материалов: общие сведения
- •Особенности наноструктурного состояния вещества
- •Классификация наноразмерных объектов
- •Различия свойств вещества на поверхности и в объеме
- •Процессы на поверхности и приповерхностных слоях
- •Размерные эффекты наноструктур.
- •Молекулярные кластеры.
- •Металлические кластеры.
- •9. Кластерные частицы
- •10. Газовые безлигандные кластеры
- •11. Коллоидные кластеры
- •12. Твердотельные нанокластеры и наноструктуры
- •13. Кластерные кристаллы
- •14. Фуллериты
- •18. Оптический микроскоп
- •19. Электронный микроскоп. Нейтронный микроскоп.
- •20. Сканирующая зондовая микроскопия. Сканирующий туннельный микроскоп
- •21. Атомно-силовой микроскоп. Типы кантилеверов.
- •22. Сканирующий оптический микроскоп ближнего поля.
- •23. Наноиндентор
- •24. Сканирующие зондовые лаборатории
- •25. Учебное нанотехнологическое оборудование “умка”
- •26. Нановесы
- •27. Спектроскопия. Методы радиоспектроскопии
- •28. Ядерный магнитный резонанс
- •29. Электронный парамагнитный резонанс
- •30. Квантово-химическая модель.
- •31. Расчетные методы квантовой химии. Общая характеристика.
- •32. Первопринципные методы расчета.
- •34. Применение тфп.
- •36. Основы полуэмпирических методов.
- •37. Методы mndo и mndo-pm/3.
- •16.Углеродные нанотрубки
29. Электронный парамагнитный резонанс
Это явление резонансного поглощения электромагнитного излучения парамагнитными частицами, помещёнными в постоянное магнитное поле. Один из методов радиоспектроскопии. Данный метод используется для изучения систем с ненулевым электронным спиновым магнитным моментом.
Ф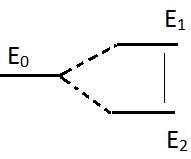 изика
явления: в отсутствие постоянного
магнитного поля Н магнитные моменты
неспаренных электронов направлены
произвольно. Состояние системы таких
частиц вырождено по энергии. При
наложении поля Н проекции магнитных
моментов на направление поля принимают
определённые значения и вырождение
снимается.
изика
явления: в отсутствие постоянного
магнитного поля Н магнитные моменты
неспаренных электронов направлены
произвольно. Состояние системы таких
частиц вырождено по энергии. При
наложении поля Н проекции магнитных
моментов на направление поля принимают
определённые значения и вырождение
снимается.
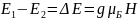
g – фактор спектроскопического расщепления, μБ – магнетон Бора.
Основные параметры спектров ЭПР – интенсивность, форма, ширина резонансной линии, g-фактор, константы тонкой и сверхтонкой структуры.
G-фактор:
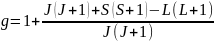
L, S, J – квантовые число соответствуют орбитального, спинового и полного моментов количества движения.
В спектроскопии ЭПР триплетных состояний (S = 1) помимо электро-ядерных взаимодействий (СТВ) необходимо учитывать взаимодействие неспаренных электронов друг с другом.
Техника эксперимента:

К – источник, Р – резонатор, В – детектор, У – усилитель, П- регистрирующее устройство.
Спектрометры обычно работают при частоте 9 ГГц. Длина волны 3,2 см. Магнитная индукция – 0,3 Тл. ЭМИ СВЧ от К по В поступают в объёмный Р.
Чувствительность современных спектрометров достигает 10-9 метра (1011 частиц в образце). При оптимальных условиях регистрации и ширине линий 10-4Тл.
Важная характеристика = временная шкала метода, определяемая частотой СВЧ излучения, падающего на образец с частотой 10-10).
Применение: методом ЭПР можно определить концентрацию и идентифицировать парамагнитные частицы в другом агрегатном состоянии.
ЭПР применяется в радиационной химии, фотохимии, катализе, в изучении процессов окисления и горения т.д.
30. Квантово-химическая модель.
Для описания химической системы необходим учёт множества физических явлений: движение электронов в поле ядер, взаимодействие электронов между собой, релятивистское увеличение массы электронов за счёт ускорения вблизи ядра, квантовые эффекты неопределённости положения и импульса, спиновые и другие эффекты. Поскольку одновременный учёт этих явлений невозможен, используют множество математических моделей, которые учитывают наиболее простые и важные эффекты. Особенностью этих моделей является невозможность их точного аналитического решения.
В отличие от многих простых математических моделей, модели молекулярных систем могут быть решены точно только для тривиальных систем, например, атома Н, молекулярного иона водорода Н2+. Для всех практически значимых химических систем решение соответствующих электронных уравнений возможно только приближенно. При этом точность такого решения определяется не только физическими эффектами, заложенными в математическую модель, но и способом решения уравнения.
Квантово-химическая модель обязана подчиняться 2-м основным принципам:
Уникальность решения. Она даёт уникальное (хотя и приближенное) решение уравнения Шредингера для данной конфигурации ядер, электронного и спинового состояния молекулы.
Трансферабельность. Она применима к химической системы произвольно размера и с произвольной молекулярной структурой (хотя согласие результатов расчёта с экспериментом и практическая осуществимость такого расчёта может зависеть от конкретных параметров системы).
Кроме того желательно, чтобы при использовании моделирования выполнялись ещё несколько дополнительных принципов:
Размерная согласованность – результаты, получаемые для системы, состоящей из 2-х молекул, находящихся от бесконечном расстоянии друг от друга, должны быть точно равны сумме результатов, получаемых для двух изолированных молекул.
Воспроизведение точных результатов соответствующей N-электронной задаче.
Квантово-химический метод, явно учитывающий взаимодействия N-электронов должен давать такое решение, которое совпадает с точным решением уравнения Шредингера для N-электронной задачи, допускающей точное (аналитическое) решение.
Вариационность – энергия, предсказываемая методом, должна быть верхней границей точного решения электронного уравнения. Более точный метод должен давать более низкое значение энергии, чем его предшественники.
Точность – в идеале модель должна давать высокоточные количественные результаты, совпадающие с экспериментом в пределах экспериментальной погрешности. Как минимум, модель должна предсказывать качественные закономерности для групп молекулярных систем.
Вычислительная эффективность – расчёты в рамках данной модели должны быть осуществимы с использованием современных компьютерных технологий.
