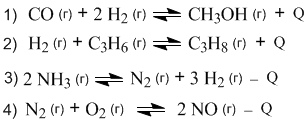- •6.1.8. Гомогенный катализ
- •6.1.9. Гетерогенный катализ
- •14. Молекулярная структура воды
- •Основные физико-химические свойства воды и их влияние на биохимические процессы
- •15. 10.5. Автопротолиз воды
- •Водородный показатель (рН)
- •18. 6.4. Способы выражения состава растворов
- •Способы выражения состава растворов
11. Скорость химической реакции – это изменение количества реагирующего вещества или продукта реакции за единицу времени в единице объема (для гомогенной реакции) или на единице поверхности раздела фаз (для гетерогенной реакции).
Зависимость скорости реакции от температуры
Правило Вант – Гоффа. Повышение температуры ускоряет большинство химических реакций. Согласно эмпирическому правилу Вант- Гоффа при повышении температуры на 10 К скорость многих реакций увеличивается в 2 – 4 раза
![]()
где v2 и v1 - скорости реакции при температурах Т2 и Т1, γ - коэффициент, значение которого для эндотермической реакции выше, чем для экзотермической. Для многих реакций γ лежит в пределах 2 – 4.
При концентрациях реагирующих веществ 1 моль/л скорость реакции численно равна константе скорости k. Правило Вант – Гоффа запишется так:
![]()
Уравнение показывает, что константа скорости зависит от температуры так же, как и скорость процесса.
Эти два уравнения можно использовать лишь для ориентировочных расчетов, так как точность их не очень высока.
Уравнение Аррениуса
В 1889 г. шведский ученый Сванте Аррениус на основании экспериментов вывел уравнение, которое названо его именем
![]() ,
,
где k – константа скорости реакции; А – предэкспоненциальный множитель; е – основание натурального логарифма; Еа – постоянная, называемая энергией активации, определяемая природой реакции. Значения Еа для химических реакций лежат в пределах 40 – 400 кДж/ моль.
После логарифмирования уравнение имеет вид
![]()
Е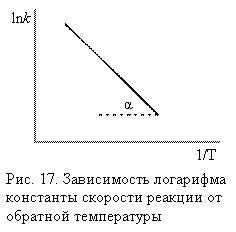 сли
представить графическую
зависимость lnk = f(1/T),
то она имеет вид (рис 17).
сли
представить графическую
зависимость lnk = f(1/T),
то она имеет вид (рис 17).
Здесь tgα = -Еа/R и Еа = - Rtgα. Отрезок, отсекаемый на оси ординат равен lnА.
Итак, константа скорости реакции (и скорость) возрастает с увеличением температуры по экспоненциальному закону. В соответствии с уравнением Аррениуса константа скорости реакции уменьшается с ростом энергии активации. Уравнение Аррениуса позволяет рассчитывать константы скорости (и скорости) при различных температурах.
12. Зависимость скорости реакции от катализатора
Катализаторы – вещества, не расходующиеся в результате протекания реакции и не входящие в состав конечных продуктов реакции, но увеличивающие скорость реакции. Катализаторы могут участвовать в образовании промежуточных продуктов реакции, но к концу реакции они полностью регенерируются.
Явление изменение скорости под действием катализатора называется катализом, а реакции - каталитическими.
Теория каталитических реакций основана на следующих положениях:
а) катализ применим для реакций, в которых для данных условий энергия Гиббса отрицательна (G < 0);
б) в присутствии катализатора изменяется механизм реакции, она протекает через новые стадии с невысокой энергией активации;
в) при катализе не изменяется тепловой эффект реакции;
г) для обратимых реакций катализатор не влияет на равновесие, не меняет константы равновесия и равновесных концентраций;
д) катализатор действует селективно (избирательно).
В настоящее время общепризнано, что катализаторы уменьшают полную энергию активации процесса, т.к. каталитический процесс идет по другому пути, через другое переходное состояние, с образованием других промежуточных частиц. Активированный комплекс с участием катализаторов, имеет меньшую энергию, чем комплекс без катализаторов, поэтому энергия активации каталитической реакции ниже, чем энергия некаталитической реакции, т.е. Еа > Еак. (рис.19).
![]()
 Различают
гомогенный и гетерогенный катализ.
Различают
гомогенный и гетерогенный катализ.
6.1.8. Гомогенный катализ
Катализаторы, которые находятся в системе в том же фазовом состоянии, что и реагенты, называются гомогенными. Механизм гомогенного катализа можно объяснить на основе теории промежуточных соединений. Большой вклад в развитие этой теории внесли П. Сабатье (Франция) и Н.Д. Зелинский (Россия). Согласно этой теории, катализатор образует с реагентами промежуточные соединения. Это приводит к уменьшению энергии активации реакции. Например, реакция:
АВ + D → A…B…D → A + BD
в присутствии катализатора К может проходить по схеме:
D
+ K ![]() D…K
DK
D…K
DK
DK + AB A…B…D…K → A + BD + K
Катализатор, как видим, не входит в продукты и не изменяет своего состава.
Примером каталитической гомогенной реакции является процесс окисления оксида углерода в присутствии паров воды:
2СО
+ О2 ![]() 2СО2.
2СО2.
6.1.9. Гетерогенный катализ
Если катализаторы и реагенты находятся в разных фазах и имеют границу раздела, то катализ называется гетерогенным. Катализатор является твердым веществом, а реагирующие вещества – газы или жидкости. Реагирующие молекулы адсорбируются на поверхности катализатора, и за счет ориентации определенным образом и ослабления внутримолекулярных связей снижается энергия активации и увеличивается скорость реакции.
Пусть в отсутствии катализатора протекает реакция
А + В = АВ* = Продукты,
а в присутствии катализатора скорость ее возрастает, но продукты остаются теми же. Если считать, что активное адсорбционное состояние аналогично активированному комплексу АВ некаталитической реакции, то весь процесс можно изобразить следующим образом.
1. Адсорбция исходных веществ на поверхность катализатора:
А + В + Кт = АВКт
Как правило, этот процесс экзотермический.
2. Перевод адсорбированного состояния в активное:
АВКт = АВКт*
Этот процесс требует затраты энергии, называемой истинной энергией активации.
3. Реакция в адсорбированном состоянии с образованием адсорбированных конечных продуктов:
АВКт* = Продукты Кт
4. Десорбция продуктов реакции, приводящая к регенерации катализатора:
Продукты Кт = Продукты + Кт
Таким образом, и в гетерогенном катализе ускоряющее действие катализатора, так же как и в гомогенном катализе, связано с тем, что реагирующие вещества образуют промежуточные соединения, что приводит к снижению энергии активации.
Уравне́ние Михаэ́лиса — Ме́нтен — основное уравнение ферментативной кинетики, описывает зависимость скорости реакции,катализируемой ферментом, от концентрации субстрата и фермента. Простейшая кинетическая схема, для которой справедливо уравнение Михаэлиса:
![]()
Уравнение имеет вид:
![]() ,
,
где
 —
максимальная
скорость реакции, равная
—
максимальная
скорость реакции, равная 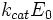 ;
;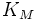 —
константа
Михаэлиса, равная концентрации субстрата,
при которой скорость реакции составляет
половину от максимальной;
—
константа
Михаэлиса, равная концентрации субстрата,
при которой скорость реакции составляет
половину от максимальной;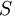 —
концентрация
субстрата.
—
концентрация
субстрата.
[править]Вывод уравнения
Вывод уравнения был впервые предложен Бриггсом и Холдейном. Вывод уравнения скорости ферментативной реакции, описываемой схемой Михаэлиса-Ментен.
Обозначения констант скоростей:
k1 — константа скорости реакции образования фермент-субстратного комплекса из фермента и субстрата
k-1 — константа скорости реакции диссоциации фермент-субстратного комплекса на фермент и субстрат
k2 — константа скорости реакции превращения фермент-субстратного комплекса в фермент и продукт
Для фермент-субстратного комплекса применим метод квазистационарности, так как в подавляющем большинстве реакций константа скорости превращения фермент-субстратного комплекса в фермент и продукт много больше, чем константа скорости образования ферменто-субстратного комплекса из фермента и субстрата. Иными словами:
![]()
Учтем тот факт, что фермент, изначально находившийся только в свободной форме, в процессе реакции находится как в виде фермент-субстратного комплекса, так и в виде молекул свободного фермента. Таким образом:
![]()
Преобразуем это к виду:
![]()
И подставим в первое уравнение. После раскрытия скобок и группировки слагаемых получим следующее:
![]()
Выразим отсюда концентрацию фермент-субстратного комплекса:

Скорость ферментативной реакции в целом (то есть скорость образования продукта) представляет собой скорость распада фермент-субстратного комплекса по реакции первого порядка с константой k2:
![]()
Подставим в эту формулу выражение, которое мы получили для концентрации ES. Получим:
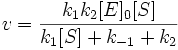
Разделим числитель и знаменатель на k1. В результате:
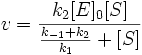
Выражение в знаменателе — (k-1+k2)/k1 — называется константой Михаэлиса (Km). Это кинетическая константа (с размерностью концентрации), которая равняется такой концентрации субстрата, при которой скорость ферментативной реакции составляет половину от максимального значения.
Для начальной стадии реакции можно пренебречь уменьшением концентрации субстрата. Тогда выражение для начальной скорости реакции будет выглядеть так:
![]()
Если k-1>k2, то на первой стадии ферментативной реакции с течением времени устанавливается равновесие (квазиравновесный режим протекания реакции), и в выражение для скорости ферментативной реакции входит уже не константа Михаэлиса, а субстратная константа KS, характеризующая взаимодействие фермента с субстратом в равновесных условиях:
![]() ;
; ![]()
13. Химическое равновесие. Принцип Ле Шателье.
Химические реакции, которые протекают со сравнимыми скоростями в обоих направлениях, называются обратимыми. В таких реакциях образуются равновесные смеси реагентов и продуктов, состав которых далее уже не меняется со временем. Например, при нагревании происходят следующие превращения:

У этой равновесной системы есть замечательное свойство: ее состав не зависит от способа получения. Можно нагревать смесь газообразных водорода и йода, а можно взять для опыта чистый HI – результат будет одним и тем же: образуется равновесная смесь трех веществ (H2, I2, HI) одного и того же состава. Для внешнего наблюдателя в такой системе химические превращения не происходят, но на самом деле здесь постоянно идут прямая и обратная реакции. Рассмотрим эту систему с точки зрения химической кинетики.
Допустим, для опыта взяли газообразные водород и йод. В первый момент времени еще нет HI, поэтому идет только прямая реакция, скорость которой (vпр) выражается кинетическим уравнением:
vпр = k1[H2][I2]
Здесь k1 – константа скорости прямой реакции. Постепенно в смеси накапливается продукт реакции HI. Но в этих же условиях йодистый водород с заметной скоростью разлагается на исходные вещества: H2 и I2. Скорость обратной реакции (vобр) выражается кинетическим уравнением с константой скорости k2:
vобр = k2[HI]2
Когда йодистого водорода образуется уже достаточно много (т.е. когда его концентрация достигнет определенной величины), скорости прямой и обратной реакции выравниваются:
vпр = vобр
В этом случае говорят, что наступило химическое равновесие. Количество содержащихся в равновесной системе веществ H2, I2 и HI теперь не меняется со временем, если нет внешних воздействий на систему.
Химическим равновесием называется такое состояние химической системы, при котором количества исходных веществ и продуктов не меняются со временем.
Химическое равновесие носит динамический характер. Например, в приведенной реакции HI постоянно образуется и расходуется. Если добавить в такую равновесную смесь радиоактивный йод, то он быстро распределяется между молекулами I2 и HI. Это говорит о постоянном переходе атомов йода из исходного вещества в продукт реакции и обратно.
Можно ли изменить состояние химического равновесия? Иными словами – можно ли сдвинуть равновесие в сторону образования продуктов или в сторону образования исходных веществ?
Ответ на этот вопрос подсказывают кинетические уравнения прямой и обратной реакций. Если добавлять в равновесную систему извне «лишний» водород, то возрастет величина молярной концентрации [H2] в кинетическом уравнении прямой реакции. Следовательно, увеличится скорость прямой реакции vпр, а скорость обратной реакции vобр останется неизменной. В итоге израсходуется какая-то часть добавленного водорода, а равновесие сместится вправо, т.е. в сторону образования продукта реакции. Такой же эффект даст и введение в систему дополнительных порций I2.
Напротив, добавление HI приведет к сдвигу равновесия влево. Это подтверждает кинетическое уравнение обратной реакции (vобр): она получит преимущество, поскольку возрастет величина [HI]2.
Мы можем заметить важную закономерность: при попытке воздействовать на равновесную систему она «сопротивляется» такому воздействию. Действительно, добавление в равновесную систему H2 или I2 приводит к увеличению их расходования в прямой реакции. В итоге H2 или I2 в системе окажется меньше, чем было добавлено, зато возрастет количество HI. Наоборот, добавление HI приводит к более быстрому его расходованию в обратной реакции. Такая способность равновесных систем «сопротивляться» внешним воздействиям носит общий характер и известна под названием принципа Ле Шателье:
Если на равновесную систему воздействовать извне, изменяя какой-нибудь из факторов, определяющих положение равновесия, то в системе усилится то направление процесса, которое ослабляет это воздействие.
** Анри Луи Ле Шателье (1850-1936) – французский физикохимик, Президент Французского химического общества, член многих академий, в том числе Петербургской АН. Был почетным членом и АН СССР. Независимо от немецкого химика Ф. Габера в 1901 г. нашел условия синтеза аммиака (см. ниже).
В некоторых учебных пособиях формулировку принципа Ле Шателье упрощают: равновесная система, на которую оказывают воздействие, смещает равновесие так, чтобы уменьшить влияние этого воздействия. На самом деле не всякое воздействие может приводить к смещению равновесия, а только определяющее. Например, рассмотрим ту же реакцию между H2 и I2 . Давление в данной конкретной системе не является определяющим фактором, поскольку в прямой и обратной реакциях образуется одинаковое количество молекул газа. В итоге ни одна из реакций не получает преимущества при изменении концентраций газов и положение равновесия не меняется. Таким образом, для смещения равновесия надо изменять только те параметры, которые являются для данной реакцииопределяющими. В рассмотренном случае давление не является таким фактором.
Приведем пример реакции, в которой важным для положения равновесия фактором является давление. Она тоже происходит в газовой фазе:
2
NO2 (г)
![]() N2O4 (г)
N2O4 (г)
При комнатной температуре NO2 – темно-коричневый газ (часто его называют «бурым» газом). Продукт его димеризации N2O4 бесцветен. Оба газа при обычных условиях присутствуют в смеси, т.е. находятся в химическом равновесии. Если увеличивать в такой равновесной химической системе давление, то равновесие сдвигается вправо – в сторону образования N2O4. Дело в том, что при одновременном увеличении концентрации [NO2] и [N2O4] преимущество получает прямая реакция. В ее кинетическое уравнение концентрация [NO2] входит в квадрате:
vпр = k1[NO2]2; vобр = k2[N2O4]
Происходящий при этом сдвиг равновесия вправо можно наблюдать экспериментально: при сжатии смеси газов она светлеет, поскольку уменьшается концентрация окрашенного NO2 и возрастает концентрация бесцветного N2O4 (рис. 1-12).
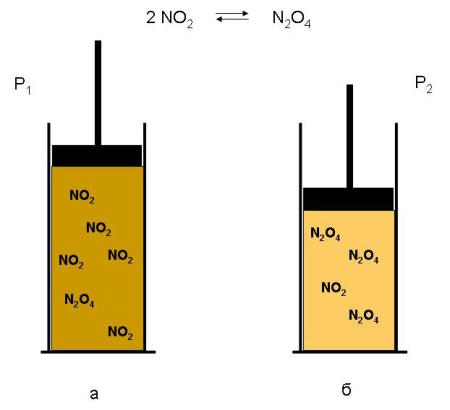
Рис. 1-12. При увеличении давления (Р2 > Р1) общее количество молекул в равновесной смеси уменьшается – система «сопротивляется» повышению давления: а) в системе больше молекул NO2 (смесь интенсивно окрашена); б) после увеличения давления молекул NO2становится меньше (окраска ослабевает).
Но на равновесные реакции в растворах изменение давления не оказывает заметного влияния, если только в реакции не выделяется какой-нибудь газ. Дело в том, что жидкости почти не сжимаются под давлением, и концентрации растворенных в них реагирующих веществ практически не изменяются (если это не газообразные реагирующие вещества).
С помощью кинетических уравнений прямой и обратной реакций можно вывести закон действующих масс для химического равновесия. Пусть происходит обратимая реакция:
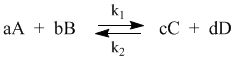
Здесь а, b, c, d – коэффициенты перед веществами в химических уравнениях прямой и обратной реакций. В этом случае можно записать кинетические уравнения:
vпр = k1[A]a[B]b; vобр = k2[C]c[D]d
При наступлении равновесия скорости прямой и обратной реакции становятся равны (vпр = vобр) и можно записать:
k1[A]a[B]b = k2[C]c[D]d
Из этого соотношения можно получить константу равновесия Кр, которая равна отношению констант скорости прямой и обратной реакций:

В предыдущем уравнении достаточно перенести в левую часть k2

а из полученного уравнения уже легко получается выражение для константы равновесия Кр:

Это не что иное, как математическая запись закона действующих масс для химического равновесия. Например, для рассмотренной выше реакции
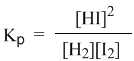
Константа равновесия определяется экспериментально. Численное значение Кр характеризует положение равновесия при данной температуре и не меняется с изменением концентраций реагирующих веществ.
До сих пор мы использовали кинетические уравнения для выяснения вопроса о сдвиге химического равновесия в ту или иную сторону. И хотя далеко не для всех реакций их кинетические уравнения соответствуют химическим уравнениям, качественно определить направление смещения равновесия таким способом удается. Например, для сложной гетерогенной химической реакции
Fe3O4 (тв) + СО (г) 3 FeO (тв) + СО2 (г) + Q кДж
можно предсказать, что изменение давления не приведет к смещению равновесия. Здесь скорости прямой и обратной реакции зависят в основном от концентраций газов (которые при изменении давления меняются одинаково), а твердые вещества не входят в кинетические уравнения.
vпр = k1[CO]; vобр = k2[CO2]
Теплоту тоже можно рассматривать как «продукт» реакции. Следовательно, нагревание такой равновесной смеси должно приводить к активизации обратной реакции и смещению равновесия влево – в сторону образования исходных Fe3O4 и CO.
Наоборот, отведение образующегося тепла (понижение температуры) будет уменьшать скорость обратной реакции и равновесие сдвинетсявправо – в сторону продуктов FeO и CO2.
Можно не пользоваться для решения таких вопросов кинетическими уравнениями, а прямо применить принцип Ле Шателье. Действительно, при нагревании равновесной системы с оксидами железа она должна сопротивляться этому воздействию – то есть замедлять прямую реакцию, идущую с выделением тепла. Точно так же (без кинетических уравнений) можно решать вопрос о смещении равновесия при увеличении давления в системе
2 NO2 (г) N2O4 (г)
Для того, чтобы «сопротивляться» увеличению давления, эта система должна активизировать реакцию, приводящую к уменьшению общего числа молекул в смеси. Такой реакцией является прямая реакция, в которой из двух молекул газа получается одна. Следовательно, преимущество получит прямая реакция и равновесие сдвинется вправо.
Способы смещения химического равновесия играют большую роль в химической промышленности. Например, синтез аммиака является обратимой, экзотермической, каталитической реакцией:
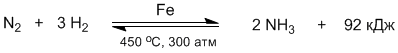
Во всех рассмотренных до сих пор реакциях, кроме синтеза аммиака, кинетические уравнения прямых и обратных реакций соответствовали их химическим уравнениям. Но получение аммиака и обратная реакция его разложения – это сложные, многостадийные процессы, состоящие на самом деле из нескольких элементарных стадий. Поэтому выражение для константы равновесия в синтезе аммиака нельзя записать на основании формального закона действующих масс. Выражение для Кр в таких случаях можно получить, только опираясь на экспериментальные данные.
Однако принцип Ле Шателье позволяет качественно подобрать условия, наиболее подходящие для сдвига равновесия вправо, т.е. в сторону максимально возможного содержания аммиака в равновесной смеси. Это имеет большое практическое значение – ведь чем больше равновесие сдвинуто вправо, тем больше аммиака можно получать в промышленной установке.
Принцип Ле Шателье говорит о том, что для смещения равновесия вправо нужно, во-первых, повышать давление. Действительно, при повышении давления система будет «сопротивляться» возрастанию концентрации газов – для этого активизируется прямая реакция превращения четырех молекул газа (одной молекулы азота и трех водорода) в две молекулы газообразного аммиака. Во-вторых, необходимо отводить образующееся в реакции теплоту, т.е. понижать температуру. Если температуру повышать, то обратная реакция ускорится в большей степени, поскольку она идет с поглощением теплоты. Однако если охлаждать реактор слишком сильно, то обе реакции замедляются и равновесие устанавливается слишком медленно.
В промышленности находят компромисс – давление в аппаратах синтеза аммиака держат настолько высоким, насколько может выдержать их конструкция, а температуру выбирают средней, при которой равновесие в системе наступает достаточно быстро и в то же время не слишком сильно смещено в сторону исходных веществ – азота и водорода. Этой же цели служит и железный катализатор – он ускоряет наступление химического равновесия. Как вы уже знаете, катализаторы одинаково хорошо ускоряют как прямую, так и обратную реакции, поэтомудобавление катализатора не может изменить положение равновесия, но способствует более быстрому его достижению.
Промышленное получение аммиака из атмосферного азота имеет огромное значение для современной цивилизации. Азот – весьма инертное вещество и его соединения в виде полезных ископаемых (селитр) встречаются очень редко. В то же время растения нуждаются в азоте, поэтому современное сельское хозяйство требует интенсивного применения все большего количества азотных удобрений, которые делают на основе аммиака. Также аммиак служит сырьем для производства азотной кислоты, а уже с участием HNO3 осуществляются многие другие важнейшие промышленные процессы – от получения лекарств и взрывчатых веществ до переработки ядерного топлива.
ЗАДАЧИ.
1.22. В каких реакциях изменение давления окажет влияние на смещение равновесия?
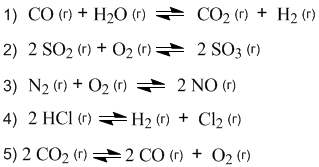
1.23. В какой из реакций предыдущей задачи повышение давления приводит к сдвигу равновесия влево?
1.24. ** (ФМШ) Реакция протекает по уравнению: 2 А В. Константа равновесия равна 0,25. Найдите равновесные концентрации, если начальная концентрация [А]н = 4 моль/л. Примечание: если задача не решается, воспользуйтесь подсказкой в конце раздела. Но не торопитесь и подумайте еще - ведь на экзамене подсказок не будет!
1.25. Рассчитайте, во сколько раз изменятся скорости прямой и обратной реакции в равновесной системе
2 NO (г) + О2 (г) 2 NО2 (г)
при увеличении давления вдвое. Исходя из результатов расчета, решите, как отразится такое изменение давления на положении равновесия. (Примечание: для расчета можно брать любые исходные концентрации веществ - результат от этого не изменится. Исследуйте задачу и убедитесь в этом сами).
1.26. Примените принцип Ле Шателье к условиям и вопросу задачи 1.24. Убедитесь в том, что вывод о направлении смещения равновесия качественно совпадает с результатом количественного расчета.
1.27. В какой из четырех реакций равновесие больше всего сместится вправо при одновременном повышении температуры и понижении давления?