
- •48. Третий закон термодинамики и постулат Нернста.
- •16) Метод валентных связей при расчете молекулы водорода, вариационный метод.
- •17) Смысл обменного и кулоновского интеграла
- •19) Понятие 'связывающих’ и ‘разрыхляющих’ орбиталей при анализе прочности связи атомов в молекуле.
- •21. Ковалентная связь и ее особенности
- •22. Донорно-акцепторная связь (дас) и ее особенности.
- •23. Ионная связь и понятие электроотрицательности
- •24. Понятия ‘изолированная’, ’открытая’, ’закрытая’ система, равновесный и неравновесный процесс.
- •26. Взаимосвязь теплоты, внутренней энергии и работы при постоянном давлении, объеме и т.
- •27. Работа системы при отсутствии теплообмена с окр. Средой, теплоемкость системы.
- •28. Взаимосвязь теплоемкости при постоянном давлении и объеме для идеальных газов и кристаллов.
- •20. Энергия ионизации (эи) и сродства к электрону.
- •25. I закон тд. Соотношение между теплотой внутренней энергией и работой.
- •29. Влияние температуры на теплоемкость.
- •30. Теплоемкость Эйнштейна и характеристическая т Эйнштейна.
19) Понятие 'связывающих’ и ‘разрыхляющих’ орбиталей при анализе прочности связи атомов в молекуле.
Можно
также показать, что 2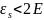 0,
т.е. энергии, соответствующая нахождению
2х электронов на орбитали
0,
т.е. энергии, соответствующая нахождению
2х электронов на орбитали
 меньше, чем энергия 2х электронов на
самых нижних орбиталях 2х невзаимодействующих
атомов водорода Н, находящихся
меньше, чем энергия 2х электронов на
самых нижних орбиталях 2х невзаимодействующих
атомов водорода Н, находящихся
 далеко друг от друга. Это означает, что
2 электрона, оказавшись на орбитали
обеспечивают паре атомов Н более
выгодное энергетическое СС, чем в
случае, когда эти атомы Н являются
невзаимодействующими, т.е. 2-м атомам Н
выгодно превратиться в молекулу. По
этой причине орбиталь
называют связывающей.
далеко друг от друга. Это означает, что
2 электрона, оказавшись на орбитали
обеспечивают паре атомов Н более
выгодное энергетическое СС, чем в
случае, когда эти атомы Н являются
невзаимодействующими, т.е. 2-м атомам Н
выгодно превратиться в молекулу. По
этой причине орбиталь
называют связывающей.
Оказавшись
на орбитали
 2 эл-на увеличивают свою энергию системы
в сравнении со случаем, когда атомы
удалены друг от друга. Такое состояние
для двух атомов Н невыгодно и атомы
расходятся на
большое расстояние. По этой причине
орбиталь называют разрыхляющей
орбиталью. Эл-ны, оказавшиеся на этой
орбитали, разваливают молекулу.
2 эл-на увеличивают свою энергию системы
в сравнении со случаем, когда атомы
удалены друг от друга. Такое состояние
для двух атомов Н невыгодно и атомы
расходятся на
большое расстояние. По этой причине
орбиталь называют разрыхляющей
орбиталью. Эл-ны, оказавшиеся на этой
орбитали, разваливают молекулу.
21. Ковалентная связь и ее особенности
Существенной особенностью гетеронуклеарной молекул явл-ся то, что заряд в них смещен к атому с большим атомным номером. Даже если связь м/у мол-ми определяет только 1 электрон, большую часть времени этот электрон проводит у атома с большим зарядом ядра. В результате заряд всей молекулы оказывается асимметричным и у молекулы появляется электронный дипольный момент. Молекула становится полярной. Большинство молекул хар-ся не чисто ковалентной, а ковалентно-ионной связью. При этом ковалентная составляющая обладает способностью насыщаться. Насыщаемость ковалентной связи обусловлено механизмом ее появления. Этот механизм предполагает спаривание электронов. Поскольку принцип Паули недопускает более чем 2 эл-на на 1 орбиталь, то в соответствии этому принципу при образовании связи неминуемо ведет к насыщению.
22. Донорно-акцепторная связь (дас) и ее особенности.
Донорно-акцепторная связь хар-ет сближение 2 частиц таким образом, что свободная низкая орбиталь одной частицы оказывается без эл-ов и может принять эл-ны от другой частицы, а полностью занятая орбиталь другой частицы может отдать эл-ны. Это происходит при сближении частиц.
23. Ионная связь и понятие электроотрицательности
Ионная связь характерна для случая сильной полярности образования состоящая из нескольких атомов или молекул. Когда ковалентная связь по сути своей ведет тем не менее не к обобществлению связывающих электронов, а к их концентрации у одного из атомов. Степень полярности связи наиболее непосредственно хар-ся дипольным моментом, часто для этого используется также концепция электроотрицательности. ЭО атома это способность его в молекуле притягивать на себя эл-н. полярность молекулы определяется разностью ЭО. Когда разность >= имеем ионную связь.
24. Понятия ‘изолированная’, ’открытая’, ’закрытая’ система, равновесный и неравновесный процесс.
Термодинамическая система – тело или группа тел, отделенных от других тел границей раздела. Открытая система – система, обменивающая с окр. средой энергией и веществом. Закрытая система – система, обменивающая с окр средой только энергией. Изолированная система – система, необменивающая ни энергией, ни веществом. Под равновесным процессом понимают бесконечно медленно протекающий процесс через непрерывный ряд состояний близких к равновесным. Если такой процесс провести сначала прямом, а после в обратном направлении, то работы совершенные при этих процессах будет равна, то процесс называется обратимым. НЕРАВНОВЕСНЫЕ ПРОЦЕССЫ в термодинамике и статистической физике, физ. процессы, включающие неравновесные состояния. Пример: процесс установления равновесия (термодинамич. или статистич.) в изолированной системе, находящейся в неравновесном состоянии.
