
- •48. Третий закон термодинамики и постулат Нернста.
- •16) Метод валентных связей при расчете молекулы водорода, вариационный метод.
- •17) Смысл обменного и кулоновского интеграла
- •19) Понятие 'связывающих’ и ‘разрыхляющих’ орбиталей при анализе прочности связи атомов в молекуле.
- •21. Ковалентная связь и ее особенности
- •22. Донорно-акцепторная связь (дас) и ее особенности.
- •23. Ионная связь и понятие электроотрицательности
- •24. Понятия ‘изолированная’, ’открытая’, ’закрытая’ система, равновесный и неравновесный процесс.
- •26. Взаимосвязь теплоты, внутренней энергии и работы при постоянном давлении, объеме и т.
- •27. Работа системы при отсутствии теплообмена с окр. Средой, теплоемкость системы.
- •28. Взаимосвязь теплоемкости при постоянном давлении и объеме для идеальных газов и кристаллов.
- •20. Энергия ионизации (эи) и сродства к электрону.
- •25. I закон тд. Соотношение между теплотой внутренней энергией и работой.
- •29. Влияние температуры на теплоемкость.
- •30. Теплоемкость Эйнштейна и характеристическая т Эйнштейна.
1. Постулат о
волновой функции и ее смысл. Постулат
о волновой функции частиц, образующих
систему
 Сущ-ет ф-ция коорд-т и времени, используя
которую можно расч-ть ве-ть обнар-я
частицы в некоторой области простр-ва.
Эта же ф-ция позволяет рассчитать вер-ть
обнар-ния у этой частицы опред. величины
P.
Сущ-ет ф-ция коорд-т и времени, используя
которую можно расч-ть ве-ть обнар-я
частицы в некоторой области простр-ва.
Эта же ф-ция позволяет рассчитать вер-ть
обнар-ния у этой частицы опред. величины
P.


Сама по себе ф-ция состояния ψ не имеет физ. смысла. Смысл имеет квадрат ее модуля.
3. Постулат о средней величине энергии. Ср. значение энергии системы частиц может быть рассчитана

2. Постулат Шредингера (уравнение Шредингера) в физической химии. Позволяет опр-ть (рассчитать) ф-цию ψ

Для ФХ особое значение имеет ситуация, когда ψ от времени не зависит


 – Гамильтониан
– Гамильтониан
Решения квантомеханических задач сводится к опред-ю ф-ции V в случае, когда рассчитана ф-ция V и остается решить ур-ие. Решение этого ДУ может быть найдена с точностью до пост-го множителя. Из теории спец. ф-ций следует, что решений получается несколько:
E1 ψ1, a ψ1, b ψ1, …
E2 ψ2, a ψ2, b ψ2, …
Еще
одна особенность ψ1,
ψ2
и т.д. явл-ся то, что

Какому-либо знач-ю энергии может соотв-ть несколько ф-ций ψ, отлич-ся друг от друга не только пост. множителями. В этом случае сост-е с энергией Ei наз-ся вырожденным. Если этих ф-ций 2 => дважды вырожденным и т.д.
4. Постулат Паули (принцип запрета Паули). В одном состоянии не может быть двух частиц, обладающих одними и тем же значениями четверки квантовых чисел n, l, ml, ms.Это ограничение характерно для частиц, называющихся фермионами и подчиняется статистике Ферми-Дирака и облад-щих ½ спинами. Для этих частиц ф-ция состояния как решение ур-я Шредингера (УШ) должна быть ассиметрична, т.е. при перестановке 2х электронов, состояние которых описывает эта ф–ция, волновая ф-ция должна менять значение. В то же время решением УШ явл-ся еще одна ф-ция, тоже непрервная, так же однозначная, так же симметрична. Она описывает поведение частиц, называемых базонами.
5. Постулат о самосопряженном операторе. Каждой динамической переменной классической физики (координате, импульсу, энергии и т.д.) в квант-й механике соотв-т опред-ный линейный самоспряж-й оператор.


Линейный оператор

C1 и С2 – константы
 – линейный
– линейный
Самосопряженный, если

7. Первое приближение при решении уравнения Шредингера. Заключается в том, что при расчете ф-ции сост-я электронов точное значение Гамильтониана, включающее внешнее, внутр-е и электростат-е взаимод-е заменяют H, учит-щее только электростат.

Под Hвнеш понимается возд-вие на систему эл-нов внешних полей. Принебречь можно, т.к. в пределах произв-х установок и полеземли, и гравитация примерно неизменны и сравнительно легко учит-ся поправки. Под Hвнутр понимается взаим-вие м/уядрами, обр-щими молекулу. Там действ-т молекул-ные силы, достаточно стабильные, слабо подверг-ся возд-вию электронов.
8. Второе приближение при решении уравнения Шредингера (Оппенгеймера). Адиабатическое приближение Борна-Оппенгеймера. Масса ядер в 103-105 больше, чем масса всех электронов => можно не учитывать изменение расст-я м/у ядрами в процессе хим. Превращений. Можно не учитывать их колебания т.е. расстояние м/у ядрами R входит в расчетное соотношение как параметр или как const.
6.
Постулат о суперпозиции состояний.
Если частица может нах-ся в сост-ях ψ1
и ψ2,
то линейная суперпозиция двух состояний,
в которых может нах-ся частица
 - лин. суперпозиция двух состояний
- лин. суперпозиция двух состояний
С1
и С2
нах-ся из условия нормировки:

9.
Третье приближение при решении уравнений
Шредингера (Хартри - Фока).
Это приближение заключается в том, что
Хартри предложил исследовать поведение
отдельного электрона, т.е. рассчитывать
ф-цию его состояния, не учитывая
взаимодействие этого электрона с каждым
из других эл-нов в отдельности, а вместо
этого ввести в Гамильтониан некоторое
эффективное поле, усреднено учитывающее
действие всех эл-нов на исслед-й электрон.
Это эффективное поле можно опред-ть
экспер-но, тем более что любая величина
для исслед. эл-на рассчит-ся в среднем,
а в дальнейшем если такое приближение
окажется грубым, его можно уточнять и
уточнять. Используя приближение Х-Ф
определяют ф-цию состояния для каждого
из эл-в системы Hiφi=Eφi

Приближение Хартри учитывает пространственные координаты электрона, связанные с его орбитальным моментом => определяемая ф-ция состояния наз-ся орбитальной.
11. Метод молекулярных орбиталей и линейной комбинации атомных орбиталей при анализе основного состояния молекулы. Для определения волновых ф-ций не отдельного атома, а системы атомов, объединенных в молекулы, когда эл-ны нах-ся в поле, не обладающим сферич-й симметрией, Ф определяет 2 метода: метод Валентных связей и метод молекулярных орбиталей. Оба метода дают приближения. В одних ситуациях применяется один метод. в других – другой. В ММО все орбитали рассчит-ся для всей системы ядер. Т.е. для каждого из эл-нов, входящих в состав молекулы в гамильтониан включают энергию взаимодействия эл-нов с 1, 2, 3 и т.д. ядром. В одной из разновидностей ММО после того, как записан H-ан проверяют на пригодность в качестве ф-ций состояния ф-цию, составленную из атомных орбиталей отд. атомов:



Метод
линейн-х комб-ций атомных орбиталей
(МЛКАО) – одна из ММО. Ф-ция состояния
молекул-х орбиталей строятся по привед-й
схеме.
 - ф-ция состояния всей молекулы. Энергия
молекулы опред-ся по формуле
- ф-ция состояния всей молекулы. Энергия
молекулы опред-ся по формуле
 ;
;
 – кол-во электронов;
– кол-во электронов;
 - энергия эл-на на i-ой орбите
- энергия эл-на на i-ой орбите
10.
Четвертое приближение при решении
уравнения Шредингера (средней энергии).
Т.к. в ФХ
большое значение имеет ср. энергия
системы и методы ее опред-я (именно оно
опред-т напр-е хим. реакций) в квантовой
химии разработаны методики опр-я ср.
значения энергии системы

Если
ф-цию состояния представить в виде
линейн-й комб-ции ф-ций сост-я отд-х
атомов, то рассчитать ср .значение
энергии системы можно методом вариаций
кэф-в C1
… CN
(вариационное Т). Один из коэф-в, например
Ci
,считается переменной величиной, ε –
тоже, а ост-ное – const.
 => 1е ур-ние
=> 1е ур-ние
Дальше
дифф-ем по след. const,
меняем индекс
 .
Всего будет n уравнений. Решая эти ур-я
можно получить набор значений ε. Min из
этих значений рассм-ся как энергия
основного состояния системы, остальные
– как возбужд. состояний системы
(выделение основного состояния необходимо
потому, что любая система -> min своей
энергии, а именно такими состояниями
занимается ФХ). Далее εmin
подставляем в 1, 2, …, n ур-ния, находим
соотношение м/у C1,
C2,
и Cn.
Полученные значения (C1,
C2,
…) подставляем в ур-ние нормировки
.
Всего будет n уравнений. Решая эти ур-я
можно получить набор значений ε. Min из
этих значений рассм-ся как энергия
основного состояния системы, остальные
– как возбужд. состояний системы
(выделение основного состояния необходимо
потому, что любая система -> min своей
энергии, а именно такими состояниями
занимается ФХ). Далее εmin
подставляем в 1, 2, …, n ур-ния, находим
соотношение м/у C1,
C2,
и Cn.
Полученные значения (C1,
C2,
…) подставляем в ур-ние нормировки

Находим численное значение C1, C2, и Cn. Найти соотношение м/у C1, C2, и Cn означает, что все Ci можно выразить ч/з C1, C2, и Cn.
12. Метод валентных связей при анализе основного состояния молекулы. Для определения волновых ф-ций не отдельного атома, а системы атомов, объединенных в молекулы, когда эл-ны нах-ся в поле, не обладающим сферич-й симметрией, Ф определяет 2 метода: метод Валентных связей и метод молекулярных орбиталей. Оба метода дают приближения. В одних ситуациях применяется один метод. в других – другой. В методе ВС предполагается, что при объединении атомов в молекулы, атомные орбитали каждого из атомов практически не меняются, за исключением атомных орбиталей нескольких эл-нов, с помощью которых атомы вступают во взаимодействие. Как правило это наружные электроны атомных оболочек.
13. Основные положения при построении электронной конфигурации. Совокупность МО молекулы, занятых эл-нами наз-ся электронной конфигурацией молекулы. Не все орбитали, доступные эл-нам могут быть заняты. Одни будут заняты как правило, другие буду заняты при наличии внешнего излучения. При этом выполн-ся следующие принципы:
1) наименьшей энергии. Каждый новый электрон занимает в молекуле незант-ую орбиталь с min энергией
2) принцип Паули. На одной орбитали могут нах-ся 2 электрона с различными спинами.
14. Критерии выбора атомного базиса при построении электронной конфигурации. Набор атомных орбиталей, с помощью которых рассчит-ся МО должен отвечать опред. требованиям:
1) выбранные атомные орбитали должны обеспечивать хорошее эксперим-е соотв-вие вероятностных хар-к, полученных для молек-х орбиталей, рассчит-е с исп-нием выбранных атомных орбиталей.
2) атомные орбитали, выбранные для построения атомных орбиталей, должны обеспечивать аналит-й расчет всех интегралов, фигурирующих в рассчетх соотношениях.
3) полное число атомных орбиталей, исп-х при расчете атомных орбит, не должно быть слишком большим.
15. Условия успешного комбинирования атомных орбиталей в молекулярную орбиталь. Для успешного комбинирования атомных орбиталей в молекулярную орбиталь желательно чтобы:
1) энергии выбранных АО были сравнимы по величине
2) электр-е облака. Хар-щие плотность вер-ти нах-ния эл-нов вблизи ядра, относящ-ся к сосед-щим атомам, должны max перекрываться
3) атомные орбитали, выбранные для построения МО должны, обладать одинаковой симметрией.
31. Тепловой эффект реакции и закон Гесса. Раздел хим-й ТД, посвящ-й исслед-ю тепл-х эфф-в хим-х реакций, фазовых переходов, процессов растворения вещ-ва, наз-ся термохимией. При хим-х реакц-х происходит перестройка электр-х оболочек, разрыв хим. связей и появление новых, что ведет либо к поглощению энергии из окр. среды, либо к выделению в ок-щую среду. Можно показать, что для большинства процессов термохимии выполняется след-е положение (правило):
1) процессы протекают необратимо при p=const или V=const.
2) при протекании термохим. процессов не совершается никакой другой работы, кроме процессов расширения.
3) T исх-ных продуктов хим-й реакции и конечных продуктов равны.
В этом случае выполняется соотношение, справедливое для реальных газов:


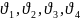 – стехиометрические
коэф-ты
– стехиометрические
коэф-ты
33. Второе следствие закона Гесса. Тепловой эффект реакции и теплота образования вещества. Тепловой эффект ХР равен разности суммы теплот продуктов реакции и суммы теплот образования исх-х вещ-в. Теплоты образования – кол-во тепла, поглощаемая или выделяемая при образовании 1 моля i-го вещ-ва из простых вещ-в, взятых в ТД устойчивом состоянии при T=298K и P = 1 атм.
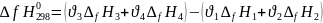
Как и теплоты сгорания, теплоты обр-ния определены и табулированы.
32. Первое следствие закона Гесса. Тепловой эффект реакции и теплота сгорания. Закон Гесса говорит, что в результате протекания хим. реакции при норм. условиях (T=2980K и P=1.012 * 105Па), закон Гесса имеет 2 формы: тепловой эффект реакции = разности теплот сгорания исходных веществ и теплот сгорания продуктов реакции. До высших окислов в среде O2 при P = 20-30Па сжигание происходит в калориметрических бомбах. В этом Q эффект реакции можно определить след. образом:

 – тепловой эффект
реакции;
– тепловой эффект
реакции;
 - теплота сгорания компонента А1
;
- теплота сгорания компонента А1
;
 - стехиометрический коэфф-т исходного
ур-ния и т.д. Значение
- стехиометрический коэфф-т исходного
ур-ния и т.д. Значение
 в настоящее время можно определить с
достаточно высокой точностью. Они
определены и табулированы.
в настоящее время можно определить с
достаточно высокой точностью. Они
определены и табулированы.
48. Третий закон термодинамики и постулат Нернста.

Из этих соотношений => для определения T зависимости необх-мо знать:
1)
Т зависимость

2) знать необх-мо в диапазоне от 0 до P
3) необх-мо знать const интегр-ния 1 ур-ия
Определить
эти соотношения можно из эксп-та при
известной const v
реакции.
Гораздо простым решением явл-ся метод,
разраб-й Нернстом и основанный на

Это справедливо только для крист. в-в.
4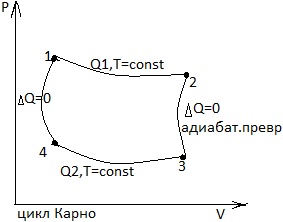 9.
Основные следствия постулата Нернста.
Метод, определения Т зависимости,
разраб-й Нернстом и основанный на
справедлив только для крист. вещ-в. Из
него следует ряд полезных следствий:
9.
Основные следствия постулата Нернста.
Метод, определения Т зависимости,
разраб-й Нернстом и основанный на
справедлив только для крист. вещ-в. Из
него следует ряд полезных следствий:
1) для крист. в-в пределом этого соотн = 0
2)
 => при T->0
тепловой эффект и изменение теплоемкости
от T
не зависят
=> при T->0
тепловой эффект и изменение теплоемкости
от T
не зависят
3) для процессов, сопровождающих взаимод-е крист. в-в это отношение записано не только для Гиббса, но и для энтропии

Необходимо отметить, что это соотношение справедливо только для крист. в-в. Для растворов не выполняется.
4)
для процессов, сопровождающих взаимод-е
крист. в-в,
5)

 где
где

j – истинная хим. постоянная
В целом III закон ТД с учетом соотношением Нернста и приведенных следствий м/б сформ-на след. образом:
Энтропия любого бездефектного индивидуального кристалл. Вещ-ва при 00K=0
S=k*lnΩ
k – постоянная Больцмана
Ω – статистич. вес, т.е. число микросостояний, посредством которых реализ-ся данное макросост. То, что при S при 00K=0, означает, что в индивид. крист. бездефф. в-вах равнов. состоянием м/б реализовано только одним способом.
36.
Характер функции при S,V=const.

 T
при S,V=const-мера
возрастания U,
сопровождающийся ростом S
при V=const.
P при
T
при S,V=const-мера
возрастания U,
сопровождающийся ростом S
при V=const.
P при
 ,V=const-мера
убыли U,
сопровождающаяся
,V=const-мера
убыли U,
сопровождающаяся
 при
S=const.
вывод:
S,V=const
при
S=const.
вывод:
S,V=const


37.
Характер функции при S,P=const.
 dH=dU+pdV+Vdp⇒dH=TdS+Vdp
;
dH=dU+pdV+Vdp⇒dH=TdS+Vdp
;

 вывод:
S,P=const
вывод:
S,P=const


38.
Характер функции при T,V=const.
 A-Энергия
Гельмгольца.
A-Энергия
Гельмгольца.






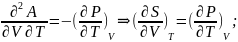
 Вывод:
T,V=const
Вывод:
T,V=const
 ;
;

34.Зависим.
теплового эффекта от Т. Уравнение
Кирхгофа.
Проблема состоит в том, что тепл. эфф.
нужно рассчитывать не только при норм.
Т, но и при повышенной Т. Этой проблемой
занимался Кирхгоф.


 ;
;
 =
=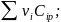
 (1) ; (1)-уравнение Кирхгофа. Теплов. эфф.
может менять свой знак.
(1) ; (1)-уравнение Кирхгофа. Теплов. эфф.
может менять свой знак. ;
1)3
;
1)3 2)2
2)2 3)
3)
Д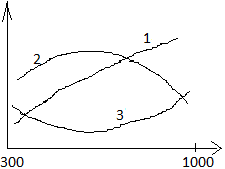 ля
определения
ля
определения
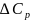 используют экстраполяцию теплоемкости
с помощью 3 членов: А+ВТ+С
используют экстраполяцию теплоемкости
с помощью 3 членов: А+ВТ+С или А+ВС+ С
.
В последнем соотношении вместо табл.
соотн. используют ∆r
или А+ВС+ С
.
В последнем соотношении вместо табл.
соотн. используют ∆r .
Для упрощения расчетов используют
усредн. значение теплоемкостей, заданных
в определенном интервале Т:
.
Для упрощения расчетов используют
усредн. значение теплоемкостей, заданных
в определенном интервале Т:
35.
II
закон ТД. Самопроизвольные и
несамопроизвольные процессы. Энтропия
и ее изменение. II
ЗТД определяет невозможность создания
вечного двигателя 2-го рода: Q→A.
Тепло, переданное рабочему телу,
превращает тепло в работу, частично
должно быть передано холодильнику
1-2-изотерма( );
2-3-адиабата ∆Q=0
расширение;3-4-изотерма (
);
2-3-адиабата ∆Q=0
расширение;3-4-изотерма ( );4-1-адиабата
∆Q=0
сжатие. η=
);4-1-адиабата
∆Q=0
сжатие. η= ; η=
; η= ;
;
 (*). Все эти рассуждения касаются
квазистат. процессов, сопровождается
изменением P
и V,
изменяющихся небольшими порциями,
приближая состояние системы (СС)
к равновесной. Если система выйдет из
равн-я, то (*) не будет выполняться. Для
подынтегр. выражения было предложено
опред-е энтропии. dS=
(*). Все эти рассуждения касаются
квазистат. процессов, сопровождается
изменением P
и V,
изменяющихся небольшими порциями,
приближая состояние системы (СС)
к равновесной. Если система выйдет из
равн-я, то (*) не будет выполняться. Для
подынтегр. выражения было предложено
опред-е энтропии. dS=




 справедливо, когда система соверш.
равна работе увелич. U
системы, т.е
справедливо, когда система соверш.
равна работе увелич. U
системы, т.е
 Энтропия
явл-ся экстенсивной ТД функцией. Если
система состоит из
Энтропия
явл-ся экстенсивной ТД функцией. Если
система состоит из
 атомов, то
атомов, то


 .
Для квазистат. процессов в изолирован.системах
.
Для квазистат. процессов в изолирован.системах
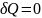 при U,V=const.
В этом случае
при U,V=const.
В этом случае
 при U,V=const,
для нестац. процессов
при U,V=const,
для нестац. процессов
 .В
то же время в отдельн. частях изолированной
системы S
может ↑, а в других ↓. Но в целом наличие
участков ↑ и ↓ энтропии означает, что
система в нестационарн. состоянии S
.В
то же время в отдельн. частях изолированной
системы S
может ↑, а в других ↓. Но в целом наличие
участков ↑ и ↓ энтропии означает, что
система в нестационарн. состоянии S или S
или S ,в
итоге суммарная энтропия растет. а)
,в
итоге суммарная энтропия растет. а)
39. Уравнение Гиббса-Гельмгольца.
ТД
соотношения, устанавливающие связь
между внутренней энергией U и энергией
Гельмгольца (свободной энергией F) или
между энтальпией H и энергией Гиббса
(свободной энтальпией G):
 ,H=G-T
,H=G-T Ур-ие
(1) следует из определения энергии
Гельмгольца F=U-TS и выражения для
энтропии
Ур-ие
(1) следует из определения энергии
Гельмгольца F=U-TS и выражения для
энтропии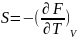 .
Ур-ие (2) -
из определения энергии Гиббса G=H-TS и
выражения для энтропии
S=-
.
Ур-ие (2) -
из определения энергии Гиббса G=H-TS и
выражения для энтропии
S=- .
Ур-ние (1)
позволяет по энергии Гельмгольца F(T,
V)найти внутр. энергию U(T, V)и, следовательно,
теплоёмкость при пост. объёме. Ур-ние
(2) позволяет по энергии Гиббса G(T, P)
найти энтальпию H(T, P) и, следовательно,
теплоёмкость при P=const.
Маx
работа, к-рую может совершить система
в тепловом контакте с окружающей средой
.
Ур-ние (1)
позволяет по энергии Гельмгольца F(T,
V)найти внутр. энергию U(T, V)и, следовательно,
теплоёмкость при пост. объёме. Ур-ние
(2) позволяет по энергии Гиббса G(T, P)
найти энтальпию H(T, P) и, следовательно,
теплоёмкость при P=const.
Маx
работа, к-рую может совершить система
в тепловом контакте с окружающей средой
 удовлетв. ур-ию Гиббса-Гель.
удовлетв. ур-ию Гиббса-Гель. .
Эта max
работа за вычетом работы против сил
давления P(V2-V1)
(максимальная полезная работа)
.
Эта max
работа за вычетом работы против сил
давления P(V2-V1)
(максимальная полезная работа)
 ,удовл.ур.Гиббса-Гель.:
,удовл.ур.Гиббса-Гель.:
40.
Характер функции при Р,Т=const.








 ;
Вывод: Р,Т=const,
const
;
Вывод: Р,Т=const,
const
 ;
;

