
- •1Основные понятия коллоидной химии; классификация, основные особенности, количественные характеристики дисперсных систем.
- •2. Диспергационные методы получения дисперсных систем
- •3. Конденсационные методы получения дисперсных систем
- •5Первый и второй законы Фика, диффузия, движущая сила диффузии, связь коэффициента диффузии с размерами частиц.
- •6. Гипсометрический закон Лапласа, диффузионно-седиментационное равновесие. Кривая седиментации для монодисперсных и полидисперсных систем.
- •7. Строение двойного электрического слоя (фи-потенциал и дзета-потенциал), теория Квинке-Гельмгольца-Перрена, теория Гуи-Чепмена, теория Штерна, строение мицеллы.
- •9 Закон Бугера-Ламберта-Бера, оптические свойства коллоидных растворов, оптические методы анализа дисперсности.
- •10. Работа когезии. Связь поверхностной энергии с взаимодействиями между молекулами (атомами, ионами), правило Трутона, уравнение Дюпре. .
- •12. Закон Лапласа: общая форма, частные случаи, капиллярное поднятие жидкости, уравнение Жюрена.
- •13 Закон Томсона (Кельвина), зависимость давления насыщенного пара от кривизны поверхности жидкости, капиллярная конденсация.
- •14. Закон Гиббса-Оствальда-Фрейндлиха, влияние дисперсности на растворимость твердых частиц, процессы изотермической перегонки в дисперсных системах.
- •15. Лиофильные коллоидные системы, методы получения. Самопроизвольное диспергирование макрофаз: критерий самопроизвольного диспергирования (по Ребиндеру-Щукину, примеры).
- •17 Солюбилизация
- •18. Термодинамика мицеллообразования, диаграмма фазовых состояний, точка Крафта, жидкокристаллические системы.
- •19. Образование и строение обратных мицелл
- •Классификация
- •Свойства
- •21 Термопреципитация
- •22. Фотофорез
- •23. Термофорез.
- •25 Быстрая и медленная коагуляция.
- •26. Концентрационная и нейтрализационная коагуляция
- •27. Изотермическая перегонка.
- •29 Эффект Марангони
- •30. Тиксотропия.
- •31. Флотация.
- •33. Правило Банкрофта
- •34. Правило Дюкло-Траубе
- •35. Правило Шульца-Гарди.
- •37. Теория длфо.
- •38. Слои Шиллера
- •39. Тактоиды
- •41. Кольца и слои Лизеганга
- •42. Пептизация.
- •43. Флокуляция
- •45. Адагуляция.
- •46. Аддитивность коагуляции.
- •47. Антагонизм коагуляции
- •49. Коагуляционные структуры
- •50. Структуры с фазовыми контактами
- •51. Синерезис.
- •53. Кристаллизационные структуры
- •54. Когезия.
- •55. Адгезия
- •57. Смачивание.
- •58. Капиллярное давление
- •59. Закон Ньютона (трение)
- •61. Застудневание
- •62.Ползучесть
- •63. Вязкость коллоидных растворов. Зависимость вязкости раствора от концентрации взвешенных частиц (уравнение Эйнштейна)
- •Аномалии вязкости
- •65. Как образуется снежинка
- •66. Хемосорбция и каталитическая сорбция, сходства и отличия, привести примеры
- •67. Почему “химические дожди” выпадают недалеко от источника загрязнения?
- •69. Абсорция.
- •70. Хемосорбция.
- •71. Каталитическая сорбция
- •73. В чём сходство и различие газовой и жидкой дисперсионных сред?
- •74. Почему туман в вечернее время распространяется в приземном слое, не оседая на поверхность?
- •75. Почему снег выпадает иногда в виде “крупы”?
- •77. Адсорбция и адагуляция, сходства и отличия, привести примеры
- •Количественные характеристики дисперсных систем
- •Классификация дисперсных систем по размеру частиц дисперсной фазы
- •Классификация дисперсных систем по фракционному составу частиц дисперсной фазы
- •Классификация дисперсных систем по концентрации частиц
- •Классификация дисперсных систем по взаимодействию дисперсной фазы с дисперсной средой
- •Классификация дисперсных систем по характеру распределения фаз
- •Классификация дисперсных систем по агрегатному состоянию
- •Классификация дисперсных частиц по размерам
- •Классификация дисперсных частиц по форме
- •Классификация дисперсных частиц по строению
- •Классификация дисперсных частиц по химическому составу
- •Размерные эффекты, наблюдаемые в дисперсных системах
- •Тд свойства дисперсных частиц
- •Механические свойства дисперсных частиц
- •Магнитные свойства дисперсных частиц
- •Каталитические свойства дисперсных частиц
- •Энергетическое и силовое определение поверхностного натяжения
- •Факторы, влияющие на поверхностное натяжение
- •Дисперсная и полярная составляющие поверхностного натяжения
- •Метод избыточных величин Гиббса
- •Капиллярное давление
- •Закон Лапласа
- •Смачивание
- •Закон Юнга
- •Несмачивание, полное смачивание, гидрофильность, гидрофобность.
- •Правило Антонова
- •Эффект Марангони
- •Зависимость смачивания от свойств твёрдой поверхности
- •Смачивание нанокаплями
- •Адгезия, когезия, уравнение Дюпре
- •Закон Кельвина
- •Закон Гиббса-Оствальда
- •Изотермическая перегонка
- •Капиллярная конденсация
- •Закон Жюрена
- •Закон Пуазейля
- •Измерение поверхностного натяжения методом капиллярного подъёма
- •Измерение поверхностного натяжения методом сидящей капли
- •Измерение поверхностного натяжения методом максимального давления
- •Измерение поверхностного натяжения методом пластинки Вильгельми
- •Измерение поверхностного натяжения методом вращающейся капли
- •Измерение поверхностной энергии твёрдых тел
- •Адсорбция пав из растворов на поверхности твёрдых тел
- •Химическое модифицирование твёрдых тел
- •Классификация пав по растворимости
- •Классификация пав по диссоциации в воде
- •Классификация пав по способу образования мицелл и происхождению
- •Классификация пав по фх воздействию на поверхность раздела между фазами
- •Гидрофильно-липофильный баланс
- •Критический параметр упаковки
- •Механизмы образования электрического заряда на поверхности твёрдых тел и жидкостей в дисперсных системах
- •Строение дэс
- •Влияние электролитов на дэс
- •Электрофорез
- •Электроосмос
- •Потенциал течения
- •Потенциал оседания
- •Электрокапиллярные явления (электрокапиллярная кривая, закон Липпмана)
5Первый и второй законы Фика, диффузия, движущая сила диффузии, связь коэффициента диффузии с размерами частиц.
Диффузия молекул, атомов, ионов, дисперсных частиц – один из основных процессов, происходящих в газах, жидкостях и твердых телах.
Диффузия – самопроизвольный процесс выравнивания концентрации какого-либо вещества в газе, жидкости или твердом теле. Диффундирующее вещество может находиться в виде отдельных атомов, молекул и ионов, дисперсных частиц. Диффузия дисперсных частиц происходит под влиянием броуновского движения и ведет к увеличению энтропии системы.
Основной закон диффузии (з-н Фика) определяет кол-во вещества dm, которое переносится через площадь Ω (площадь поперечного сечения диффузионного потока) за время dt под действием градиента концентрации gradC = –dC/dx (х – направление (ось координат), в котором происходит диффузия): dm = –D(dC/dx)Ωdt .
Для расчета диффузии дисперсных частиц в дисперсионной среде (жидкости) следует пользоваться концентрацией частиц (ν, м-3). Тогда закон Фика примет вид:
dm = –D(dν/dx)*Ωdt.
Количество вещества id = dm/(Ωdt), которое переносится диффузией в единицу времени через единицу площади, называют удельным диффузионным потоком. Тогда:
id = –D(dν/dx). Это уравнение дает макроскопическое (феноменологическое) определение коэффициента диффузии (D) дисперсных частиц: коэффициент диффузии равен массе дисперсной фазы вещества, которое продиффундировало через единицу площади в единицу времени при единичном градиенте концентрации dν/dx = 1 м-4.
Физический смысл коэффициента диффузии дисперсных частиц раскрывает уравнение Эйнштейна: D = kBT/(6πηr), где kB - постоянная Больмана (Дж/К), Т – температура (К), η – вязкость дисперсионной среды (Па*с), r – радиус дисперсной частицы. Важнейшее следствие – коэффициент диффузии обратно пропорционален радиусы частицы r. Поэтому диффузия протекает довольно интенсивно только в ультрадисперсных и высокодисперсных системах. Коэфф. дифф. дисперсных частиц размером 1-100 нм в воде при комнатной температуре изменяется примерно от 4*10-14 до 4*10-10 м2/с.
Одно из наиболее важных следствий диффузии – в высокодисперсных системах устанавливается динамическое равновесие между оседанием (седиментацией) частиц и их диффузией в противоположном направлении. Это равновесие обеспечивает длительную седиментационную устойчивость высокодисперсных систем (напр., коллоидных растворов) в поле силы тяжести.
Второй закон Фика учитывает то, что поток атомов в процессе диффузии может меняться, т. е. принимает во внимание нестационарность потока. При этом скорость накопления диффундирующего вещества в данном объеме является разностью между входящим и выходящим потоками за единичное время. Для двух параллельных плоскостей, площадь каждой из которых равна единице, а расстояние между ними dx, поток через первую плоскость будет соответствовать выражению id = –D(dν/dx), а через вторую −
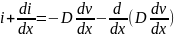
Разность этих двух потоков составляет
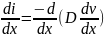
При условии не зависящего от концентрации коэффициента диффузии получим второй закон Фика для одномерной диффузии в дифференциальной форме:

Концентрация ν здесь зависит от времени t и от глубины диффузии x.
Примеры:
1. Распространение запахов,
2. смешивание разнородных жидкостей,
3. растворение твердых тел в жидкостях,
4. сварка металлов при их расплавлении или под давлением.
6.Проникновение растворённого вещества в клетку может быть выражено законом Фика, в котором значение коэффициента Диффузии заменено коэффициентом проницаемости мембраны, а градиент концентрации — разностью концентраций вещества по обе стороны мембраны.
7. Диффузионное проникновение в клетку газов и воды (Осмос) также описывается законом Фика; при этом значения разности концентраций заменяются значениями разности давлений газов и осмотических давлений внутри и вне клетки.
Диффузия кислорода из лёгких в кровь и из крови в ткани, всасывание продуктов пищеварения из кишечника, поглощение элементов минерального питания клетками корневых волосков, диффузия ионов при генерировании биоэлектрических импульсов нервными и мышечными клетками).
8. Различная скорость диффузии ионов через клеточные мембраны — один из физических факторов, влияющих на избирательное накопление элементов в клетках организма.
