
- •1Основные понятия коллоидной химии; классификация, основные особенности, количественные характеристики дисперсных систем.
- •2. Диспергационные методы получения дисперсных систем
- •3. Конденсационные методы получения дисперсных систем
- •5Первый и второй законы Фика, диффузия, движущая сила диффузии, связь коэффициента диффузии с размерами частиц.
- •6. Гипсометрический закон Лапласа, диффузионно-седиментационное равновесие. Кривая седиментации для монодисперсных и полидисперсных систем.
- •7. Строение двойного электрического слоя (фи-потенциал и дзета-потенциал), теория Квинке-Гельмгольца-Перрена, теория Гуи-Чепмена, теория Штерна, строение мицеллы.
- •9 Закон Бугера-Ламберта-Бера, оптические свойства коллоидных растворов, оптические методы анализа дисперсности.
- •10. Работа когезии. Связь поверхностной энергии с взаимодействиями между молекулами (атомами, ионами), правило Трутона, уравнение Дюпре. .
- •12. Закон Лапласа: общая форма, частные случаи, капиллярное поднятие жидкости, уравнение Жюрена.
- •13 Закон Томсона (Кельвина), зависимость давления насыщенного пара от кривизны поверхности жидкости, капиллярная конденсация.
- •14. Закон Гиббса-Оствальда-Фрейндлиха, влияние дисперсности на растворимость твердых частиц, процессы изотермической перегонки в дисперсных системах.
- •15. Лиофильные коллоидные системы, методы получения. Самопроизвольное диспергирование макрофаз: критерий самопроизвольного диспергирования (по Ребиндеру-Щукину, примеры).
- •17 Солюбилизация
- •18. Термодинамика мицеллообразования, диаграмма фазовых состояний, точка Крафта, жидкокристаллические системы.
- •19. Образование и строение обратных мицелл
- •Классификация
- •Свойства
- •21 Термопреципитация
- •22. Фотофорез
- •23. Термофорез.
- •25 Быстрая и медленная коагуляция.
- •26. Концентрационная и нейтрализационная коагуляция
- •27. Изотермическая перегонка.
- •29 Эффект Марангони
- •30. Тиксотропия.
- •31. Флотация.
- •33. Правило Банкрофта
- •34. Правило Дюкло-Траубе
- •35. Правило Шульца-Гарди.
- •37. Теория длфо.
- •38. Слои Шиллера
- •39. Тактоиды
- •41. Кольца и слои Лизеганга
- •42. Пептизация.
- •43. Флокуляция
- •45. Адагуляция.
- •46. Аддитивность коагуляции.
- •47. Антагонизм коагуляции
- •49. Коагуляционные структуры
- •50. Структуры с фазовыми контактами
- •51. Синерезис.
- •53. Кристаллизационные структуры
- •54. Когезия.
- •55. Адгезия
- •57. Смачивание.
- •58. Капиллярное давление
- •59. Закон Ньютона (трение)
- •61. Застудневание
- •62.Ползучесть
- •63. Вязкость коллоидных растворов. Зависимость вязкости раствора от концентрации взвешенных частиц (уравнение Эйнштейна)
- •Аномалии вязкости
- •65. Как образуется снежинка
- •66. Хемосорбция и каталитическая сорбция, сходства и отличия, привести примеры
- •67. Почему “химические дожди” выпадают недалеко от источника загрязнения?
- •69. Абсорция.
- •70. Хемосорбция.
- •71. Каталитическая сорбция
- •73. В чём сходство и различие газовой и жидкой дисперсионных сред?
- •74. Почему туман в вечернее время распространяется в приземном слое, не оседая на поверхность?
- •75. Почему снег выпадает иногда в виде “крупы”?
- •77. Адсорбция и адагуляция, сходства и отличия, привести примеры
- •Количественные характеристики дисперсных систем
- •Классификация дисперсных систем по размеру частиц дисперсной фазы
- •Классификация дисперсных систем по фракционному составу частиц дисперсной фазы
- •Классификация дисперсных систем по концентрации частиц
- •Классификация дисперсных систем по взаимодействию дисперсной фазы с дисперсной средой
- •Классификация дисперсных систем по характеру распределения фаз
- •Классификация дисперсных систем по агрегатному состоянию
- •Классификация дисперсных частиц по размерам
- •Классификация дисперсных частиц по форме
- •Классификация дисперсных частиц по строению
- •Классификация дисперсных частиц по химическому составу
- •Размерные эффекты, наблюдаемые в дисперсных системах
- •Тд свойства дисперсных частиц
- •Механические свойства дисперсных частиц
- •Магнитные свойства дисперсных частиц
- •Каталитические свойства дисперсных частиц
- •Энергетическое и силовое определение поверхностного натяжения
- •Факторы, влияющие на поверхностное натяжение
- •Дисперсная и полярная составляющие поверхностного натяжения
- •Метод избыточных величин Гиббса
- •Капиллярное давление
- •Закон Лапласа
- •Смачивание
- •Закон Юнга
- •Несмачивание, полное смачивание, гидрофильность, гидрофобность.
- •Правило Антонова
- •Эффект Марангони
- •Зависимость смачивания от свойств твёрдой поверхности
- •Смачивание нанокаплями
- •Адгезия, когезия, уравнение Дюпре
- •Закон Кельвина
- •Закон Гиббса-Оствальда
- •Изотермическая перегонка
- •Капиллярная конденсация
- •Закон Жюрена
- •Закон Пуазейля
- •Измерение поверхностного натяжения методом капиллярного подъёма
- •Измерение поверхностного натяжения методом сидящей капли
- •Измерение поверхностного натяжения методом максимального давления
- •Измерение поверхностного натяжения методом пластинки Вильгельми
- •Измерение поверхностного натяжения методом вращающейся капли
- •Измерение поверхностной энергии твёрдых тел
- •Адсорбция пав из растворов на поверхности твёрдых тел
- •Химическое модифицирование твёрдых тел
- •Классификация пав по растворимости
- •Классификация пав по диссоциации в воде
- •Классификация пав по способу образования мицелл и происхождению
- •Классификация пав по фх воздействию на поверхность раздела между фазами
- •Гидрофильно-липофильный баланс
- •Критический параметр упаковки
- •Механизмы образования электрического заряда на поверхности твёрдых тел и жидкостей в дисперсных системах
- •Строение дэс
- •Влияние электролитов на дэс
- •Электрофорез
- •Электроосмос
- •Потенциал течения
- •Потенциал оседания
- •Электрокапиллярные явления (электрокапиллярная кривая, закон Липпмана)
25 Быстрая и медленная коагуляция.
Коагуляция
Коагуляция (от лат.Coagulatio — свёртывание, сгущение), самопроизвольный процесс слипания частиц коллоидной системы при их столкновениях в процессе теплового (броуновского) движения, перемешивания или направленного перемещения во внешнем силовом поле. В результате Коагуляции образуются агрегаты — более крупные (вторичные) частицы, состоящие из скопления более мелких (первичных). Агрегаты состоят из десятков и сотен исходных дисперсных частиц, разделенных тонкими (наноразмерными) пленками жидкой дисперсионной среды.
Различают быструю и медленную Коагуляцию. При быстрой Коагуляции почти каждое соударение частиц эффективно, т. е. приводит к их соединению. Аналогия с реакцией второго порядка позволяет описать кинетику коагуляции: – dν/dt=Kν2, где К – константа скорости коагуляции, м3/с; для перикинетической коагуляции К=4πDl (D – коэффициент диффузии, l – расстояние между центрами дисперсных частиц).
Теория быстрой коагуляции позволяет оценить критическое расстояние l, при котором становится возможным слипание двух дисперсных частиц. Самый простой случай – обе частицы представляют собой сферы одинакового радиуса r.

где kB - постоянная Больцмана, Т – температура, η – вязкость дисперсионной среды, ν0 – исходная концентрация частиц, t0 – время половинной коагуляции. Расчеты на основе экспериментальных данных показывают, что l/r≈2,0-2,5. Теория быстрой коагуляции для более сложных систем учитывает и другие параметры, например, форму частиц. Для анизометричных частиц (например, «палочки») скорость коагуляции в десятки раз больше, чем для сферических частиц равного объема. Причина: для вытянутых частиц повышается частота столкновений при броуновском движении.
При медленной Коагуляции к образованию коагуляционных агрегатов приводят не все соударения, а только некоторая доля ε от общего числа соударений. ε называют эффективностью слипания. Причина неэффективности некоторой части соударений – процесс слипания связан с преодолением определенного энергетического барьера (U).
Коэффициент замедления (W) показывает, во сколько раз скорость медленной коагуляции vs меньше, чем скорость быстрой коагуляции vq: W= vs/vq. Коэффициент замедления определяют так:
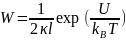
где κ(каппа)=1/δ (δ – приведенная толщина диффузного слоя противоионов в двойном электрическом слое), l – расстояние между центрами сферических дисперсных частиц. Данное уравнение показывает, что режим медленной коагуляции наступает в двух случаях: при большой высоте энергетического барьера U и при увеличении толщины диффузного слоя δ.
При значительном потенциальном барьере, намного превышающем среднюю кинетическую энергию столкновения частиц, скорость коагуляции лиофобных дисперсных систем стремится к нулю, они становятся агрегативно устойчивыми.
Примеры использования явления.
Очистка природных и сточных вод от высокодисперсных механических примесей, то есть в загрязненную воду добавляют новое вещество и его взаимодействие с водой вызывает выпадения осадка.
Борьба с загрязнением воздушного пространства аэрозолями,
выделение каучука из латекса,
получение сливочного масла и др. пищевых продуктов - характерные примеры использования коагуляции в практических целях.
