
- •Неорганическая химия
- •1. Важнейшие классы неорганических соединений: оксиды, гидроксиды, кислоты, соли.
- •2. Закон сохранения материи.
- •3. Основные типы комплексных соединений (к.С.). Поведение к.С. В водных растворах. Константа нестойкости.
- •4. Номенклатура комплексных соединений. Координационное число.
- •5. Амфотерные гидроксиды
- •6. Комплексные соединения. Комплексообразователь, лиганды.
- •7. Гидролиз солей, образованных слабым основанием и сильным кислотой. Степень и константа гидролиза.
- •8. Растворение твердых веществ. Из каких слагаемых состоит теплота растворения твердого вещества в жидкости?
- •9. Типы окислительно-восстановительных реакций.
- •10. Закон постоянства состава. Дальтониды, бертоллиды.
- •11. Кристаллизация разбавленных и концентрированных растворов. Кристаллогидраты.
- •12. Ионообменные реакции. Произведение растворимости.
- •13. Закон кратных отношений.
- •14. Электрохимическая диссоциация воды. Ионное произведение воды. Водородный показатель.
- •15. Отношение металлов к соляной и серной кислотам (разбавленной и концентрированной).
- •17. Закон эквивалентов. Определение эквивалентов простых и сложных веществ.
- •18. Способы выражения концентрации раствора: молярная, нормальная, титр.
- •19. Квантово-механическая теория строения атома. Уравнение Луи де Бройля. Принцип неопределенности Гейзенберга.
- •20. Окислительно-восстановительные свойства перманганата калия.
- •22. Гидролиз солей, образованных слабым основанием и слабой кислотой.
- •23. Слабые электролиты. Степень диссоциации. Константа диссоциации.
- •24. Отношение металлов к азотной кислоте.
- •26. Электронная структура атомов. S-, p-, d-, f- электронные семейства атомов.
- •27. Растворимость. Растворение газов, жидкостей и твердых тел. Физико-химическая теория растворов.
- •28. Заполнение атомных орбиталей в атомах с возрастанием порядкового номера элемента (правило Клечковского).
- •29. Давление пара над жидкостью. Первый закон Рауля.
- •30. Ядерная модель строения атома. Атомные ядра, их состав. Изотопы, изобары.
- •31. Растворы сильных электролитов.
- •32. Квантовые числа: главное, орбитальное, магнитное, спиновое.
- •33. Общее понятие о растворах. Способы выражения концентрации раствора: моляльность, массовая доя, титр.
- •34. Гидролиз солей, образованных сильным основанием и слабой кислотой.
- •35. Осмос. Осмотическое давление.
- •36. Сильные электролиты.
- •37. Квантовая теория света Планка. Теория строения атома Бора.
- •38. Вода. Физические и химические свойства воды.
- •39. Закон эквивалентов. Химический эквивалент. Определение эквивалента кислоты, основания и соли.
- •40. Второй закон Рауля.
38. Вода. Физические и химические свойства воды.
Вода – оксид водорода. Природная вода не бывает совершенно чистой. Наиболее чистой является дождевая вода, но и она содержит незначительные количества различных примесей, которые захватывает из воздуха.
Вода, содержащая значительное количество солей кальция и магния, называется жесткой в отличие от мягкой воды, например дождевой. Жесткая вода дает мало пены с мылом, а на стенках котлов образует накипь.
Чтобы освободить природную воду от взвешенных в ней частиц, ее фильтруют сквозь слой пористого вещества, например, угля, обожженной глины и т.п. При фильтровании больших количеств воды пользуются фильтрами из песка и гравия. Фильтры задерживают также большую часть бактерий. Кроме того, для обеззараживания питьевой воды ее хлорируют; для полной стерилизации воды требуется не более 0.7 г хлора на 1 т воды.
Фильтрованием можно удалить из воды только нерастворимые примеси. Растворенные вещества удаляют из нее путем перегонки (дистилляции) или ионного обмена. Состав воды (по массе): 11.19% водорода и 88.81% кислорода.
ФИЗИЧЕСКИЕ СВОЙСТВА ВОДЫ:
Чистая вода прозрачна и бесцветна. Она не имеет ни запаха, ни вкуса. Многие физические свойства и характер их изменения у чистой воды аномальны. Это относится к температурам плавления и кипения, энтальпиям и энтропиям этих процессов. Аномален и температурный ход изменения плотности воды.
Вода имеет максимальную плотность при +4оC. Выше и ниже этой температуры плотность воды уменьшается. При отвердевании происходит дальнейшее резкое уменьшение плотности, поэтому объем льда на 10% больше равного по массе объема воды при той же температуре. Все указанные аномалии объясняются структурными изменениями воды, связанными с возникновением и разрушением межмолекулярных водородных связей при изменении температуры и фазовых переходах.
Аномалия плотности воды имеет огромное значение для жизни живых существ, населяющих замерзающие водоемы. Поверхностные слои воды при температуре ниже +4°С не опускаются на дно, поскольку при охлаждении они становятся более легкими. Поэтому верхние слои воды могут затвердевать, в то время как в глубинах водоемов, сохраняется температура +4°С. В этих условиях жизнь продолжается. Если бы плотность льда была больше плотности воды (как у большинства других веществ), все водоемы на Земле постепенно промерзли бы до дна и живые организмы в них погибли бы. Кроме того, получаемой от Солнца теплоты (включая теплое время года) недостаточно для оттаивания всей массы воды, если бы она превратилась в лед.
Вода замерзает при 0°С и кипит при 100°С при давлении 101 325 Па.
Большое значение в жизни природы имеет и тот факт, что вода обладает аномально высокой теплоемкостью [4.18 Дж/(г∙К)]. Поэтому в ночное время, а также при переходе от лета к зиме вода остывает медленно, а днем или переходе от зимы к лету также медленно нагревается, являясь, таким образом, регулятором температуры на Земле. С повышением температуры водородные связи разрываются, и полный разрыв их наступает при переходе воды в пар.
М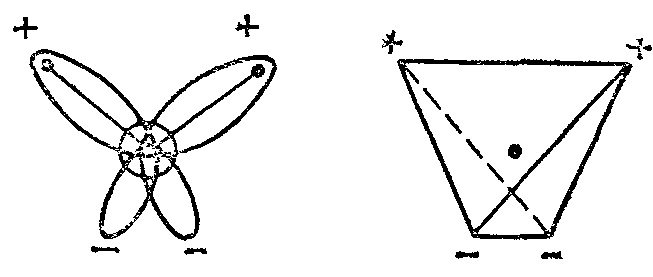 олекула
воды имеет угловую форму: атомы водорода
по отношению к кислороду образуют угол,
равный 104.5°. Поэтому молекула воды –
диполь: та часть молекулы, где находится
водород, заряжена положительно, а часть,
где находится кислород – отрицательно.
Благодаря полярности молекул воды
электролиты в ней диссоциируют на ионы.
олекула
воды имеет угловую форму: атомы водорода
по отношению к кислороду образуют угол,
равный 104.5°. Поэтому молекула воды –
диполь: та часть молекулы, где находится
водород, заряжена положительно, а часть,
где находится кислород – отрицательно.
Благодаря полярности молекул воды
электролиты в ней диссоциируют на ионы.
Молекулярная масса парообразной воды равна 18 и отвечает ее простейшей формуле. Однако, молекулярная масса жидкой воды оказывается более высокой. Это свидетельствует о том, что в жидкой воде происходит ассоциация молекул, т.е. соединение их в более сложные агрегаты.
В твердой воде (лед) атом кислорода каждой
молекулы участвует в образовании двух
водородных связей с соседними молекулами
воды. Образование водородных связей
приводит к такому расположению молекул
воды, при котором они соприкасаются
друг с другом своими разноименными
полюсами. Молекулы образуют слои, причем
каждая из них связана с тремя молекулами,
принадлежащими к тому же слою, и с одной
– из соседнего слоя.
твердой воде (лед) атом кислорода каждой
молекулы участвует в образовании двух
водородных связей с соседними молекулами
воды. Образование водородных связей
приводит к такому расположению молекул
воды, при котором они соприкасаются
друг с другом своими разноименными
полюсами. Молекулы образуют слои, причем
каждая из них связана с тремя молекулами,
принадлежащими к тому же слою, и с одной
– из соседнего слоя.
ХИМИЧЕСКИЕ СВОЙСТВА ВОДЫ:
Химические свойства воды во многом определяются ее химическим строением, в частности наличием двух неподеленных электронных пар и значительной полярностью молекул. Вода является весьма реакционноспособным веществом. Она может быть окислителем, функционировать в качестве лиганда в комплексных соединениях.
В воде растворяет ся большинство неорганических кислот, оснований и солей. Из ковалентных водородных соединений в воде хорошо растворяются те, которые подвергаются электролитической ионизации с образованием гидратированных ионов (например, НСl) и способны давать межмолекулярные водородные связи с молекулами воды (например, NH3). С другой стороны, практически все вещества, с которыми мы имеем дело, содержат следы воды. Например, температуры кипения ртути, брома, этилового спирта и т.п. после тщательного высушивания повышаются на десятки градусов.
Вода является катализатором целого ряда химических процессов. В ее отсутствие многие вещества почти не взаимодействуют химически. Например, после длительного высушивания гремучая смесь не взрывается даже при высокой температуре, угарный газ не горит в кислороде, хлор не действует на металлы, фторид водорода не разъедает стекло, натрий и фосфор не окисляются на воздухе и не реагируют с хлором. Следы воды катализируют также некоторые реакции разложения. В то же время вода иногда затрудняет протекание реакций, а также может выступать как каталитический яд. Так, при синтезе аммиака из элементов на железном катализаторе присутствие в реакционной смеси следов водяного пара отравляет катализатор.
Вода, молекулы которой включают тяжелые изотопы водорода и кислорода, обобщенно называется тяжелой водой. Однако под тяжелой водой прежде всего имеют в виду дейтериевую воду D2O16. В природной воде 99,73% приходится на
