
- •Неорганическая химия
- •1. Важнейшие классы неорганических соединений: оксиды, гидроксиды, кислоты, соли.
- •2. Закон сохранения материи.
- •3. Основные типы комплексных соединений (к.С.). Поведение к.С. В водных растворах. Константа нестойкости.
- •4. Номенклатура комплексных соединений. Координационное число.
- •5. Амфотерные гидроксиды
- •6. Комплексные соединения. Комплексообразователь, лиганды.
- •7. Гидролиз солей, образованных слабым основанием и сильным кислотой. Степень и константа гидролиза.
- •8. Растворение твердых веществ. Из каких слагаемых состоит теплота растворения твердого вещества в жидкости?
- •9. Типы окислительно-восстановительных реакций.
- •10. Закон постоянства состава. Дальтониды, бертоллиды.
- •11. Кристаллизация разбавленных и концентрированных растворов. Кристаллогидраты.
- •12. Ионообменные реакции. Произведение растворимости.
- •13. Закон кратных отношений.
- •14. Электрохимическая диссоциация воды. Ионное произведение воды. Водородный показатель.
- •15. Отношение металлов к соляной и серной кислотам (разбавленной и концентрированной).
- •17. Закон эквивалентов. Определение эквивалентов простых и сложных веществ.
- •18. Способы выражения концентрации раствора: молярная, нормальная, титр.
- •19. Квантово-механическая теория строения атома. Уравнение Луи де Бройля. Принцип неопределенности Гейзенберга.
- •20. Окислительно-восстановительные свойства перманганата калия.
- •22. Гидролиз солей, образованных слабым основанием и слабой кислотой.
- •23. Слабые электролиты. Степень диссоциации. Константа диссоциации.
- •24. Отношение металлов к азотной кислоте.
- •26. Электронная структура атомов. S-, p-, d-, f- электронные семейства атомов.
- •27. Растворимость. Растворение газов, жидкостей и твердых тел. Физико-химическая теория растворов.
- •28. Заполнение атомных орбиталей в атомах с возрастанием порядкового номера элемента (правило Клечковского).
- •29. Давление пара над жидкостью. Первый закон Рауля.
- •30. Ядерная модель строения атома. Атомные ядра, их состав. Изотопы, изобары.
- •31. Растворы сильных электролитов.
- •32. Квантовые числа: главное, орбитальное, магнитное, спиновое.
- •33. Общее понятие о растворах. Способы выражения концентрации раствора: моляльность, массовая доя, титр.
- •34. Гидролиз солей, образованных сильным основанием и слабой кислотой.
- •35. Осмос. Осмотическое давление.
- •36. Сильные электролиты.
- •37. Квантовая теория света Планка. Теория строения атома Бора.
- •38. Вода. Физические и химические свойства воды.
- •39. Закон эквивалентов. Химический эквивалент. Определение эквивалента кислоты, основания и соли.
- •40. Второй закон Рауля.
31. Растворы сильных электролитов.
Полярные молекулы и кристаллы ионного типа образуют раствор, проводящий ток.
Электропроводность растворов электролитов создается направленным перемещением ионов электрически заряженных частиц имеющих положительный катион или отрицательный анион заряд.
Любой раствор электронейтрален.
Вещества, проводящие электрический ток расплавленном или растворенном состоянии называются электролитами. Процесс распада вещества на ионы называется электролитической диссоциацией.
Теорию электролитической диссоциации была выдвинута Каблуковым и Кистяковским.
За счет диполь-дипольного ориентационного и диполь-ионного взаимодействия молекулы растворителя притягиваются к полярным молекулам растворенного вещества или кристалл-ионного типа и происходит поляризация-ионизация, а затем диссоциация веществ. Перед диссоциацией обязательно наблюдается сольватация (гидратация частиц).
В том случае если энергия кристаллической решетки больше энергии гидратации, то не происходит растворение веществ.
В водных растворах сильные электролиты обычно полностью диссоциированы. Поэтому число ионов в них больше, чем в растворах слабых электролитах той же концентрации. И если в растворах слабых электролитов концентрация ионов мала, расстояния между ними велики и взаимодействие ионов друг с другом незначительно, то в не очень разбавленных растворах сильных электролитов среднее расстояние между ионами вследствие значительной концентрации сравнимо мало. При этом силы межионного притяжения и отталкивания довольно велики. В таких растворах ионы не вполне свободны, движение их стеснено взаимным притяжением друг к другу. Благодаря этому притяжению каждый ион как бы окружен шарообразным роем противоположно заряженных ионов, получившим название «ионной атмосферы».
На процесс электролитической диссоциации влияет диэлектрическая проницаемость растворителя (ξ). Чем больше ξ, тем в большей степени ослабляются связи между ионами электролита.
![]()
32. Квантовые числа: главное, орбитальное, магнитное, спиновое.
Главное квантовое число n.
Энергия электрона величина квантовая. Возможные энергетические состояния электрона определяются величиной главного квантового числа n, которое может принимать положительные целочисленные значения: 1, 2, 3 … и т.д. Наименьшей энергией электрон обладает при n = 1; с увеличением n энергия электрона возрастает. Поэтому состояние электрона, характеризующееся определенным значением главного квантового числа, принято называть энергетическим уровнем электрона в атоме: при n = 1 электрон находится на первом энергетическом уровне, при n = 2 – на втором и т.д.
Главное квантовое число определяет и размеры электронного облака. Для того чтобы увеличить размеры электронного облака, нужно часть его удалить на большее расстояние от ядра. Этому препятствуют силы электростатического притяжения электрона к ядру, преодоление которых требует затраты энергия. Поэтому большим размером электронного облака соответствует более высокая энергия электрона в атоме и, следовательно, большее значение главного квантового числа n. Электроны же, характеризующиеся одним и тем же значением главного квантового числа, образуют в атоме электронные облака приблизительно одинаковых размеров; поэтому можно говорить о существовании в атоме электронных слоев или электронных оболочек, отвечающих определенным значениям главного квантового числа.
Для энергетических уровней электрона в атоме (т.е. для электронных слоев, или оболочек), соответствующих различным значениям n, приняты следующие буквенные значения:
-
Главное квантовое число n
1
2
3
4
5
6
7
Обозначение энергетического уровня
K
L
M
N
O
P
Q
Орбитальное квантовое число l.
Форма электронных облаков определяется орбитальным квантовым числом l, которое может принимать целочисленные значения от 0 до (n−1), где n – главное квантовое число. Различным значениям n отвечает разное число возможных значений l. Так, при n = 1 возможно только одно значение орбитального квантового числа – ноль (l = 0), при n = 2 l может быть равным 0 или 1, при n = 3 возможны значения l, равные 0, 1 и 2, данному значению главного квантового числа n соответствуют n различных возможных значений орбитального квантового числа.
Энергия электрона в атоме зависит от главного квантового числа. В атоме водорода энергия электрона полностью определяется значением n. Однако, в многоэлектронных атомах энергия электрона зависит и от значения орбитального квантового числа. Поэтому состояния электрона, характеризующиеся различными значениями l, принято называть энергетическими подуровнями электрона в атоме. Этим подуровням присвоены следующие буквенные значения:
-
Орбитальное главное число
1
2
3
4
Обозначение энергетического подуровня
s
p
d
f
В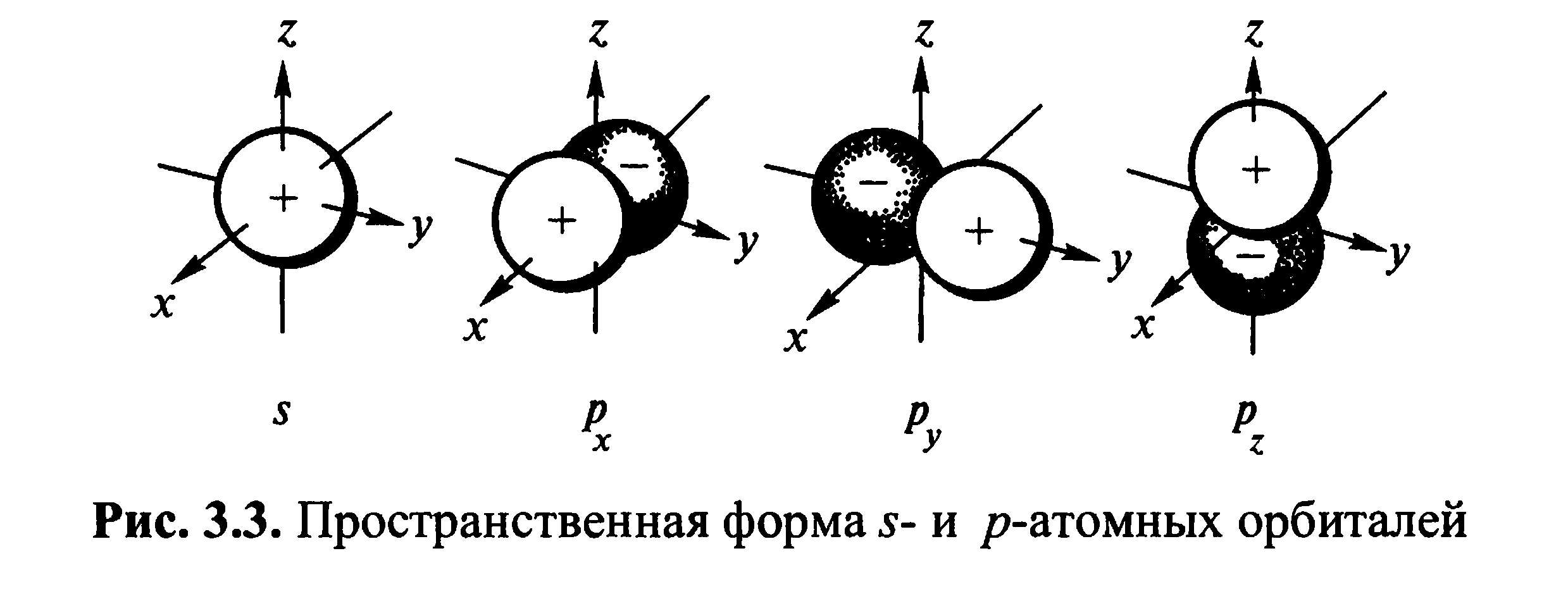 соответствии с этими обозначениями
говорят об s-подуровне,
p-подуровне
и т.д. Электроны, характеризующиеся
значениями побочного квантового числа
0, 1, 2 и 3, называют соответственно
s-электронами,
p-электронами,
d-электронами
и f-электронами.
При данном значении главного квантового
числа наименьшей энергией обладают
s-электроны,
затем p-,
d-
и f-электроны.
соответствии с этими обозначениями
говорят об s-подуровне,
p-подуровне
и т.д. Электроны, характеризующиеся
значениями побочного квантового числа
0, 1, 2 и 3, называют соответственно
s-электронами,
p-электронами,
d-электронами
и f-электронами.
При данном значении главного квантового
числа наименьшей энергией обладают
s-электроны,
затем p-,
d-
и f-электроны.
Состояние электрона в атоме, отвечающее определенным значениям n и l, записывается следующим образом: сначала цифрой указывается значение главного квантового числа, а затем буквой – орбитального квантового числа. Так, обозначение 2p относится к электрону, у которого n = 2 и l = 1, обозначение 3d – к электрону, у которого n = 3 и l = 2.
Магнитное квантовое число m.
И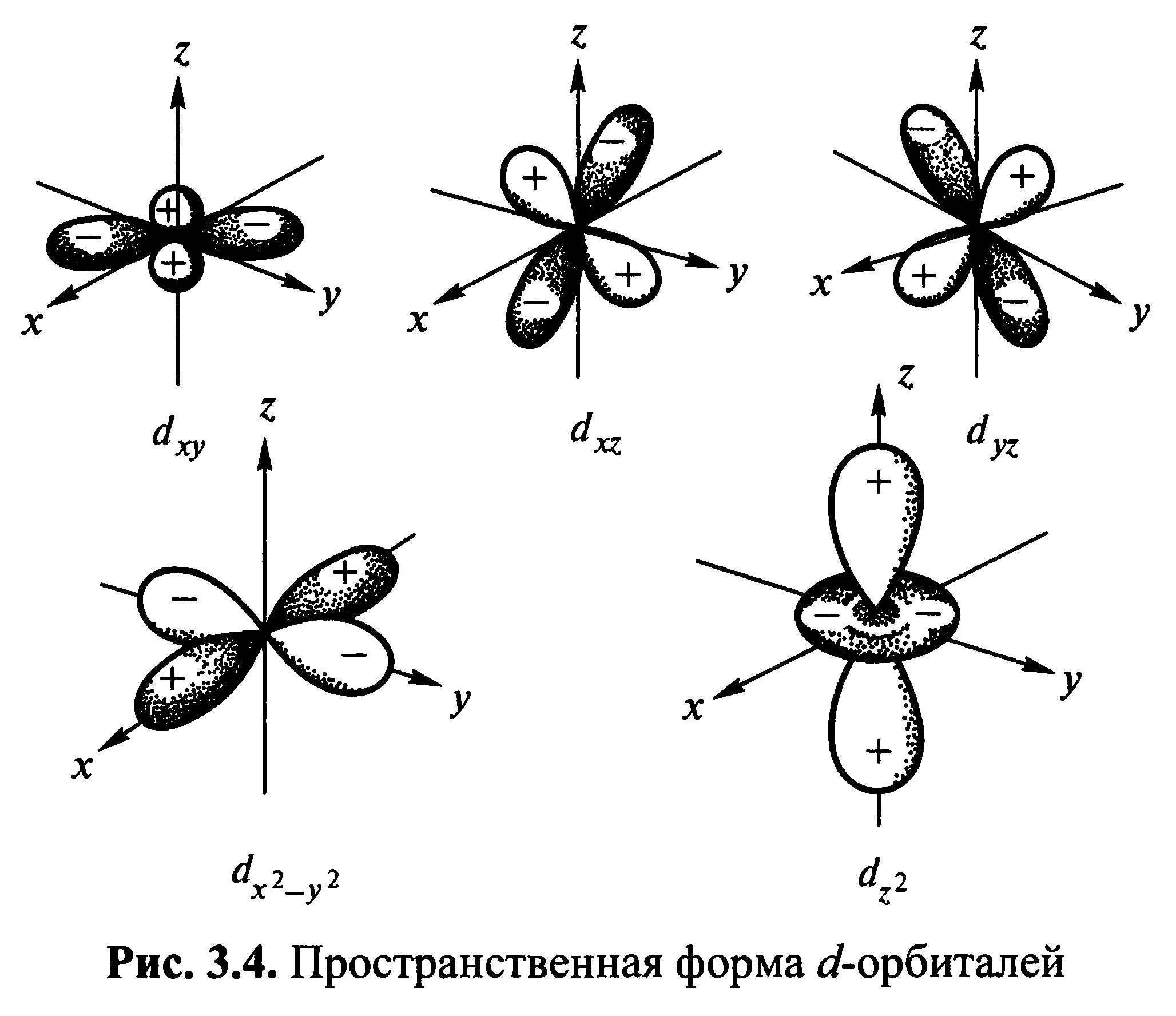 з
уравнения Шредингера следует, что
ориентация
электронного облака в пространстве не
может быть произвольной: она определяется
значением третьего, так называемого
магнитного квантового числа m.
з
уравнения Шредингера следует, что
ориентация
электронного облака в пространстве не
может быть произвольной: она определяется
значением третьего, так называемого
магнитного квантового числа m.
Магнитное квантовое число может принимать любые целочисленные значения – как положительные, так и отрицательные – в пределах от +l до −l. Таким образом, для разных значений l число возможных значений m различно. Так, для s-электронов (l = 0) возможно только одно значение m (m = 0); для p-электронов (l = 1) возможны три различных значения m (−1, 0, +1); при l = 2 (d-электроны) m может принимать пять различных значений (−2, −1, 0, +1, +2). Вообще, некоторому значению l соответствует (2l + 1) возможных значений магнитного квантового числа, т.е. (2l + 1) возможных расположений электронного облака в пространстве.
Состояние электрона в атоме, характеризующиеся определенными значениями квантовых чисел n, l и m, т.е. определенными размерами, формой и ориентацией в пространстве электронного облака, получило название атомной электронной орбитали.
Спиновое квантовое число s.
Электрон характеризуется еще одной квантованной величиной, не связанной с движением электрона вокруг ядра, а определяющей его собственное состояние. Эта величина получила название спинового квантового числа или просто спина (spin – кручение, вращение). Спин электрона может иметь только два значения: + ½ или −½; таким образом, как и в случае остальных квантовых чисел, возможные значения спинового квантового числа различаются на единицу.
