
- •21.Основные газовые законы и область их применения. Идеальный газ. Выводы закона Клапейрона-Менделеева. Универсальная газовая постоянная.
- •1. Собственный объём молекул газа пренебрежимо мал по сравнению с объёмом сосуда;
- •2. Между молекулами газа отсутствуют силы взаимодействия;
- •3. Столкновение молекул газа между собой и со стенками сосуда абсолютно упругие.
- •Вывод уравнения Менделеева – Клайперона.
- •22.Вывод основного уравнения молекулярно кинетической теории газов для давления. Средняя квадратичная скорость молекул. Средняя кинетическая энергия поступательного движения молекул газа.
- •Средняя кинетическая энергия поступательного движения молекул газа.
- •23.Распределение скоростей молекул по Максвеллу. Наиболее вероятная скорость, средняя арифметическая скорость. Опыт Штерна.
- •1. Это не физический случай;
- •24.Идеальный газ в поле силы тяжести. Выбор барометрической формулы. Распределение Больцмана. Распределение Больцмана.
- •Барометрическая формула.
- •25. Число столкновений и средняя длинна свободного пробега молекул. Явление переноса в газах. Опытные законы диффузии, внутреннего трения и теплопроводности.
- •26. Молекулярно-кинетическая теория явления переноса. Коэффициенты переноса и их зависимость от давления.
- •27. Работа газа при его расширении. Внутренняя энергия идеального газа. Уравнение Майера.
- •28. Равномерное распределение энергии по степеням свободы. Классическая теория теплоемкостей идеального газа и ее недостатки.
- •29.Теплота и работа. Первое начало термодинамики и закон сохранения и превращения энергии. Применение первого начала к изохорическому процессу. Количество проводимого тепла в этом процессе.
- •Изохорный процесс.
- •30. Применение первого начала термодинамики к изобарическому процессу. Работа, совершаемая газом, и количество проводимого тепла.
- •31. Применение первого начала термодинамики к изотермическому процессу. Работа, совершаемая газом, и количество проводимого тепла.
21.Основные газовые законы и область их применения. Идеальный газ. Выводы закона Клапейрона-Менделеева. Универсальная газовая постоянная.
Идеальным газом называется газ, молекулы которого не взаимодействуют друг с другом на расстоянии и имеют малые собственные размеры. Это идеализированная модель, согласно которой:
1. Собственный объём молекул газа пренебрежимо мал по сравнению с объёмом сосуда;
2. Между молекулами газа отсутствуют силы взаимодействия;
3. Столкновение молекул газа между собой и со стенками сосуда абсолютно упругие.
Уравнением Клайперона
называется соотношение, справедливое
для постоянной массы идеального газа:
![]() .
R=C\v
– молярная
газовая постоянная,
согласно закону Авогадро (при одинаковых
давлениях и температурах молярные
объемы различных газов также одинаковы).
Отсюда следует, что R
одинаково у всех газов. Поэтому ее
принято называть универсальной
газовой постоянной.
R
= 8, 31 Дж/(K
моль)
.
R=C\v
– молярная
газовая постоянная,
согласно закону Авогадро (при одинаковых
давлениях и температурах молярные
объемы различных газов также одинаковы).
Отсюда следует, что R
одинаково у всех газов. Поэтому ее
принято называть универсальной
газовой постоянной.
R
= 8, 31 Дж/(K
моль)
Молярной массой любого тела называется физическая величина, равная отношению массы тела к количеству молей, которое в нём содержится: = m/, = m/ ; = 10 –3 m/mo , где m масса молекулы данного тела, mo масса одной двенадцатой массы атома углерода.
Молярным объёмом называется физическая величина, равная отношению объёма газа к числу молей, содержащихся в газе: V =V/ .
Вывод уравнения Менделеева – Клайперона.
V =V/, перепишем уравнение состояния в форме учтя что R=C\, получим P V = RT отсюда PV = RT.
22.Вывод основного уравнения молекулярно кинетической теории газов для давления. Средняя квадратичная скорость молекул. Средняя кинетическая энергия поступательного движения молекул газа.
Основным
уравнение кинетической
энергии газов есть соотношение:
![]() .
.
Это уравнение выполняется при N = const общее число молекул в газе, то есть при отсутствии химических реакций; газ может состоять из разнородных молекул.
![]() суммарная энергия
поступательного движения молекул газа,
находящихся в сосуде, где mi
масса, а Vi
скорость «i
ой» молекулы.
суммарная энергия
поступательного движения молекул газа,
находящихся в сосуде, где mi
масса, а Vi
скорость «i
ой» молекулы.
Для однородного
газа mi
= mo
, тогда
![]() .
.
Средняя кинетическая энергия поступательного движения молекул газа.
Введём средне
квадратичную скорость V
квадр.
поступательного
движения молекул газа:
![]() .
Тогда
.
Тогда
![]()
Подставим данный результат в основное уравнение кинетической теории газов
![]() (*), m
масса всего газа.
(*), m
масса всего газа.
Сопоставим полученный результат с уравнением МенделееваКлайперона:
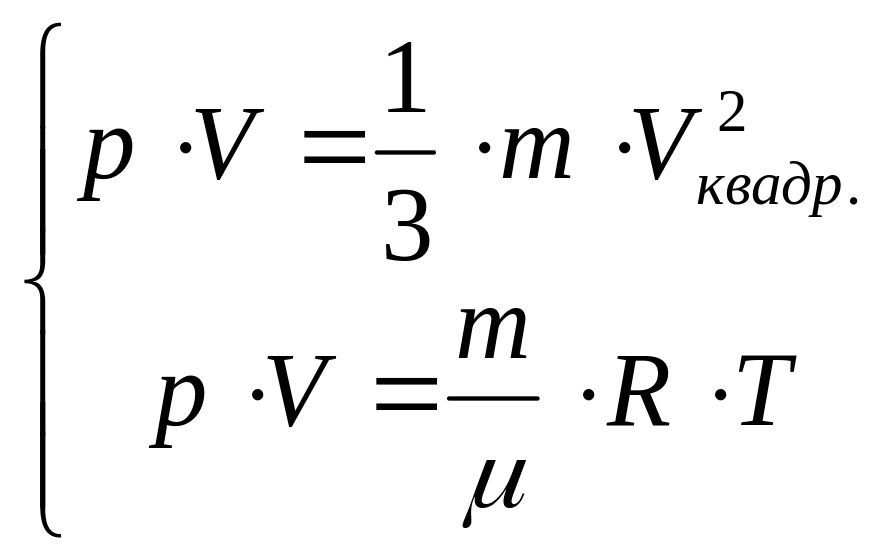
![]() ,
здесь использовалось полезное соотношение:
,
здесь использовалось полезное соотношение:
![]() .
Связь давления, плотности газа и средней
квадратичной скорости следует (*):
.
Связь давления, плотности газа и средней
квадратичной скорости следует (*):
![]()
Средняя кинетическая энергия поступательного движения одной молекулы идеального газа:
![]() .После
подстановки явного выражения для средней
квадратичной скорости, получим:
.После
подстановки явного выражения для средней
квадратичной скорости, получим:
![]()
Наиболее вероятная скорость vB – соответствует максимуму f.
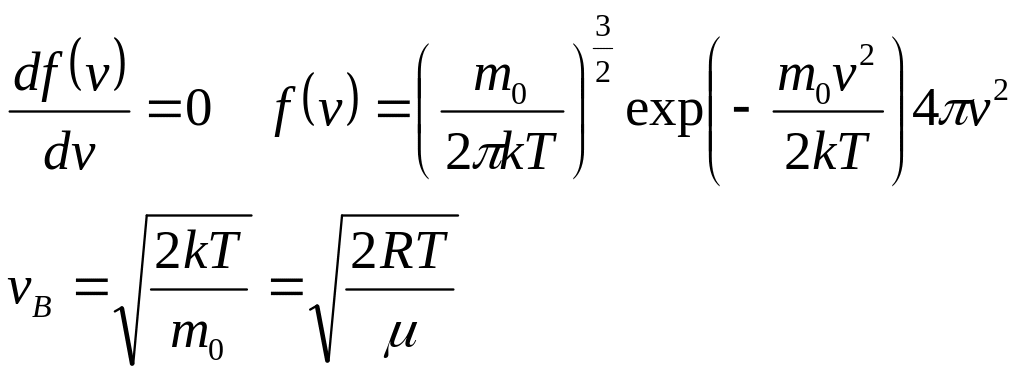
23.Распределение скоростей молекул по Максвеллу. Наиболее вероятная скорость, средняя арифметическая скорость. Опыт Штерна.
Закон
распределения молекул идеального газа
по скоростям определяет долевое участие
молекул однородного газа в тепловом
движении при данной температуре со
скоростями, заключёнными в интервале
от V
до V
+ V.
Он выведен теоретически:
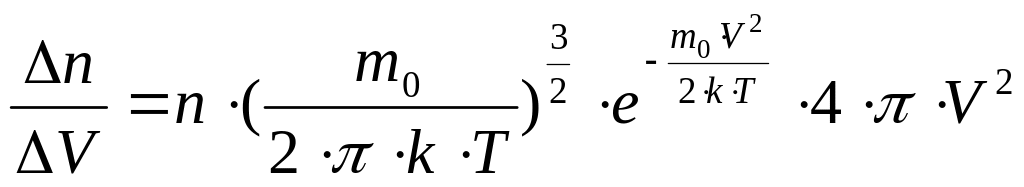 ,
,
где n число молекул в единице объёма (концентрация молекул),
n
число молекул
из общего их
числа, скорости которых лежат в интервале
скоростей:
![]() ,
,
m0 масса одной молекулы,
k постоянная Больцмана,
T температура газа.
Чем меньше по величине выбирается интервал скоростей, тем более точный результат даёт данная формула.
N в единицу объёма, которые [,+ ]
Графическая
иллюстрация данной формулы приведена
на графике зависимости относительной
концентрации молекул n/V
идеального однородного газа от
скорости.Функцией распределения молекул
идеального газа по скоростям Максвелла
называется выражение: .С
помощью этой функции можно найти все
статистически необходимые величины,
характеризующие состояние идеального
газа.
.С
помощью этой функции можно найти все
статистически необходимые величины,
характеризующие состояние идеального
газа.
Вначале найдём наивероятнейшую скорость, т.е. значение скорости, соответствующее максимуму функции Максвелла. С точки зрения физики это такое значение скорости, к которому близки значения скорости большей части молекул. Воспользуемся методом нахождения экстремума функции, т.е. вначале возьмём производную от функции распределения Максвелла по скорости, а затем приравняем полученное выражение к нулю:
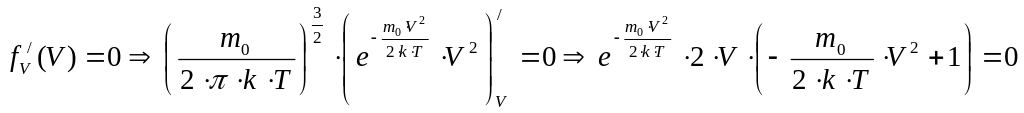 .
.
Последнее уравнение имеет три решения, т.к. необходимо равенство нулю каждого из множителей:
