
- •Динамика
- •§3. Взаимодействие тел. Сила.
- •§4. Нахождение равнодействующей.
- •§5. Разложение силы на составляющие
- •§6. Второй закон Ньютона
- •§7. Импульс материальной тоски. Другая формулировка 2-го закона Ньютона.
- •§8. Третий закон Ньютона
- •Фундаментальные и нефундаментальные взаимодействия
- •Реальные силы. Силы упругости и силы трения
- •Силы трения
- •Потенциальная и кинетическая энергия. Понятие «механическая работа»
- •6.1. Момент импульса частицы. Момент силы
- •Момент инерции
- •Законами сохранения движения или положения центра масс м.С.
- •Нётер теорема
- •Работа при изменении объема газа
- •2.5. Адиабатический процесс
- •Второе начало термодинамики. Энтропия
- •Потеря качества. Необратимость
- •Асимметрия в природе
- •Энтропия и энергия. Стрела времени
- •9.1.2. Цикл Карно
2.5. Адиабатический процесс
В параграфе
1.4 было
введено понятие адиабатически
изолированной системы, то есть системы,
которая не обменивается теплотой с
окружающими телами. Процессы, происходящие
в такой системе, называются адиабатическими.
Так как при адиабатических процессах ![]() ,
то первое начало термодинамики для них
можно записать в форме:
,
то первое начало термодинамики для них
можно записать в форме:
|
(2.74) |
Совместное применение этого выражения и уравнения Клапейрона-Менделеева позволяет получить уравнение, описывающее адиабатический процесс в идеальном газе. Для этого представим выражение (2.74) в виде:
|
(2.75) |
Нахождение полных дифференциалов от правой и левой частей уравнения Клапейрона-Менделеева (2.10) дает:
|
(2.76) |
Вычитание из этой формулы выражения (2.75) приводит его к виду
|
(2.77) |
С учетом соотношения Майера (2.70) имеем:
|
(2.78) |
Умножим
выражение (2.75) на
отношение теплоемкостей ![]() и
сложим его с формулой (2.78).
Тогда получим
и
сложим его с формулой (2.78).
Тогда получим
|
(2.79) |
где введено обозначение
|
(2.80) |
Величина ![]() называется показателем
адиабаты.
Формулы (2.65) и (2.71) позволяют
определить показатель адиабаты через
количество степеней свободы
называется показателем
адиабаты.
Формулы (2.65) и (2.71) позволяют
определить показатель адиабаты через
количество степеней свободы ![]() :
:
|
(2.81) |
Из этого выражения следует, что показатель адиабаты для идеального газа всегда больше единицы. Для одноатомных газов этот показатель равен 1,67, а для двухатомных и многоатомных соответственно 1,4 и 1,33.
Поделив
уравнение (2.79) на
произведение ![]() преобразуем
его к виду
преобразуем
его к виду
|
(2.82) |
или
|
(2.83) |
Отсюда следует:
|
(2.84) |
Интегрирование этого уравнения позволяет получить формулу
|
(2.85) |
которая
называется уравнением
Пуассона в
честь французского механика, математика
и физика Симеона
Дени Пуассона (1781
- 1840). Это уравнение
адиабатического процесса для идеального
газа,
или адиабаты -
кривой, описываемой этим уравнением в
переменных ![]() и
и ![]() .
.
С помощью уравнения Клапейрона-Менделеева уравнение (2.85) можно переписать, используя другие параметры состояния идеального газа:
|
(2.86) |
|
(2.87) |
Сравнивая
уравнение Пуассона (2.85) с
уравнением Бойля-Мариотта (2.11): ![]() ,
можно убедиться, что адиабата идеального
газа, построенная в координатах
,
можно убедиться, что адиабата идеального
газа, построенная в координатах ![]() и
,
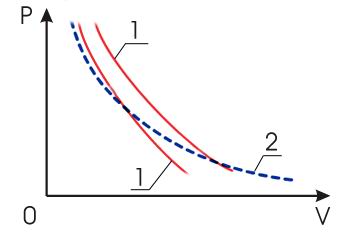
всегда идёт круче изотермы (см. рис.
2.7).
и
,
всегда идёт круче изотермы (см. рис.
2.7).
|
Рис. 2.7. Графики адиабатических процессов (1) и изотермического процесса (2) |
Это связано с тем, что, как указывалось выше, показатель адиабаты для газов всегда больше единицы и принимает наибольшее значение для одноатомных газов. Поэтому самую крутую адиабату имеют инертные газы, молекулы которых состоят из одного атома.
Поскольку адиабата пересекает все изотермы данной термодинамической системы, возможен адиабатический переход с одной изотермы на другую, путём сжатия или разрежения газа. А посредством изотермического изменения объёма возможен переход с одной адиабаты на другую.
Работу идеального газа в адиабатическом процессе можно определить с помощью выражения (2.74). Интегрирование (см. комментарий к формулам (1.6) - (1.8)) этого выражения дает:
|
(2.88) |
где: ![]() и
и ![]() -
температуры газа в начале и в конце
процесса соответственно. В данном случае
работа при переходе из одного состояния
системы в другое определяется только
функцией состояния системы
-
температуры газа в начале и в конце
процесса соответственно. В данном случае
работа при переходе из одного состояния
системы в другое определяется только
функцией состояния системы ![]() ,
так как путь перехода однозначно задан
уравнением Пуассона.
,
так как путь перехода однозначно задан
уравнением Пуассона.
Молярная
теплоемкость газа ![]() может
быть выражена через показатель адиабаты
.
Подстановка в формулу (2.80) соотношения
Майера (2.70) приводит
её к виду
может
быть выражена через показатель адиабаты
.
Подстановка в формулу (2.80) соотношения
Майера (2.70) приводит
её к виду
|
(2.89) |
из которого следует искомое выражение:
|
(2.90) |
С учетом этой формулы выражение (2.88) может быть представлено в форме
|
(2.91) |
На основании уравнения адиабаты (2.86) запишем соотношение между температурами и объемами газа в начальном и конечном состояниях:
|
(2.92) |
или
|
(2.93) |
Подстановка этой формулы в выражение (2.91) дает
|
(2.94) |
или с учетом уравнения Клапейрона-Менделеева (2.10)
|
(2.95) |
Формула (2.95) может быть получена и непосредственно с помощью интеграла (1.13), при подстановке в него уравнения Пуассона (2.85), записанного для произвольной точки адиабаты
|
(2.96) |
Тогда имеем
|
(2.97) |
Адиабатический процесс может быть реализован в газе либо путём его термоизоляции, либо за счёт быстрого протекания процесса, когда процесс теплопередачи не успевает произойти. Первый способ применялся в опытах Джоуля, описанных выше, где было принципиально необходимо достижение газом состояния, близкого к равновесному. Поэтому каждый из опытов требовал продолжительного времени (около часа) и возникала необходимость введения поправок на тепловые потери.
Примером быстропротекающего процесса является распространение звука в воздухе. Несмотря на то, что такой процесс нельзя считать равновесным, опыт показывает, что для его описания возможно применение уравнения Пуассона, полученного в рамках равновесной термодинамики.
В 1816 году, за семь лет до вывода Пуассоном уравнения адиабатического процесса, Пьером Симоном Лапласом (1749 - 1827) была получена формула для скорости распространения звука в газе
|
(2.98) |
где:
и ![]() -
давление и плотность газа. Измерения
значений
-
давление и плотность газа. Измерения
значений ![]() ,
и
позволяют
по этой формуле рассчитать значение
показателя адиабаты
,
и
позволяют
по этой формуле рассчитать значение
показателя адиабаты ![]() .
Для воздуха это значение близко к 1,4,
что указывает на возможность с хорошей
точностью считать его состоящим из
двухатомных молекул.
.
Для воздуха это значение близко к 1,4,
что указывает на возможность с хорошей
точностью считать его состоящим из
двухатомных молекул.
Экспериментальное
определение молярных теплоёмкостей
и ![]() для
реальных газов представляет собой
довольно сложную задачу. Большой вклад
в её решение внёс Анри
Виктор Реньо (1810
- 1878), под руководством которого были
измерены молярные теплоёмкости многих
веществ, в том числе газов. Исследования
проводились в лаборатории при Сервской
фарфоровой мануфактуре и носили
прикладной характер, связанный с
совершенствованием тепловых машин.
Некоторыми из методик, разработанных
Ренье, впоследствии воспользовался
Джоуль при проведении своих опытов.
для
реальных газов представляет собой
довольно сложную задачу. Большой вклад
в её решение внёс Анри
Виктор Реньо (1810
- 1878), под руководством которого были
измерены молярные теплоёмкости многих
веществ, в том числе газов. Исследования
проводились в лаборатории при Сервской
фарфоровой мануфактуре и носили
прикладной характер, связанный с
совершенствованием тепловых машин.
Некоторыми из методик, разработанных
Ренье, впоследствии воспользовался
Джоуль при проведении своих опытов.
В
заключение рассмотрим вопрос о том, как
соотносится уравнение Пуассона,
записанное в переменных
и
(2.86),
с результатами опытов Гей-Люссака,
описанными в предыдущем параграфе.
Действительно, в соответствии с
результатами этих опытов температура
идеального газа не изменяется при его
расширении в жестком, адиабатически
изолированном сосуде, а согласно
уравнению (2.86) температура
такого газа при адиабатическом процессе
должна понижаться. Это кажущееся
противоречие объясняется тем, что в
соответствии со схемой опыта Гей-Люссака,
показанной на рис. 2.5, идеальный газ при
расширении не совершает механической
работы над внешними телами: ![]() .
Поэтому соотношение (2.74) сводится
к тождеству:
.
Поэтому соотношение (2.74) сводится
к тождеству: ![]() ,
и получение из него выражений (2.75) - (2.79) и
далее формул (2.82) - (2.85) становится
невозможным.
,
и получение из него выражений (2.75) - (2.79) и
далее формул (2.82) - (2.85) становится
невозможным.
Таким образом, уравнение Пуассона неприменимо для описания опытов Гей-Люссака. Это связано с тем, что процесс адиабатического расширения идеального газа без совершения механической работы является необратимым, в отличие от обратимого адиабатического расширения, описываемого уравнением Пуассона. Подробнее описание необратимого адиабатического расширения рассмотрено в параграфе 4.3.
Задача
2.2. Внутри закрытого теплоизолированного
цилиндрического сосуда находится
теплонепроводящий поршень, который
может двигаться без трения. В начальный
момент поршень находится в середине
сосуда и делит его на равные части
объемом ![]() .
В каждой из этих половин сосуда находится
идеальный газ с показателем адиабаты
при
давлении
.
В каждой из этих половин сосуда находится
идеальный газ с показателем адиабаты
при
давлении ![]() .
Какую работу надо совершить, чтобы
уменьшить объём одной из половин в два
раза?
.
Какую работу надо совершить, чтобы
уменьшить объём одной из половин в два
раза?
Решение: В обеих частях цилиндрического сосуда будет происходить адиабатический процесс
![]() ,
,
где объёмы V1 и V2 двух частей сосуда связаны соотношением
![]() .
.
Пусть
происходит уменьшение в два раза половины
сосуда, описываемой объемом ![]() ,
то есть объем
,
то есть объем ![]() изменяется
от
до
изменяется
от
до ![]() .
Соответственно объем
.
Соответственно объем ![]() увеличивается
от
до
увеличивается
от
до ![]() .
Тогда элементарная работа, совершаемая
над газом, будет определяться разностью
давлений в двух частях сосуда:
.
Тогда элементарная работа, совершаемая
над газом, будет определяться разностью
давлений в двух частях сосуда:
![]() ,
,
где
учтено, что ![]() .
.
Подстановка в последнюю формулу первых двух соотношений и её интегрирование дает

При ![]() это
выражение равно нулю, в чем можно
убедиться устремив
к
единице и раскрыв неопределенность.
При
это
выражение равно нулю, в чем можно
убедиться устремив
к
единице и раскрыв неопределенность.
При ![]() это
выражение становится положительным,
так как при увеличении параметра
второе
слагаемое в этой формуле растёт быстрее,
чем убывает первое.
это
выражение становится положительным,
так как при увеличении параметра
второе
слагаемое в этой формуле растёт быстрее,
чем убывает первое.
Задача
2.3. Адиабатически изолированный сосуд
разделен перегородкой на две равные
части, каждая объемом
.
В левой части находится двухатомный
идеальный газ при давлении
и
температуре
.
Торцевая стенка правой части сосуда
является поршнем. Перегородку вынули,
а затем газ медленно сжали поршнем так,
что он снова стал занимать левую половину
сосуда. Найти давления ![]() ,
, ![]() и
температуры
,
газа
после изъятия перегородки и в конце
процесса.
и
температуры
,
газа
после изъятия перегородки и в конце
процесса.
Решение: При адиабатическом расширении идеального газа без совершения работы над внешними телами, его внутренняя энергия и температура не изменяются. Поэтому после изъятия перегородки имеем:
![]() ,
,
![]() .
.
При адиабатическом сжатии газа поршнем увеличение его внутренней энергии равно работе, совершенной поршнем. Температура и давление газа в конце процесса могут быть найдены с помощью соотношений (2.86) и (2.85), из которых имеем:
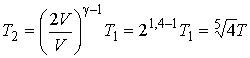 ,
,
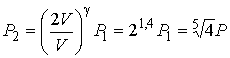 .
.
Отметим, что хотя протекающие процессы при расширении газа и его сжатии различные, уравнение состояния идеального газа применимо для описания конечного состояния газа для обоих этих случаев. Расширение газа после удаления перегородки будет необратимым, а его медленное сжатие поршнем - можно описывать как обратимый процесс. Возможность использования уравнения состояния идеального газа для описания конечного состояния необратимого процесса связано с предположением о том, что при достижении этого конечного состояния газ становится термодинамически равновесной системой.
http://www.ngpedia.ru/cgi-bin/findimg.exe?reg=1&text=032200231238242229240236251032232032224228232224225224242224046
31-?

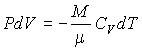 .
.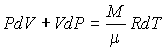 .
. .
.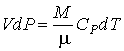 .
.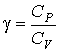 .
.
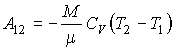 ,
,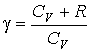 ,
,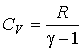 .
.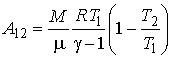 .
.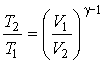 .
.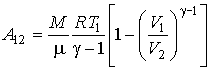
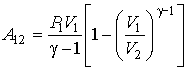 .
. .
.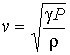 ,
,