
- •1)Химическая кинетика
- •Катализ
- •2)Химическое равновесие
- •3)Растворы электролитов
- •4) Гидролиз солей.
- •5) Строение атома.
- •6) Периодический закон д.И. Менделеева
- •7) Химическая связь
- •8) Окислительно восстановительные реакции.
- •10) Водород
- •11) Элементы iа - подгруппы
- •12) Элементы II а- подгруппы
- •13) ЭлементыIiiAподгрупа.
4) Гидролиз солей.
Гидролиз солей – взаимодействие ионов соли с водой, которое приводит к образованию слабой кислоты или слабого основания.
Типы гидролиза:
а) гидролиз по аниону происходит в растворах солей, состоящих из анионов слабых кислот и катионов сильных оснований.
б) гидролиз по катиону происходит в растворах солей, состоящих из катионов слабых оснований и анионов сильных кислот.
в) гидролиз по катиону и аниону одновременно характерен для солей, которые образованы из катионов слабых оснований и анионов слабых кислот.
KNO3 (KON-сильное основание и KNO2-слабая одноосновная кислота)
KNO2 + НОН=KOH + HNO2
K++NO2-+H2O= K++OH-+HNO2
NO-2 + H2O=OH- + HNO2
______________
NH4I (NH4OH-слабое основание, HI-сильная кислота)
NH4I+HOH=NH4OH+HI
NH4+ + H2O= NH4OH + H+
NH4++H2O=NH4OH + H+
Гидролиз протекает необратимо в том случае, когда соль образована очень слабой кислотой и очень слабым основанием.
Al2S3 + 6Н2О →2 Al(ОН)3↓+ 3Н2S↑
Fe2(CO3)3 + 3H2O → 2Fe(OH)3↓ + 3CO2↑
Константа гидролиза - Произведение двух постоянных (константы равновесия гидролиза и концентрации воды) называется константой гидролиза.
Для солей, гидролизующихся по катиону:
![]()
Для солей, гидролизующихся по аниону:
![]()
Для солей, гидролизующихся по катиону и аниону:
![]()
При расчете константы гидролиза нужно использовать константу диссоциации того слабого электролита, который на этой ступени образуется.
Степень гидролиза – это отношение концентрации соли, подвергшейся гидролизу ссоли г, к общей концентрации соли в растворе ссоли.
![]()
Величины Kг и степени гидролиза h связаны между собой отношением, аналогичным закону разбавления Оствальда:
Kг = h 2С/(1– h),
а при малых значениях h<<1: Kг = h 2С,
Отсюда степень гидролиза
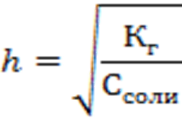
Можно отметить следующие общие закономерности гидролиза солей слабых кислот и сильных оснований:
а) степень гидролиза уменьшается при увеличении концентрации раствора соли
в) степень гидролиза зависит от силы кислоты (чем меньше Ккисл, т.е. чем слабее кислота, тем в большей степени гидролизуется ее соль)
с) степень гидролиза зависит от температуры, так как в числителе подкоренного выражения стоит ионное произведение воды Кw, сильно зависящее от температуры, а константы диссоциации слабых кислот зависят от температуры в меньшей степени, чем Кw.
5) Строение атома.
Атом — электронейтральная микросистема, состоящая из положительно заряженного ядра и отрицательно заряженных электронов.
Ядра атомов состоят из двух типов частиц (нуклонов)— протонов и нейтронов (табл. 3.1).Линейные размеры атома ~10~8 см, ядра ~10-12— 10~13см.Основная масса атома сосредоточена в ядре и характеризуется массовым числом А, равным сумме чисел протонов (заряду ядра)Zи нейтроновN: A = Z + N.Главной характеристикой атома является заряд ядра. Он определяет число электронов, находящихся вокруг ядра, т. е. принадлежность атома к данному виду химических элементов, и соответствует атомному номеру (в периодической системе элементов Менделеева — порядковому номеру)элемента.Основой современной теории строения атома являются законы и положения квантовой (волновой) механики— раздела физики, изучающего движение микрообъектов (электронов, протонов и других частиц, обладающих ничтожной массой).Согласно квантовомеханическим представлениям, движущимся микрообъектам присуща двойственная.природа: они являются частицами, но имеют волновой характер движения, т. е. микрообъекты обладают одновременно корпускулярными и волновыми свойствами. Математически это выражается уравнением де - Бройля, согласно которому частице, имеющей массуmи движущейся со скоростью v, соответствует волна длиной А,:h=mvгдеh— постоянная Планка;mv— импульс частицы.Из волновых свойств микрообъектов вытекает очень важный вывод, известный под названием принципа неопределенности Гейзенберга:микрочастица (так же, как и волна) не имеет одновременно точных значений координат и импульса.Это проявляется в том, что чем точнее определяются координаты частицы, тем неопределеннее ее импульс (или связанная с ним скорость), и наоборот. Поэтому для описания движения микрочастиц используется вероятностный подход, т. е. определяется не их точное положение, а вероятность нахождения в той или иной области околоядерногопространства.Состояние (в квантовой механике синоним слова «движение») электрона в атоме описывается с помощью кван - товомеханической модели — электронного облака, плотность соответствующих участков которого пропорциональна вероятности нахождения там электрона. Поскольку такая вероятность существует даже на относительно большом расстоянии от ядра, электронное облако не имеет определенных четких границ. Поэтому обычно под электронным облаком данного электрона, характеризующегося волновой функцией, понимают область околоядерно- го пространства, ограниченного условной поверхностью, которая охватывает примерно 90 % электронного облака. Эта область пространства называется такжеорбиталью.
Главное квантовое число определяет энергетический уровень электрона в атоме. Чем больше n, тем слабее электрон связан с ядром и больше его орбиталь.
Волновая функция есть амплитуда трехмерной электронной волны, т. е. является амплитудой вероятности присутствия данного электрона в данной области пространства. Другими словами, колеблется не сам электрон, а вероятность его обнаружения в той или иной точке пространства. Произведение представляет собой вероятность нахождения электрона в элементарном объеме пространства дельта V, а ф2— плотность вероятности, или электронную плотность.Главное квантовое число п определяет основной запас энергии электрона, иными словами, степень его удаления от ядра, или размер электронного облака (орбитали). Оно может принимать целочисленные значения от 1 до со.Совокупность электронных состояний, имеющих одинаковое значение главного квантового числа я, называется электронным слоем (электронной оболочкой) или энергетическим уровнем. Они обозначаются цифрами 1, 2, 3, 4, 5 ... или соответствующими буквами К, L, М, N, О .... Наименьшее значение энергии Е соответствует п=1. Остальным квантовым состояниям отвечают более высокие значения энергий, и электроны, находящиеся на этих энергетических уровнях, менее прочно связаны с ядром.
Для атома водорода квантовое состояние с n= 1 соответствует его наименьшей энергии и называется основным или нормальным: Е1= — 13,6 эВ. Состояния с п = 2 , 3, 4 ... называются возбужденными. Энергии, соответствующие им, связаны с Е выражением
Электронная оболочка |
Энергетический уровень л |
Энергетический подуровень |
Возможные значения т1 ч |
Число орбиталей |
Максимальное число электронов |
||||
значение / |
тип |
на подуровне (2/+1) |
|
на подуровне (21+if |
на уровне 2 я2 |
||||
К |
1 |
0 |
S |
0 |
1 |
|
2 |
2 |
|
L |
2 |
0 |
S |
0 |
1 |
|
2 |
о |
|
|
|
1 |
Р |
— 1; +1 |
3 |
|
6 |
о |
|
М |
3 |
0 |
S |
0 |
1 |
|
2 |
|
|
|
|
1 |
р |
—1; 0; +1 |
3 |
|
6 |
18 |
|
|
|
2 |
d |
-2;-1;0;+1;+2 |
5 |
|
10 |
|
|
N |
4 |
0 |
s |
0 |
1 |
|
2 |
|
|
|
|
1 |
Р |
-1; 0; +1 |
3 |
|
6 |
49 |
|
|
|
2 |
d |
—2; —1; 0; +1; +2 |
5 |
|
10 |
|
|
|
|
3 |
f |
—3; -2; -1; 0; |
7 |
|
14 |
|
|
|
|
|
+ 1; +2; +3 |
|
|
|
|
||
с ростом атомного номера элемента электроны размещаются последовательно на орбиталях, характеризуемых возрастанием суммы главного и орбитального квантовых чисел (п-{-1); при одинаковых значениях этой суммы раньше заполняется орбиталь с меньшим значением главного квантового числа п.Последовательность заполнения энергетических подуровней в основном соответствует следующему ряду: Is, 2s, 2p, 3s, 3p, 4s,3d, 4p, 5s, 4d,5p, 6s, 4f, 5d,6p, 7s, 5f, 6d 7pПри наличии однотипных орбиталей их заполнение происходит в соответствии с правилом Хунда;в. пределах энергетического подуровня электроны располагаются так, чтобы их суммарный спин был максимальным.Это означает, что первоначально электроны заполняют все свободные орбитали данного подуровня по одному, имея при этом параллельные спины, и только потом происходит заполнение этих орбиталей вторыми электронами.Существует два способа составления схем распределения электронов в атоме: 1) в виде формул электронных конфигураций, например для igK—Is2s22p63s3pb4s\ где показатель степени указывает число электронов на данном подуровне, и 2) в виде квантовых ячеек (клетка, кружок или черточка) — для изображения электронной орбитали и стрелок, направление которых указывает на ориентацию спинов электронов,— для обозначения электронов:
