
- •Физические свойства жидкостей, транспортируемых по трубопроводам.
- •Способы транспортировки нефти, нефтепродуктов и газа.
- •Развитие нефтепроводного транспорта в России.
- •Классификация и состав сооружений магистральных нефтепроводов и нефтепродуктопроводов.
- •Насосы для перекачки нефти.
- •Регулирование работы насосных агрегатов.
- •Линейная часть магистрального трубопровода.
- •Подготовка нефти к транспорту.
- •Проектирование магистральных нефтепроводов.
- •Температура застывания.
- •Уравнение баланса напоров для участка нефтепровода.
- •Нефтепровод с промежуточными нефтеперекачивающими станциями.
- •Самотёчные участки нефтепроводов.
- •Нефтепроводы со вставками и лупингами.
- •Определение числа нефтеперекачивающих станций.
- •Расстановка нефтеперекачивающих станций.
- •Перекачка высоковязких и высокозастывающих нефтей и нефтепродуктов.
- •Последовательная перекачка нефтей и нефтепродуктов.
- •Смесеобразование при последовательной перекачке.
- •Длина и объём области смеси.
- •Особенности гидравлического расчёта трубопровода при последовательной перекачке.
- •Классификация и состав сооружений магистральных газопроводов.
- •Подготовка газа к транспорту.
- •Компрессорные станции.
- •Физические свойства газов.
- •Уравнение состояния газа.
- •Основные формулы гидравлического расчёта магистрального газопровода.
- •Коэффициент гидравлического сопротивления для магистрального газопровода.
Физические свойства газов.
Физические свойства газов характеризуются следующими основными параметрами:
Плотность ,
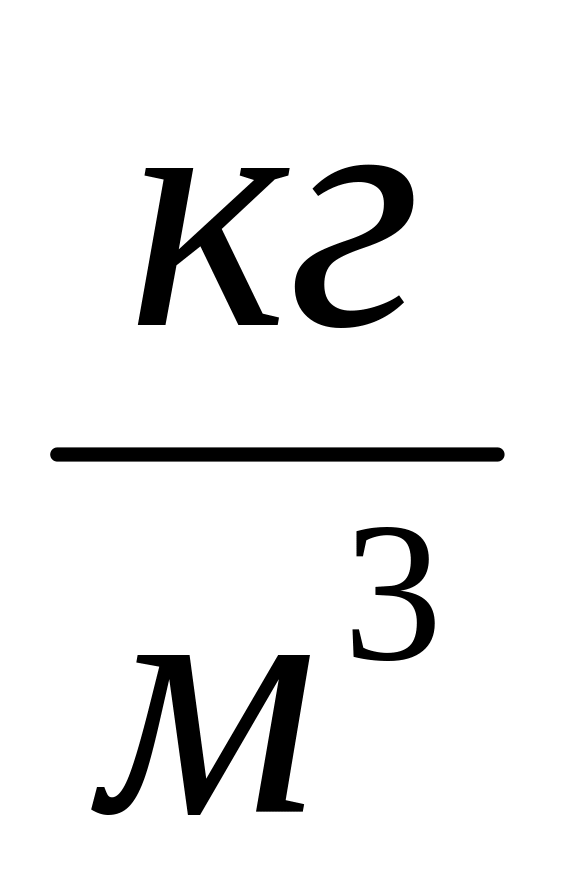 .
.Удельный объём
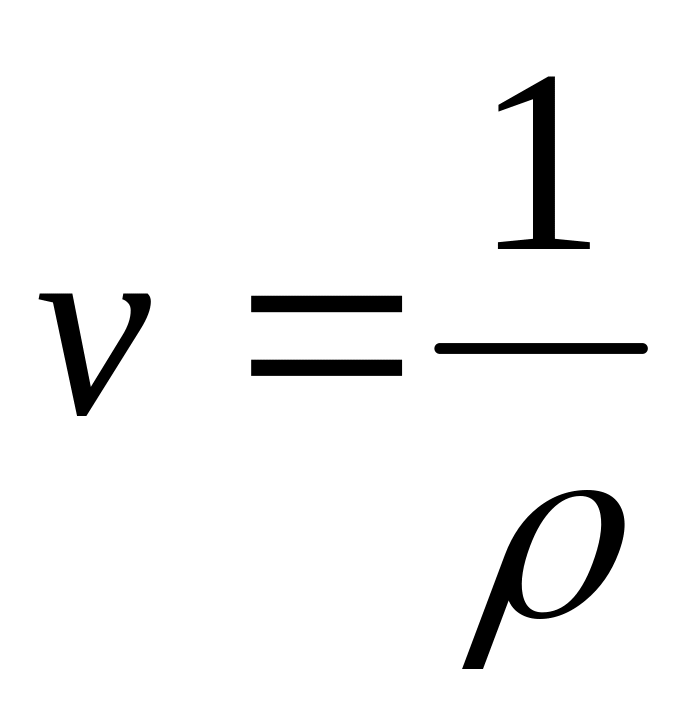 ,
,
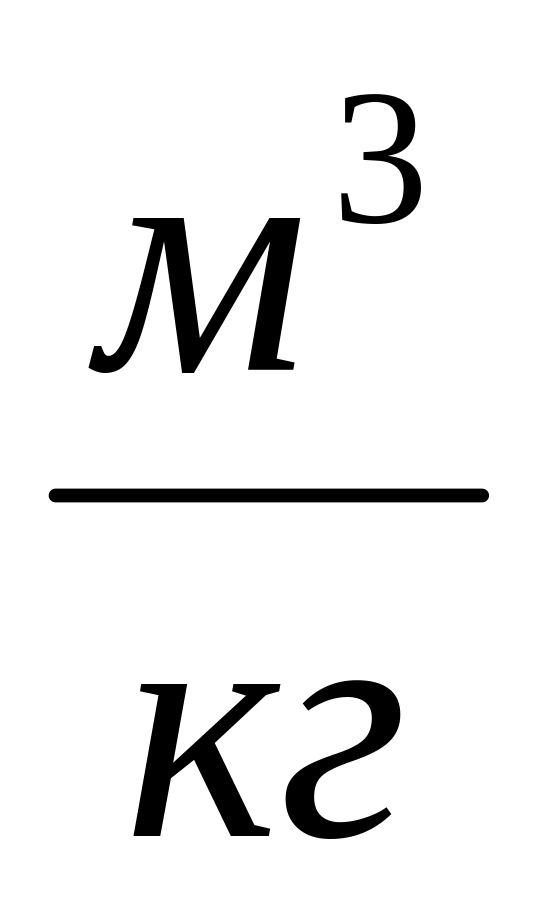 .
.Динамическая вязкость
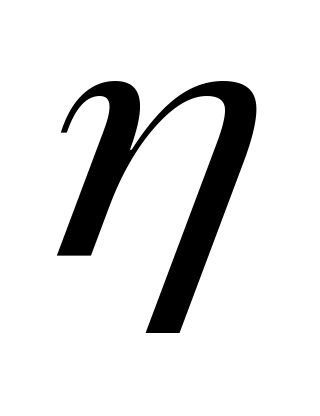 ,
,
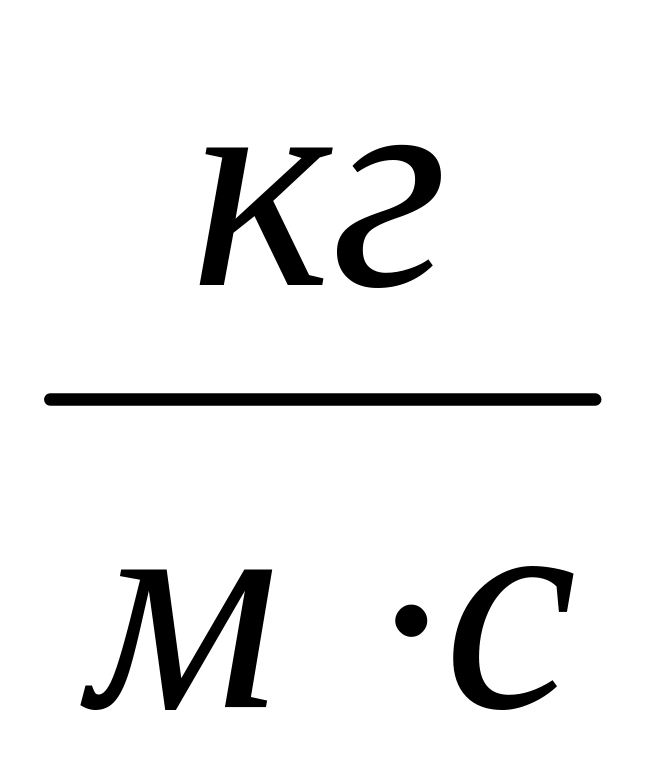 .
.Удельная теплоёмкость
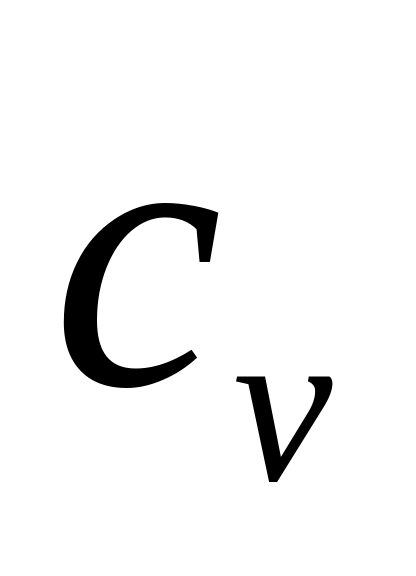 ,
,
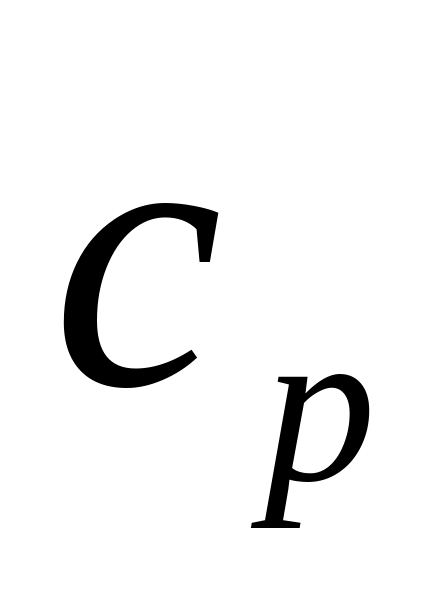 ,
,
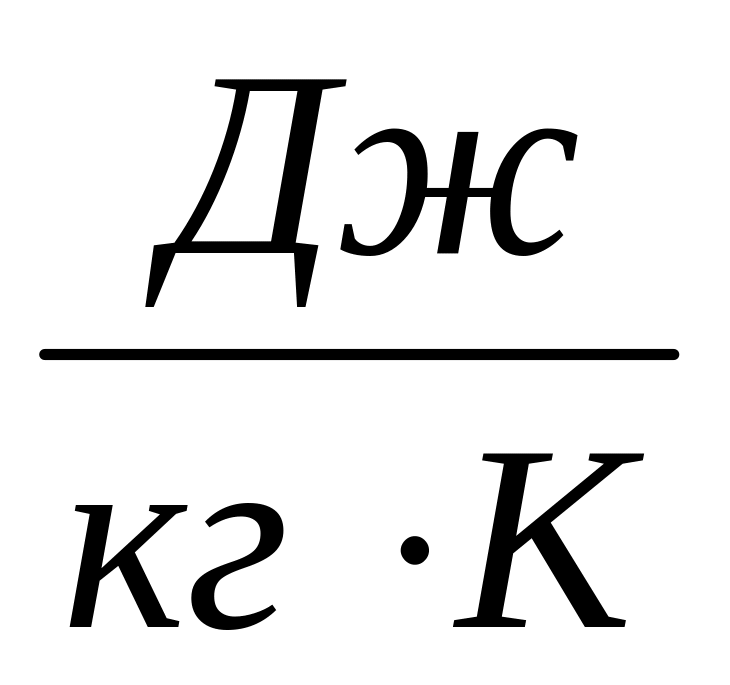 .
.Относительная плотность:
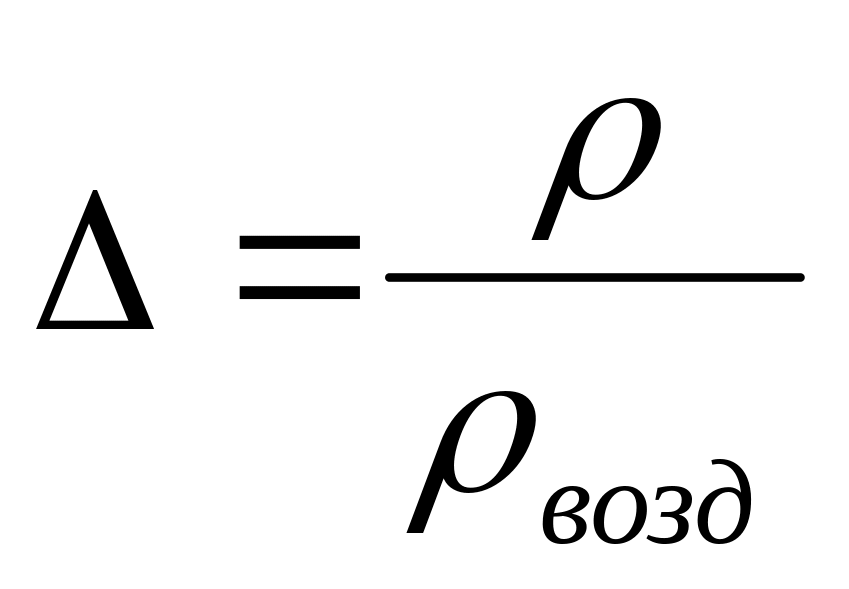 .
.
Плотность воздуха при стандартных
условиях (![]() ,
,
![]() )
составляет 1.206 килограмма на кубометр,
при нормальных условиях (
,
)
составляет 1.206 килограмма на кубометр,
при нормальных условиях (
,
![]() ).
).
Вязкость газов, в отличие от вязкости
жидкости, при увеличении температуры
тоже увеличивается:
![]() ,
где
,
где
![]() - вязкость при температуре 273 кельвина.
- вязкость при температуре 273 кельвина.
Существует две основные модели, описывающие поведение газа: модель идеального газа и модель реального газа. Вязкость идеального газа с повышением давления не меняется, а вязкость реального газа с повышением давления увеличивается.
Теплоёмкость газа зависит от процесса,
который происходит с газом и от свойств
самого газа. При изохорном процессе
теплоёмкость можно вычислить по следующей
формуле:
![]() .
Теплоёмкость при изобарном процессе
определяется из следующего уравнения:
.
Теплоёмкость при изобарном процессе
определяется из следующего уравнения:
![]() .
.
При движении газа по трубопроводу наблюдается эффект Джоуля-Томпсона, который заключатся в снижении температуры газа по мере его продвижения по трубопроводу, так как при понижении давления уменьшается кинетическая энергия газа, что приводит к уменьшению его температуры.
При перекачке газа по магистральному газопроводу используются три основных величины расхода:
Объёмный расход ,
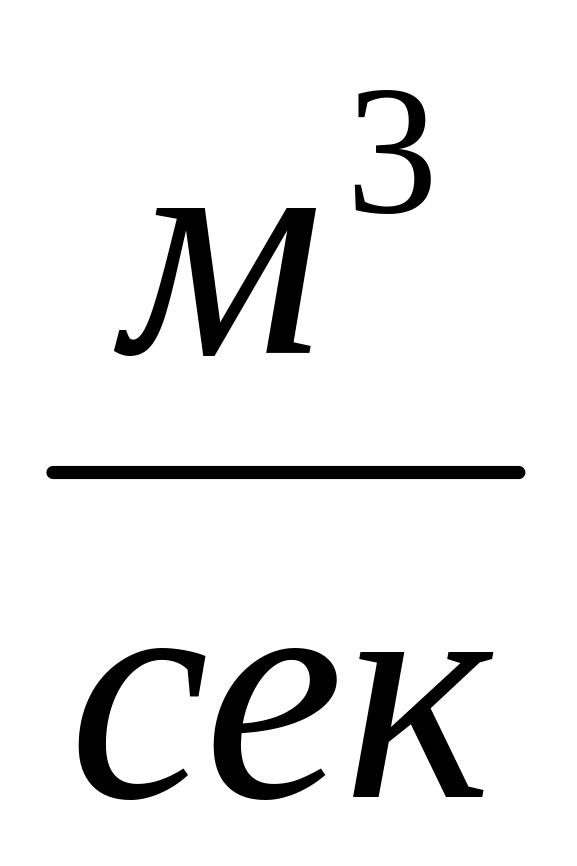 ,
,
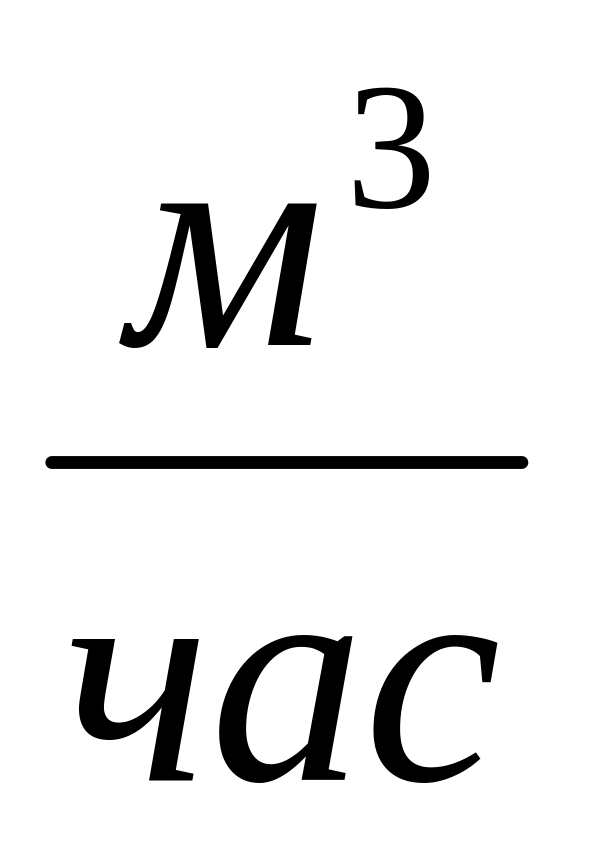 .
.Массовый расход
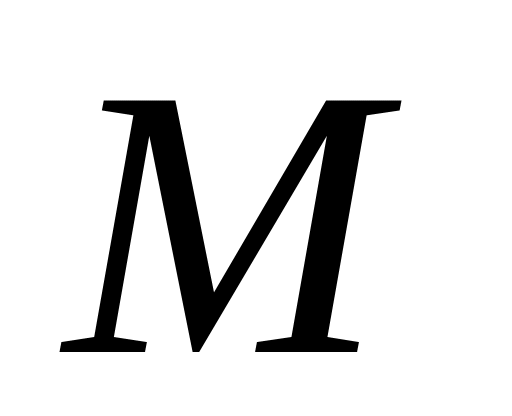 ,
,
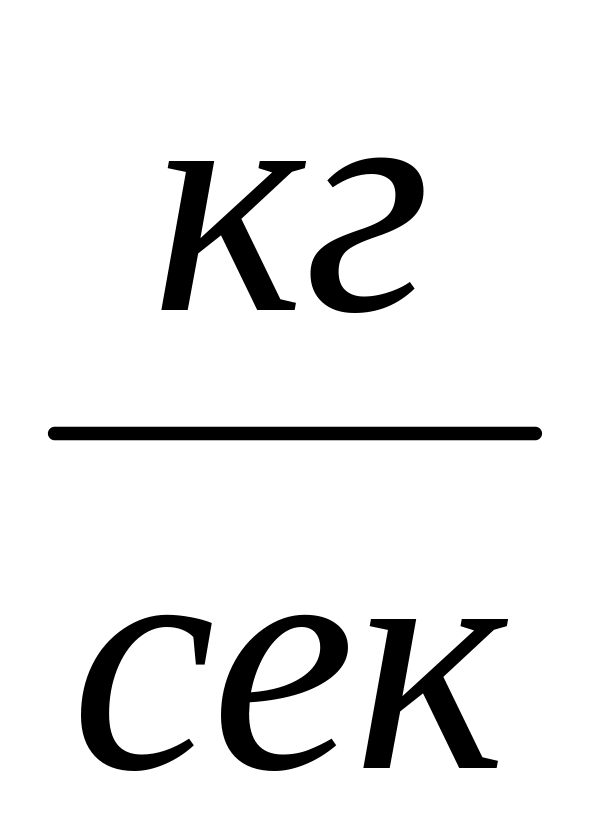 ,
,
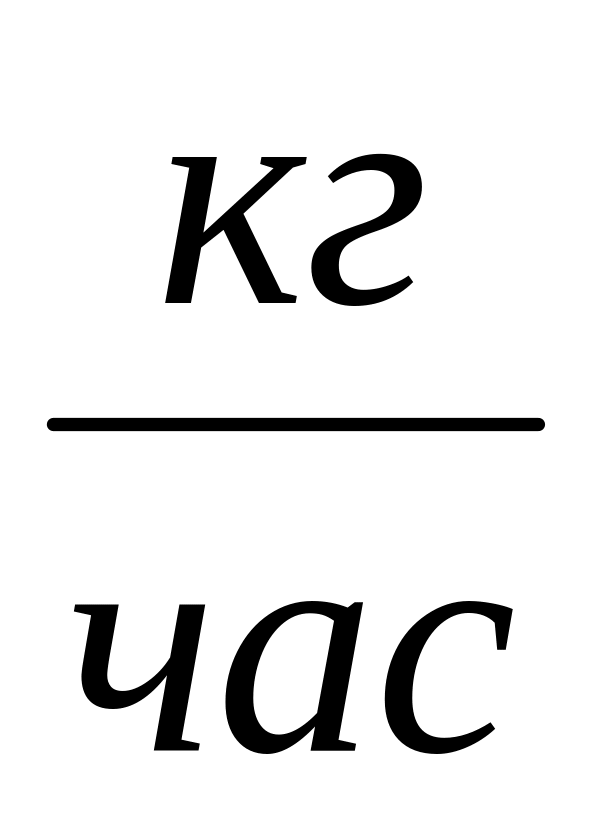 .
.Коммерческий расход
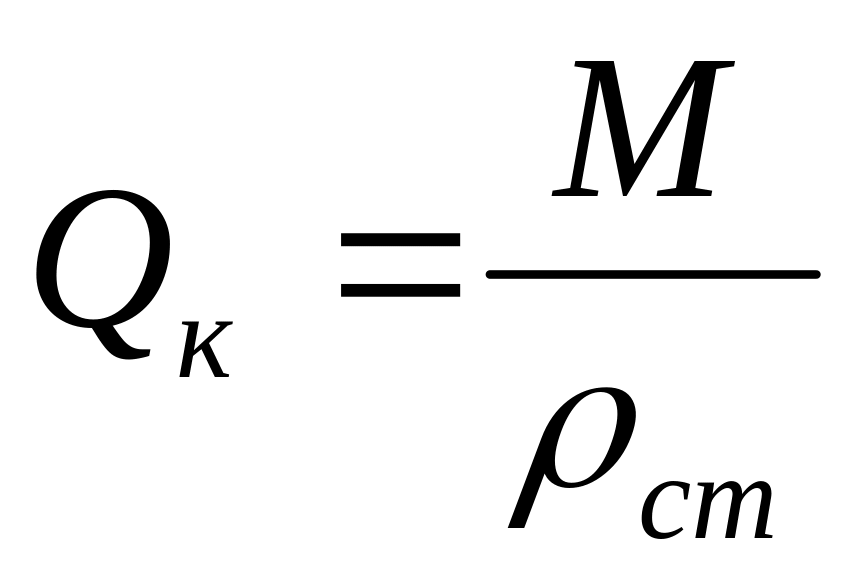 - массовый расход, приведённый к
стандартным условиям,
,
- массовый расход, приведённый к
стандартным условиям,
,
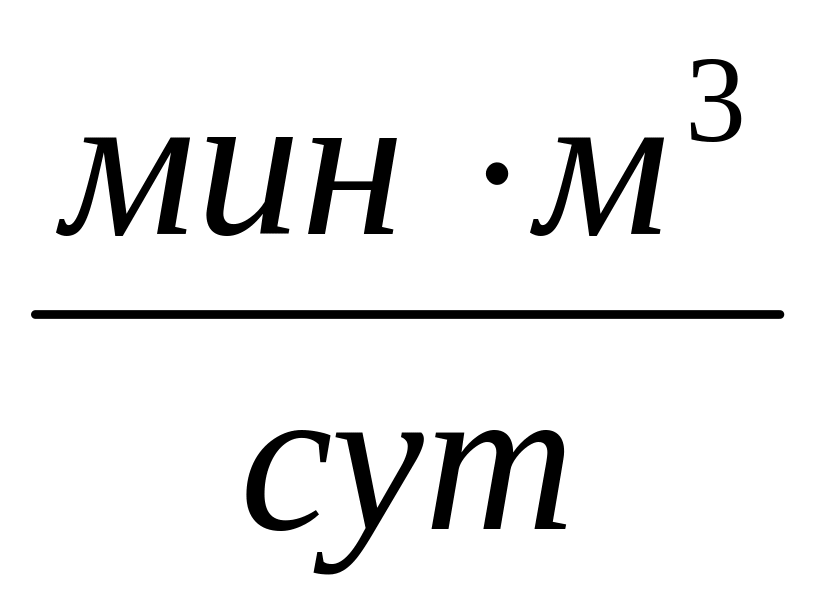 .
.
Соответственно объёмному и массовому расходу, вводят понятия линейных и массовых скоростей.
Линейная скорость
![]() ,
,
![]() .
.
Массовая скорость
![]() ,
,
![]() .
.
При движении газа по газопроводу массовый расход и скорость постоянны, а линейная скорость и объёмный расход увеличиваются вследствие снижения плотности.
Любой природный газ представляет собой газовую смесь, состоящую из 90-99 процентов метана, пропана, бутана, азота, кислорода и других газов.
Состав газовой смеси может быть выражен в объёмных, мольных или массовых долях.
Объёмная концентрация
-того
компонента определяется из соотношения:
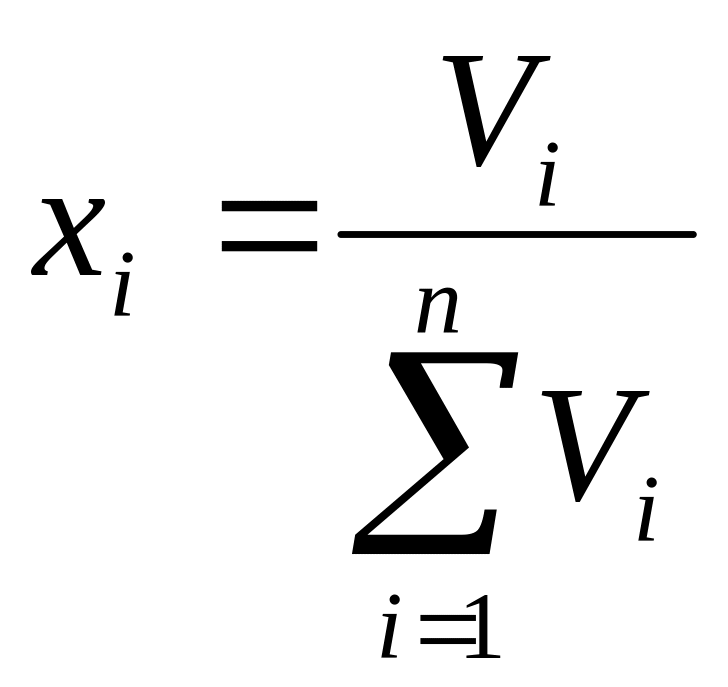 .
Мольная концентрация
-того
компонента определяется исходя из
следующей уравнения:
.
Мольная концентрация
-того
компонента определяется исходя из
следующей уравнения:
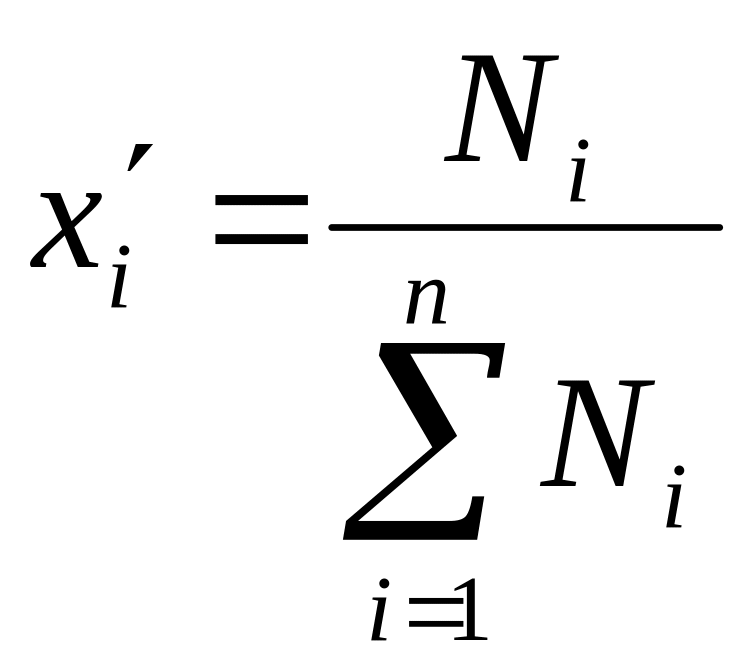 .
Массовая концентрация
-того
компонента рассчитывается по следующей
формуле:
.
Массовая концентрация
-того
компонента рассчитывается по следующей
формуле:
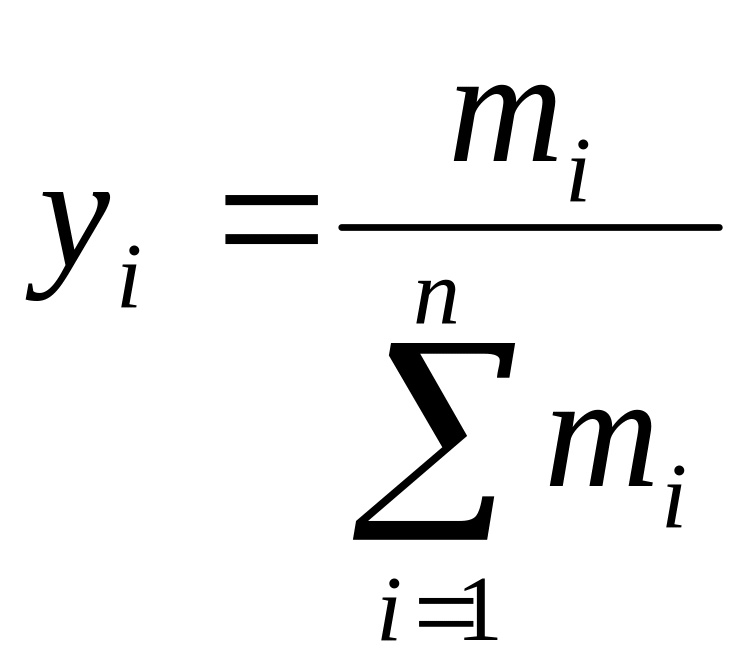 .
Молекулярную массу
-того
компонента можно определить с помощью
формулы:
.
Молекулярную массу
-того
компонента можно определить с помощью
формулы:
![]() ,
,
![]() .
Молекулярная масса всей смеси
рассчитывается следующим образом:
.
Молекулярная масса всей смеси
рассчитывается следующим образом:
![]() .
.
Уравнение состояния газа.
Уравнение состояния газа –
функциональная зависимость между
давлением
![]() ,
удельным объёмом
и температурой
,
которая существует для всех газов,
находящихся в состоянии термодинамического
равновесия, то есть
,
удельным объёмом
и температурой
,
которая существует для всех газов,
находящихся в состоянии термодинамического
равновесия, то есть
![]() .
.
Графически эта зависимость изображается семейством изотерм.
При температуре большей критической
газ всегда остаётся в газообразном
состоянии при любом давлении. При
температуре меньшей критической, при
сжатии газа, если достигается некоторого
удельного объёма
![]() начинается конденсация газа, и он
переходит в двухфазное состояние. При
достижении некоторого удельного объёма
начинается конденсация газа, и он
переходит в двухфазное состояние. При
достижении некоторого удельного объёма
![]() конденсация газа прекращается, и он
приобретает свойства жидкости.
конденсация газа прекращается, и он
приобретает свойства жидкости.
У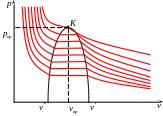 равнение
состояния идеального газа описывается
уравнением Менделеева-Клапейрона:
равнение
состояния идеального газа описывается
уравнением Менделеева-Клапейрона:
![]() ,
,
![]() или
или
![]() ,
где
,
где
![]() .
.
Газовая постоянная
![]() ,
,
![]() .
.
Для метана, имеющего молярную массу
![]() ,
газовая постоянная равна
,
газовая постоянная равна
![]() .
.
При больших давлениях и температурах
характерных для магистральных газопроводов
используются различные модели реальных
газов, который обладает явлением
сверхсжимаемости. Эти модели описываются
скорректированным уравнением
Менделеева-Клайперона:
![]() ,
где
,
где
![]() - коэффициент сверхсжимаемости, который
для реальных газов всегда меньше единицы;
- коэффициент сверхсжимаемости, который
для реальных газов всегда меньше единицы;
![]() - приведённое давление;
- приведённое давление;
![]() - приведённое давление.
- приведённое давление.
Для вычисления коэффициента сверхсжимаемости
существуют различные эмпирические
формулы, такие как
![]() .
.
Для смеси газов критическое давление
определяется по следующей формуле:
![]() ,
а критическая температура находится
следующим образом:
,
а критическая температура находится
следующим образом:
![]() .
.
Характерные параметры компонентов природного газа:
Название компонента |
|
|
|
|
|
Метан
|
16.042 |
0.717 |
518.33 |
4.641 |
190.55 |
Этан
|
30.068 |
1.356 |
276.50 |
4.913 |
305.50 |
Пропан
|
44.094 |
2.019 |
188.60 |
4.264 |
369.80 |
Азот
|
28.016 |
1.251 |
296.70 |
3.396 |
126.2 |
Сероводород
|
34.900 |
1.539 |
238.20 |
8.721 |
378.56 |
Углекислый газ
|
44.011 |
1.976 |
189.00 |
7.382 |
304.19 |
Воздух |
28.956 |
1.293 |
287.18 |
3.180 |
132.46 |
