
- •Лекция №1
- •Предмет органической химии
- •Эмпирические, молекулярные и структурные формулы. Изомерия.
- •Классификация органических веществ.
- •Важнейшие функциональные производные органических веществ
- •Номенклатура органических веществ
- •Лекция № 2
- •Виды химических связей
- •Ковалентная связь
- •Образование молекулярных орбиталей из ао (лкао мо)
- •Электронная конфигурация и гибридизация углерода в органических соединениях
- •Полярность и поляризуемость связей
- •Лекция № 3
- •Классификация органических реакций: по характеру превращения
- •По типу разрыва связи в исходной молекуле
- •Энергетические аспекты химических реакций
- •Механизмы органических реакций
- •Постулат Дж. Хэммонда
- •Лекция № 4
- •Равновесные реакции
- •Кинетический и термодинамический контроль
- •Кислотно-основные свойства органических соединений
- •Кислоты и основания по Брёнстеду-Лоури
- •Кислоты и основания по Льюису
- •Лекция № 5 Углеводороды Алканы
- •Алканы (насыщенные ациклические соединения, парафины)
- •Изомерия, номенклатура
- •Конформационная изомерия
- •Номенклатура
- •Лекция № 6 Углеводороды
- •Химические свойства алканов
- •Механизм реакции галогенирования алканов
- •Лекция № 7 Углеводороды
- •Природные источники и методы получения алканов
- •Получение алканов. Лабораторные и промышленные методы синтеза
- •Лекция № 8 Углеводороды
- •Алкены (олефины, этиленовые углеводороды)
- •Получение алкенов
- •Дегидрогалогенирование алкилгалогенидов
- •Дегидратация спиртов
- •Дегалогенирование дигалогенопроизводных
- •Парциальное (частичное) гидрирование алкинов
- •Лекция № 9 Углеводороды
- •Химические свойства алкенов
- •Присоединение галогенов
- •Присоединение галогеноводородов
- •Лекция № 10 Углеводороды
- •Радикальное присоединение к алкенам
- •Гидратация алкенов
- •Образование галогенгидринов
- •Окисление алкенов
- •Образование эпоксидов
- •Окислительное расщепление двойной связи
- •Озонолиз (реакция Гарриеса)
- •Гидроксилирование алкенов (реакция Вагнера)
- •Лекция № 11 Углеводороды
- •Реакции замещения в алкильных группах алкенов
- •Полимеризация алкенов
Полярность и поляризуемость связей
Как показано выше, ковалентная связь образуется за счет обобществления пары электронов. Ядра атомов, связанных ковалентной связью, удерживаются друг около друга за счет общей электронной пары. Чаще всего распределение электронной плотности не равномерно. У одного атома она выше, чем у другого. Один конец связи богаче электронами (более отрицательный), другой – беднее (более положительный). Такая связь называется полярной. Ковалентная связь полярна, когда она образована атомами по-разному притягивающими электроны, т.е. имеющими разную электроотрицательность. Связи, образованные атомами одного элемента, например С-С, – неполярны. Также неполярны и связи С-Н.

Рис. 8. Неполярные (а) и полярные (б) связи
Знаки + и - (дельта-плюс и дельта-минус) показывают, в каком направлении происходит сдвиг электронной плотности. Сам знак дельта означает частичный (не полный) заряд.
В некоторых случаях электроны неполярной связи могут быть распределены неравномерно под действием окружения. Такая связь называется поляризованной (рис. 9). Электронная плотность связей углерод-хлор сдвинута в сторону более электроотрицательного атома - галогена. В результате атом углерода группы -CCl3 сильно позитивирован. Электроны -связи С-С притягиваются к углероду, имеющему недостаток электронной плотности (показано изогнутой стрелкой). Это и есть поляризация связи.

Рис. 9. Поляризованная углерод-углеродная связь
Понимание того, какие связи являются неполярными, какие полярными или поляризованными чрезвычайно важно для всего курса органической химии.
Лекция № 3
Классификация органических реакций по характеру превращения, по способу разрыва связи в исходной молекуле. Электрофильные, нуклеофильные и радикальные реагенты и реакции.
Понятие о промежуточных частицах (радикалы, карбокатионы, карбанионы) и их строение. Электронные эффекты заместителей (индуктивный, мезомерный), их влияние на устойчивость промежуточных частиц. Резонансные структуры.
Факторы, определяющие возможность протекания реакций. Энергетическая кривая. Энтропийный и энтальпийный факторы, потенциал Гиббса, энергия активации, переходное состояние. Равновесные реакции, константа равновесия, кинетический и термодинамический контроль. Механизм реакции и пути его установления. Принцип микроскопической обратимости, постулат Хэммонда.
Классификация органических реакций: по характеру превращения
Бескрайнее число органических реакций может быть сведено к нескольким типам.
Реакции замещения:

Обозначают S (от англ. substitution). Х – Уходящая группа.
Реакции присоединения:
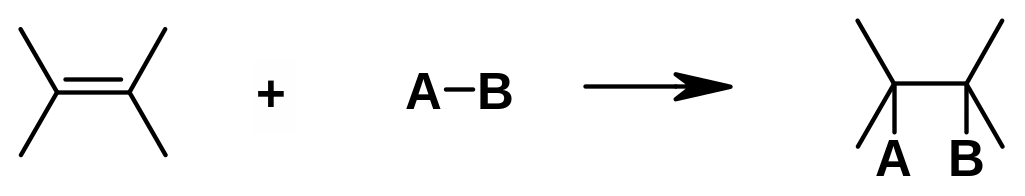
Обозначают A (от англ. addition).
Реакции отщепления (элиминирования):

Обозначают E (от англ. elimination).
Перегруппировки:
![]()
Реакции окисления и восстановления:

В органической химии под окислением понимают процесс удаления водорода с образованием новой связи между углеродом и атомом с большей электроотрицательностью, чем водород, или кратной связи. Восстановление - обратный окислению процесс.
Перициклические (согласованные) реакции: циклоприсоединение, электроциклические реакции, сигматропные перегруппировки.
