
- •Лекция №1
- •Предмет органической химии
- •Эмпирические, молекулярные и структурные формулы. Изомерия.
- •Классификация органических веществ.
- •Важнейшие функциональные производные органических веществ
- •Номенклатура органических веществ
- •Лекция № 2
- •Виды химических связей
- •Ковалентная связь
- •Образование молекулярных орбиталей из ао (лкао мо)
- •Электронная конфигурация и гибридизация углерода в органических соединениях
- •Полярность и поляризуемость связей
- •Лекция № 3
- •Классификация органических реакций: по характеру превращения
- •По типу разрыва связи в исходной молекуле
- •Энергетические аспекты химических реакций
- •Механизмы органических реакций
- •Постулат Дж. Хэммонда
- •Лекция № 4
- •Равновесные реакции
- •Кинетический и термодинамический контроль
- •Кислотно-основные свойства органических соединений
- •Кислоты и основания по Брёнстеду-Лоури
- •Кислоты и основания по Льюису
- •Лекция № 5 Углеводороды Алканы
- •Алканы (насыщенные ациклические соединения, парафины)
- •Изомерия, номенклатура
- •Конформационная изомерия
- •Номенклатура
- •Лекция № 6 Углеводороды
- •Химические свойства алканов
- •Механизм реакции галогенирования алканов
- •Лекция № 7 Углеводороды
- •Природные источники и методы получения алканов
- •Получение алканов. Лабораторные и промышленные методы синтеза
- •Лекция № 8 Углеводороды
- •Алкены (олефины, этиленовые углеводороды)
- •Получение алкенов
- •Дегидрогалогенирование алкилгалогенидов
- •Дегидратация спиртов
- •Дегалогенирование дигалогенопроизводных
- •Парциальное (частичное) гидрирование алкинов
- •Лекция № 9 Углеводороды
- •Химические свойства алкенов
- •Присоединение галогенов
- •Присоединение галогеноводородов
- •Лекция № 10 Углеводороды
- •Радикальное присоединение к алкенам
- •Гидратация алкенов
- •Образование галогенгидринов
- •Окисление алкенов
- •Образование эпоксидов
- •Окислительное расщепление двойной связи
- •Озонолиз (реакция Гарриеса)
- •Гидроксилирование алкенов (реакция Вагнера)
- •Лекция № 11 Углеводороды
- •Реакции замещения в алкильных группах алкенов
- •Полимеризация алкенов
Номенклатура органических веществ
Это система, описывающая строение и пространственное расположение атомов в молекуле.
Систематическое название – составленное в полном соответствии с принятыми номенклатурными правилами. В настоящее время наиболее распространенная и универсальная номенклатура IUPAC (International Union of Pure and Applied Chemistry).
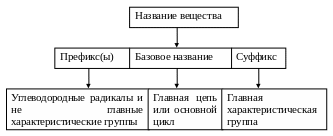
Базовое название – часть, на которой строится название в целом.
Заместитель – атом или функциональная группа, располагающаяся в исходном соединении вместо водорода.
Характеристическая группа – функциональная группа.
Главная группа – та, наличие которой указывает суффикс. Старшинство главных групп убывает в следующем ряду:
карбоновые кислоты > сульфоновые кислоты > сложные эфиры > амиды > нитрилы > альдегиды > кетоны > спирты и фенолы > тиолы > амины > имины
Локант – цифра или буква, которая указывает положение функциональной группы в молекуле.
Число одинаковых заместителей в молекуле указывают приставками ди-, три- и т.д. – умножающими префиксами.
Чтобы назвать вещество, необходимо выполнить следующую последовательность действий:
Определить главную характеристическую группу (ряд старшинства см. выше).
Определить базовую структуру – найти главную углеродную цепь или цикл. Базовая структура должна соответствовать следующим требованиям:
включать максимальное число главных групп
наибольшее количество кратных связей
состоять из максимального числа углеродных атомов
иметь наибольшее число заместителей
Назвать базовую структуру с учетом главной группы.
Определить и назвать заместители.
Пронумеровать атомы углерода базовой структуры так, чтобы главная группа получила наименьший номер. Если однозначный выбор сделать не удается, используют правило наименьших локантов. Базовую структуру нумеруют таким образом, чтобы заместители имели наименьшие номера. Из возможных последовательностей локантов правильная та, в которой раньше встретится меньшая цифра (1,3,6- меньше, чем 1,4,5-);
Объединить сделанное выше, создав полное название, перечисляя префиксы в алфавитном порядке.
Пример:

Номенклатура IUPAC конкретных классов органических веществ будет подробно рассмотрена в соответствующих разделах курса.
Лекция № 2
Виды связей в органических соединениях. Волновое уравнение, волновая функция, атомные орбитали и их типы. Природа ковалентных связей. Типы молекулярных орбиталей.
Электронная конфигурация и гибридизация углерода в органических соединениях. - и -Связи в органических соединениях, их характеристики: энергия, длина, полярность, поляризуемость.
Виды химических связей
Известно несколько видов химических связей: ионная, ковалентная, металлическая, водородная. Органические соединения образованы почти исключительно за счет ковалентных связей.
Движение электрона в зависимости от его энергии описывается уравнением Э. Шрёдингера (1926 г.) (1)
-h2 |
|
|
∂2ψ |
+ |
∂2ψ |
+ |
∂2ψ |
|
+ |
U ψ |
= |
E ψ |
(1) |
82m |
|
|
∂x2 |
∂y2 |
∂z2 |
|
где: m – масса электрона; h – постоянная Планка; U – потенциальная энергия системы; Е – полная энергия системы; x,y,z – координаты; ψ – волновая функция.
Решение уравнения Шрёдингера дает области, в которых может находиться электрон во время своего движения в атоме. Квадрат модуля волновой функции |ψ|2 - вероятность нахождения электрона в объеме пространства. Объем, в котором вероятность нахождения электрона 95%, называется орбиталью.
Формы и расположение s-, p- и d-орбиталей известны из курса общей химии.
