
- •Лекция №1
- •Предмет органической химии
- •Эмпирические, молекулярные и структурные формулы. Изомерия.
- •Классификация органических веществ.
- •Важнейшие функциональные производные органических веществ
- •Номенклатура органических веществ
- •Лекция № 2
- •Виды химических связей
- •Ковалентная связь
- •Образование молекулярных орбиталей из ао (лкао мо)
- •Электронная конфигурация и гибридизация углерода в органических соединениях
- •Полярность и поляризуемость связей
- •Лекция № 3
- •Классификация органических реакций: по характеру превращения
- •По типу разрыва связи в исходной молекуле
- •Энергетические аспекты химических реакций
- •Механизмы органических реакций
- •Постулат Дж. Хэммонда
- •Лекция № 4
- •Равновесные реакции
- •Кинетический и термодинамический контроль
- •Кислотно-основные свойства органических соединений
- •Кислоты и основания по Брёнстеду-Лоури
- •Кислоты и основания по Льюису
- •Лекция № 5 Углеводороды Алканы
- •Алканы (насыщенные ациклические соединения, парафины)
- •Изомерия, номенклатура
- •Конформационная изомерия
- •Номенклатура
- •Лекция № 6 Углеводороды
- •Химические свойства алканов
- •Механизм реакции галогенирования алканов
- •Лекция № 7 Углеводороды
- •Природные источники и методы получения алканов
- •Получение алканов. Лабораторные и промышленные методы синтеза
- •Лекция № 8 Углеводороды
- •Алкены (олефины, этиленовые углеводороды)
- •Получение алкенов
- •Дегидрогалогенирование алкилгалогенидов
- •Дегидратация спиртов
- •Дегалогенирование дигалогенопроизводных
- •Парциальное (частичное) гидрирование алкинов
- •Лекция № 9 Углеводороды
- •Химические свойства алкенов
- •Присоединение галогенов
- •Присоединение галогеноводородов
- •Лекция № 10 Углеводороды
- •Радикальное присоединение к алкенам
- •Гидратация алкенов
- •Образование галогенгидринов
- •Окисление алкенов
- •Образование эпоксидов
- •Окислительное расщепление двойной связи
- •Озонолиз (реакция Гарриеса)
- •Гидроксилирование алкенов (реакция Вагнера)
- •Лекция № 11 Углеводороды
- •Реакции замещения в алкильных группах алкенов
- •Полимеризация алкенов
Окисление алкенов
Под термином «окисление алкенов» подразумевают реакции, в которых происходит разрыв только - или - и -связей этиленового фрагмента. Более глубокое окисление, затрагивающее алкильные заместители в этом разделе не рассматривается.
В зависимости от строения алкена, природы окислителя и условий проведения реакции могут образовываться эпоксиды, 1,2-диолы, альдегиды, кетоны, карбоновые кислоты и углекислый газ. Некоторые реакции окисления могут быть использованы для определения положения двойной углерод-углеродной связи.
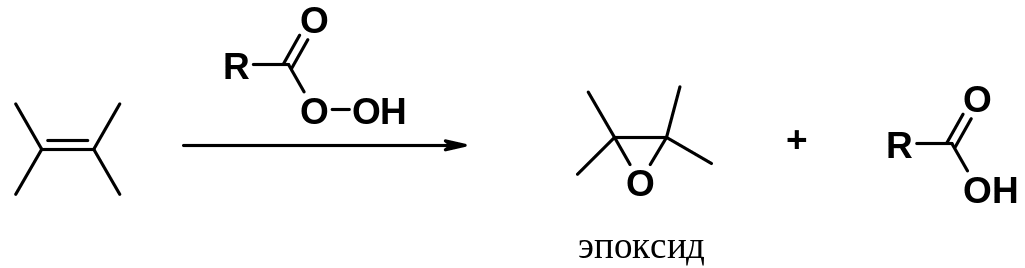
Образование эпоксидов
Эпоксисоединения (оксираны или органические оксиды) в лаборатории получают действием на алкены пероксикислот (реакция Прилежаева).
В промышленности получают в больших количествах эпоксиэтилен (этиленоксид) окислением этилена кислородом воздуха в присутствии серебряного катализатора.
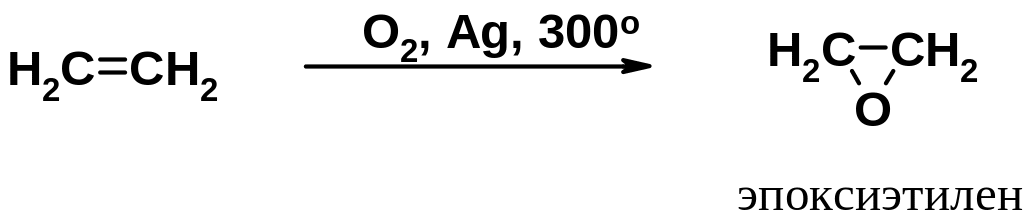
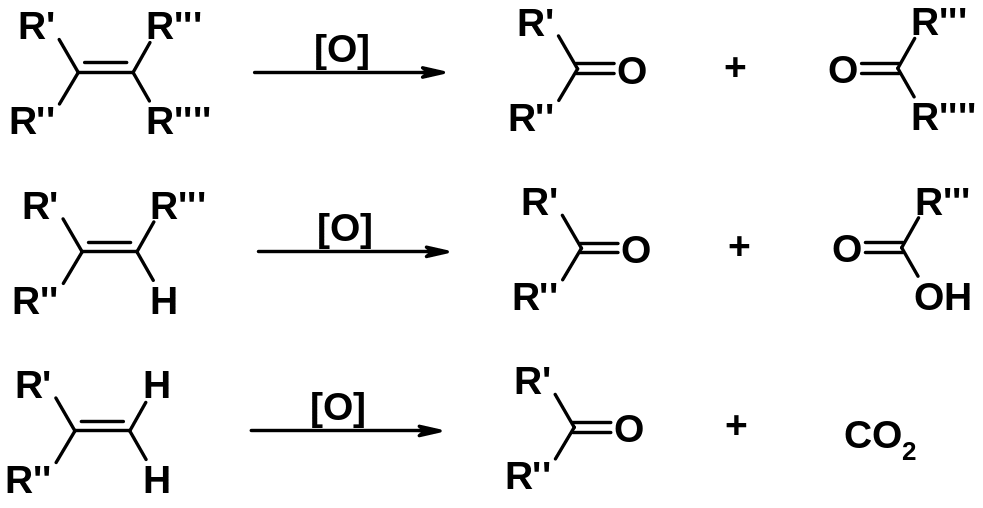
Окислительное расщепление двойной связи
Сильные окислители (перманганат калия, дихромат калия, оксид хрома и др.) при нагревании легко расщепляют молекулу алкена по двойной связи. В зависимости от строения алкена результатом могут быть карбоновые кислоты и/или кетоны. Алкены с терминальной двойной связью выделяют также и СО2.
Озонолиз (реакция Гарриеса)
Алкены даже при пониженных температурах легко окисляются озоном с расщепление и - и -связи алкенового фрагмента. Озон пропускают через раствор алкена в инертном растворителе, после упаривания которого остается вязкое масло – озонид.
 Обычно
озониды не выделяют из-за их высокой
взрывоопасности. Их разлагают водой в
присутствии восстанавливающего реагента
(цинковой пыли), чтобы предотвратить
окисление альдегидов в карбоновые
кислоты. В результате образуются
карбонильные соединения (альдегиды и
кетоны), в которых атомы кислорода
связаны двойными связями с теми атомами
углерода, которые в исходном алкене
были соединены двойной углерод-углеродной
связью.
Обычно
озониды не выделяют из-за их высокой
взрывоопасности. Их разлагают водой в
присутствии восстанавливающего реагента
(цинковой пыли), чтобы предотвратить
окисление альдегидов в карбоновые
кислоты. В результате образуются
карбонильные соединения (альдегиды и
кетоны), в которых атомы кислорода
связаны двойными связями с теми атомами
углерода, которые в исходном алкене
были соединены двойной углерод-углеродной
связью.
Карбонильные соединения легко могут быть идентифицированы физико-химическими методами, поэтому реакция Гарриеса часто используется для определения положения двойной связи в углеродной цепи. Ниже приведены результаты реакций озонолиза трех изомерных гептенов.
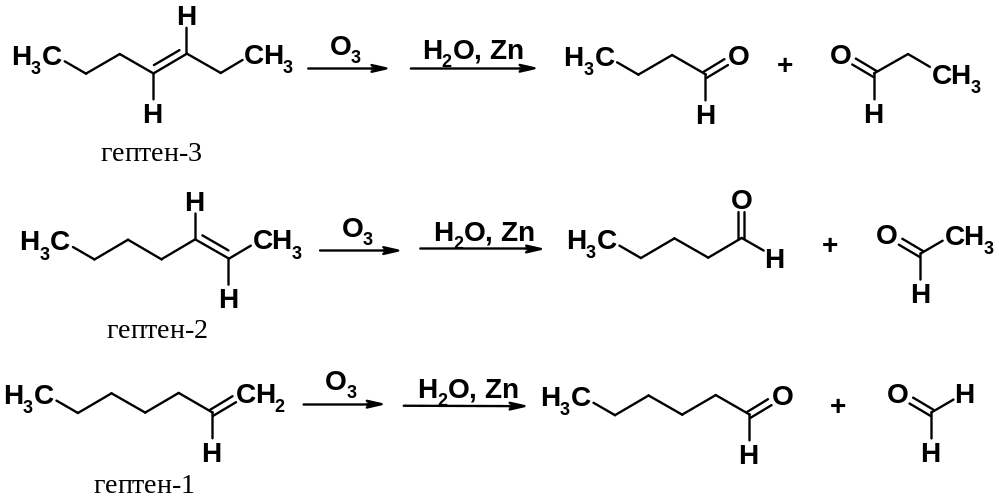
Строение продуктов озонолиза однозначно указывает на положение двойной углерод-углеродной связи в молекулах анализируемых алкенов. При озонолизе веществ со вторичными углеродами при кратной связи в результате образуются кетоны, с первичными – альдегиды, с концевой двойной связью – углекислый газ.
Гидроксилирование алкенов (реакция Вагнера)
Русский химик Е.Е. Вагнер в 1898 г. открыл реакцию окисления алкенов до гликолей. Гликолями называют двухатомные спирты с вицинальным расположением гидроксильных групп. Окисление проходит при комнатной температуре в нейтральном или слабощелочном растворе перманганата калия.

Реакция легко контролируется визуально, поскольку при образовании гликоля исчезает розовая окраска перманганата и образуется осадок оксида марганца. Поэтому реакция Вагнера может быть использована как качественная реакция на наличие в молекуле кратной связи. Гидроксилирование под действием перманганат-иона протекает стереоселективно и приводит к син-присоединению двух гидроксильных групп. Аналогично протекает гидроксилирование при окислении оксидом осмия OsO4.
Реакция Вагнера - наиболее простой метод получения 1,2-диолов и именно его следует применять при решении задач.
