
- •Лекция №1
- •Предмет органической химии
- •Эмпирические, молекулярные и структурные формулы. Изомерия.
- •Классификация органических веществ.
- •Важнейшие функциональные производные органических веществ
- •Номенклатура органических веществ
- •Лекция № 2
- •Виды химических связей
- •Ковалентная связь
- •Образование молекулярных орбиталей из ао (лкао мо)
- •Электронная конфигурация и гибридизация углерода в органических соединениях
- •Полярность и поляризуемость связей
- •Лекция № 3
- •Классификация органических реакций: по характеру превращения
- •По типу разрыва связи в исходной молекуле
- •Энергетические аспекты химических реакций
- •Механизмы органических реакций
- •Постулат Дж. Хэммонда
- •Лекция № 4
- •Равновесные реакции
- •Кинетический и термодинамический контроль
- •Кислотно-основные свойства органических соединений
- •Кислоты и основания по Брёнстеду-Лоури
- •Кислоты и основания по Льюису
- •Лекция № 5 Углеводороды Алканы
- •Алканы (насыщенные ациклические соединения, парафины)
- •Изомерия, номенклатура
- •Конформационная изомерия
- •Номенклатура
- •Лекция № 6 Углеводороды
- •Химические свойства алканов
- •Механизм реакции галогенирования алканов
- •Лекция № 7 Углеводороды
- •Природные источники и методы получения алканов
- •Получение алканов. Лабораторные и промышленные методы синтеза
- •Лекция № 8 Углеводороды
- •Алкены (олефины, этиленовые углеводороды)
- •Получение алкенов
- •Дегидрогалогенирование алкилгалогенидов
- •Дегидратация спиртов
- •Дегалогенирование дигалогенопроизводных
- •Парциальное (частичное) гидрирование алкинов
- •Лекция № 9 Углеводороды
- •Химические свойства алкенов
- •Присоединение галогенов
- •Присоединение галогеноводородов
- •Лекция № 10 Углеводороды
- •Радикальное присоединение к алкенам
- •Гидратация алкенов
- •Образование галогенгидринов
- •Окисление алкенов
- •Образование эпоксидов
- •Окислительное расщепление двойной связи
- •Озонолиз (реакция Гарриеса)
- •Гидроксилирование алкенов (реакция Вагнера)
- •Лекция № 11 Углеводороды
- •Реакции замещения в алкильных группах алкенов
- •Полимеризация алкенов
Лекция № 10 Углеводороды
Алкены. Реакции радикального присоединения - реакции против «правила Марковникова». Каталитическое гидрирование алкенов. Окисление: реакция гидроксилирования, образование оксиранов, озонолиз, окислительное расщепление двойной связи.
Радикальное присоединение к алкенам
Присоединение HCl и HI к алкенам всегда протекает в соответствии с правилом Марковникова (в современном понимании). Присоединение же бромистого водорода может протекать как по Марковникову, так и против этого правила. Объяснение этому факту дали в 1933 г. М. Хараш и Ф. Майо, которые установили, что направление присоединения зависит от механизма реакции. В условиях электрофильного присоединения реакция всегда протекает через образование наиболее устойчивого карбокатиона (в соответствии с правилом Марковникова). Наличие в реакционной смеси пероксидов или веществ, способных в условиях превращения генерировать свободные радикалы, приводит к изменению механизма реакции и она проходит как цепное радикальное присоединение (АR). В качестве инициаторов чаще всего используют органические перекиси.
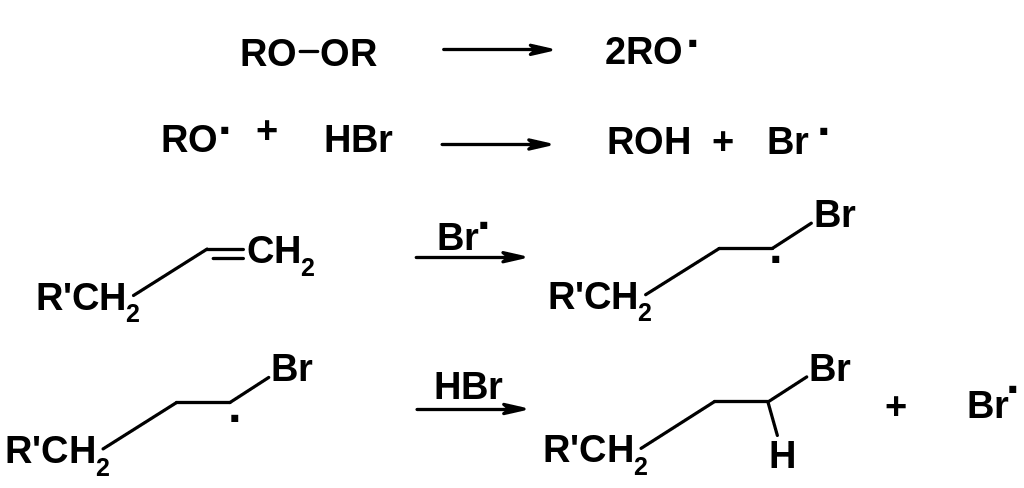
Пероксидная связь подвергается гомолитическому расщеплению при незначительном нагревании в темноте или при комнатной температуре на свету. Взаимодействие свободных радикалов с бромистым водородом приводит к образованию свободных атомов брома, атакующих алкен с образованием алкильного радикала, который в свою очередь реагирует с молекулой бромистого водорода, образуя галогенопроизводное и свободный атом брома, ведущий цепь дальше. Промежуточная частица в этой реакции свободный алкильный радикал. Реакция будет протекать через образование наиболее стабильного алкильного радикала. Как было показано ранее (см. раздел алканы), устойчивость алкильных радикалов растет в ряду метильный < первичный < вторичный < третичный.
Учитывая изменение механизма присоединения бромоводорода к алкенам в присутствии перекисей не вызывает удивления изменение региоориентации в рассматриваемой реакции.
Гидратация алкенов
Присоединение воды к алкенам происходит в присутствии разбавленных минеральных кислот (H2SO4, H3PO4) или действием Al2O3 при 400о, приводя к спиртам.

На первой стадии происходит атака электрофильной частицей (протоном минеральной кислоты) электронов -связи, приводящая к образованию -комплекса I. Это медленная стадия реакции, определяющая ход процесса в целом. Карбокатион I взаимодействует с нуклеофильной частицей, в роли которой выступает молекула воды, предоставляющая одну из своих электронных пар для образования С-О связи. На заключительной стадии оксониевый катион II теряет протон, образуя спирт III.
Как было показано выше, региоориентация присоединения определяется стабильностью промежуточно образующегося карбокатиона и не зависит от природы нуклеофильной частицы. Поэтому гидратация несимметричных алкенов всегда приводит к получению вторичных или третичных спиртов. Единственным исключением является присоединение воды к этилену, в результате которого образуется первичный спирт этанол.
Образование галогенгидринов
Галогенгидринами называют соединения, содержащие вицинально расположенные гидроксильную группу и атом галогена. Их получают реакцией алкенов с водными растворами хлора или брома.
Региоориентация присоединения легко объясняется исходя из предложенного выше механизма электрофильного присоединения. Первая стадия реакции – присоединение галогена - происходит таким образом, что образуется наиболее устойчивый карбокатион.
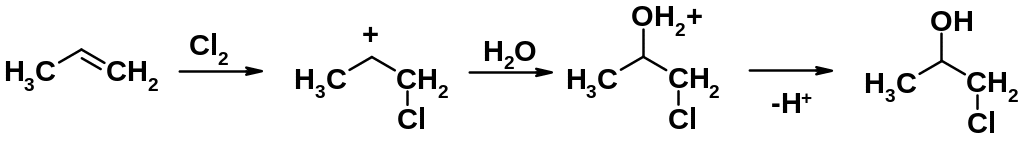
Иногда эту реакцию формально рассматривают как присоединение хлорноватистой или бромноватистой кислот к алкенам. Однако существует большое количество экспериментальных фактов, указывающих на то, что галогенгидрины образуются в результате взаимодействия алкенов с галогеном и водой.
