
- •Лекция №1
- •Предмет органической химии
- •Эмпирические, молекулярные и структурные формулы. Изомерия.
- •Классификация органических веществ.
- •Важнейшие функциональные производные органических веществ
- •Номенклатура органических веществ
- •Лекция № 2
- •Виды химических связей
- •Ковалентная связь
- •Образование молекулярных орбиталей из ао (лкао мо)
- •Электронная конфигурация и гибридизация углерода в органических соединениях
- •Полярность и поляризуемость связей
- •Лекция № 3
- •Классификация органических реакций: по характеру превращения
- •По типу разрыва связи в исходной молекуле
- •Энергетические аспекты химических реакций
- •Механизмы органических реакций
- •Постулат Дж. Хэммонда
- •Лекция № 4
- •Равновесные реакции
- •Кинетический и термодинамический контроль
- •Кислотно-основные свойства органических соединений
- •Кислоты и основания по Брёнстеду-Лоури
- •Кислоты и основания по Льюису
- •Лекция № 5 Углеводороды Алканы
- •Алканы (насыщенные ациклические соединения, парафины)
- •Изомерия, номенклатура
- •Конформационная изомерия
- •Номенклатура
- •Лекция № 6 Углеводороды
- •Химические свойства алканов
- •Механизм реакции галогенирования алканов
- •Лекция № 7 Углеводороды
- •Природные источники и методы получения алканов
- •Получение алканов. Лабораторные и промышленные методы синтеза
- •Лекция № 8 Углеводороды
- •Алкены (олефины, этиленовые углеводороды)
- •Получение алкенов
- •Дегидрогалогенирование алкилгалогенидов
- •Дегидратация спиртов
- •Дегалогенирование дигалогенопроизводных
- •Парциальное (частичное) гидрирование алкинов
- •Лекция № 9 Углеводороды
- •Химические свойства алкенов
- •Присоединение галогенов
- •Присоединение галогеноводородов
- •Лекция № 10 Углеводороды
- •Радикальное присоединение к алкенам
- •Гидратация алкенов
- •Образование галогенгидринов
- •Окисление алкенов
- •Образование эпоксидов
- •Окислительное расщепление двойной связи
- •Озонолиз (реакция Гарриеса)
- •Гидроксилирование алкенов (реакция Вагнера)
- •Лекция № 11 Углеводороды
- •Реакции замещения в алкильных группах алкенов
- •Полимеризация алкенов
Лекция № 9 Углеводороды
Алкены. Химические свойства. Реакции электрофильного присоединения галогенов, галогеноводородов, кислот (H2SO4 и HClO), воды, гидроборирование. Правило Марковникова, его современная трактовка на основе представления о механизме реакции и относительной стабильности карбониевых ионов. Стереоспецифичность электрофильного присоединения.
Химические свойства алкенов
Характерной особенностью алкенов, определяющей их химические свойства, является наличие двойной углерод-углеродной связи, которая является комбинацией - и -связей. Энергия -связи (60 ккал/моль) меньше, чем -связи (85 ккал/моль). Типичными для двойной связи являются реакции присоединения, при которых происходит разрыв -связи с образованием двух -связей:

При этом из двух или большего числа простых молекул образуется одно более сложное соединение.
-Электроны двойной связи находятся над и под плоскостью, в которой расположены атомы этиленового фрагмента (см. рис. 6 лекция 2). Они могут быть относительно легко атакованы реагентами, имеющими недостаток электронной плотности (электрофилами). Сами алкены выступают в роли донора пары электронов. Таким образом, типичными реакциями алкенов являются реакции электрофильного присоединения (AE). Кроме того, алкены легко вступают в реакции присоединения с участием свободных радикалов (AR).
Не следует забывать, что кроме фрагмента двойной связи все алкены (исключение - этилен) содержат и алкильные группы, которые способны участвовать и реакциях замещения, описанных в разделе алканы.
Присоединение водорода (гидрирование)
Присоединение молекулы водорода по двойной связи - экзотермическая реакция, протекающая в отсутствие катализатора даже при повышенной температуре с низкой скоростью. В присутствии гетерогенного катализатора, роль которого заключается в понижении энергии активации, реакция способна протекать уже при комнатной температуре.
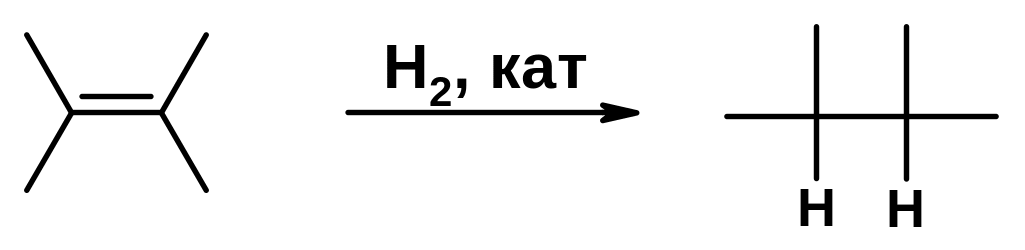
Используют платиновые, палладиевые или никелевые катализаторы. В промышленности чаще используют более дешевый никель.
Присоединение галогенов
Классическая качественная реакция на присутствие в молекуле двойной связи - обесцвечивание бромной воды или раствора брома в инертном растворителе при пропускании через него газообразного алкена.
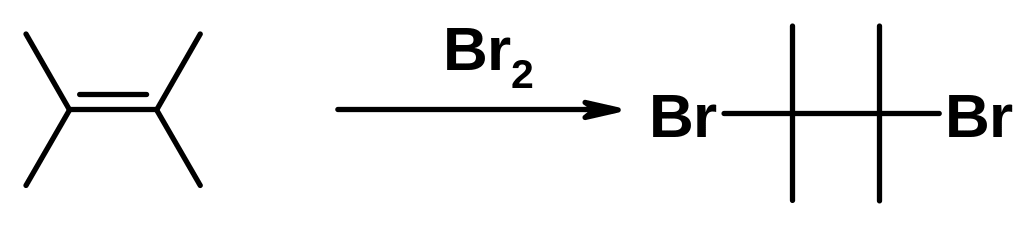
Механизм реакции присоединения брома к алкенам
Известные экспериментальные факты.
При проведении реакции в инертном растворителе (например, в тетрахлорметане) в результате реакции образуется исключительно 1,2-дибромэтан.
Если реакция проводится в бромной воде, образуются 1,2-дибромэтан, 2-бромэтанол и бромистый водород.
Если в растворе наряду с бромом содержится хлорид натрия, то в продуктах реакции фиксируется 1-бром-2-хлорэтан. Причем сам NaCl не реагирует с этиленом ни в каких условиях.
Если образуется соединение, в котором отсутствует вращение относительно углерод-углеродной связи, атомы галогена в нем занимают транс-положение.
Когда молекула галогена подходит к молекуле алкена, -электроны последнего поляризуют связь в молекуле брома с образованием так называемого -комплекса:
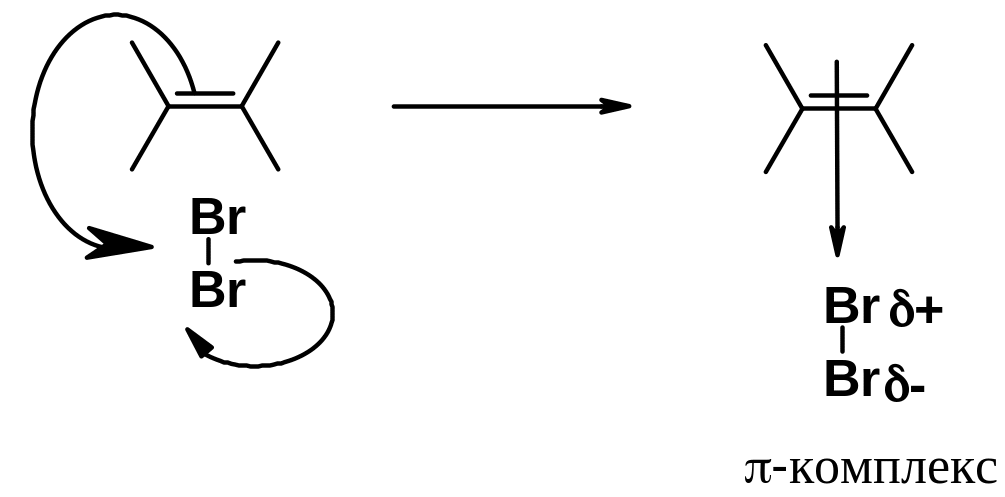
-Электроны алкена все более сдвигаются к частично позитивированному атому брома, пока полностью не образуют с ним -связь. В результате образуется карбокатион. Затем происходит перекрывание свободной пары электронов брома со свободной орбиталью карбокатионного центра. Образуются положительно заряженный бромониевый катион и анион брома. Это самая медленная стадия реакции.

Образовавшийся катион быстро подвергается атаке анионом брома, причем образование связи C-Br происходит с противоположной стороны от Br+.

Присутствие в продуктах реакции бромэтанола и бромхлорэтана объясняет тем, что нуклеофильные реагенты, имеющиеся в реакционной смеси (вода, хлорид-анион), наряду с анионом брома вступают в конкурирующую реакцию с бромониевым катионом.
Транс-ориентацию заместителей в продуктах присоединения объясняет последняя стадия, в ходе которой нуклеофил атакует бромониевый катион с противоположной стороны от атома, несущего заряд.
По аналогичному механизму протекают все реакции электрофильного присоединения (AE). Если электрофил способен образовывать ониевый катион, считается, что реакция идет через циклический ониевый катион (не во всех случаях доказано). Если электрофил не может образовывать две связи (например, протон) – реакция идет через карбокатион.
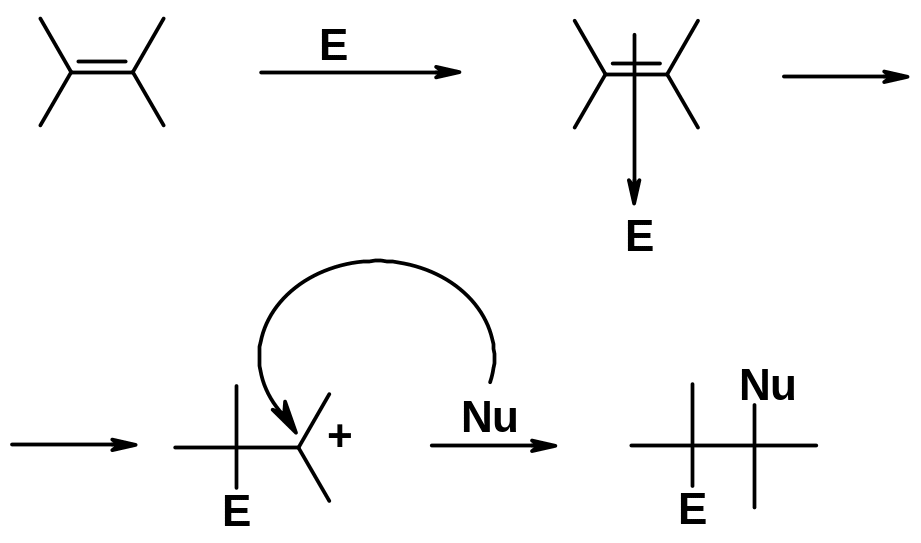
Первая стадия реакции всегда - атака электрофильной частицы на электроны -связи с образованием катиона, который быстро присоединяет нуклеофил.
