
- •Лекция №1
- •Предмет органической химии
- •Эмпирические, молекулярные и структурные формулы. Изомерия.
- •Классификация органических веществ.
- •Важнейшие функциональные производные органических веществ
- •Номенклатура органических веществ
- •Лекция № 2
- •Виды химических связей
- •Ковалентная связь
- •Образование молекулярных орбиталей из ао (лкао мо)
- •Электронная конфигурация и гибридизация углерода в органических соединениях
- •Полярность и поляризуемость связей
- •Лекция № 3
- •Классификация органических реакций: по характеру превращения
- •По типу разрыва связи в исходной молекуле
- •Энергетические аспекты химических реакций
- •Механизмы органических реакций
- •Постулат Дж. Хэммонда
- •Лекция № 4
- •Равновесные реакции
- •Кинетический и термодинамический контроль
- •Кислотно-основные свойства органических соединений
- •Кислоты и основания по Брёнстеду-Лоури
- •Кислоты и основания по Льюису
- •Лекция № 5 Углеводороды Алканы
- •Алканы (насыщенные ациклические соединения, парафины)
- •Изомерия, номенклатура
- •Конформационная изомерия
- •Номенклатура
- •Лекция № 6 Углеводороды
- •Химические свойства алканов
- •Механизм реакции галогенирования алканов
- •Лекция № 7 Углеводороды
- •Природные источники и методы получения алканов
- •Получение алканов. Лабораторные и промышленные методы синтеза
- •Лекция № 8 Углеводороды
- •Алкены (олефины, этиленовые углеводороды)
- •Получение алкенов
- •Дегидрогалогенирование алкилгалогенидов
- •Дегидратация спиртов
- •Дегалогенирование дигалогенопроизводных
- •Парциальное (частичное) гидрирование алкинов
- •Лекция № 9 Углеводороды
- •Химические свойства алкенов
- •Присоединение галогенов
- •Присоединение галогеноводородов
- •Лекция № 10 Углеводороды
- •Радикальное присоединение к алкенам
- •Гидратация алкенов
- •Образование галогенгидринов
- •Окисление алкенов
- •Образование эпоксидов
- •Окислительное расщепление двойной связи
- •Озонолиз (реакция Гарриеса)
- •Гидроксилирование алкенов (реакция Вагнера)
- •Лекция № 11 Углеводороды
- •Реакции замещения в алкильных группах алкенов
- •Полимеризация алкенов
Лекция № 8 Углеводороды
Алкены. Гомологический ряд, номенклатура, виды изомерии. Геометрическая изомерия в ряду алкенов. Цис- и транс-изомеры, E,Z-номенклатура. Причины отсутствия свободного вращения относительно двойной связи. Физические свойства, закономерности их изменения в гомологическом ряду и спектральные характеристики алкенов.
Методы получения: дегидрирование алканов, крекинг нефти, частичное гидрирование алкинов, дегалогенирование, дегидрогалогенирование галогеналканов и дегидратация спиртов (правило Зайцева).
Алкены (олефины, этиленовые углеводороды)
Алкены - открытоцепные углеводороды, отвечающие общей формуле CnH2n.и содержащие в молекуле одну двойную связь (-связь).
По сравнению с алканами соответствующие этиленовые углеводороды образуют большее число изомеров, что связано не только с различиями в углеродных скелетах, но также с расположением двойной связи и геометрией молекулы.
Рассмотрим изомерию алкенов с четырьмя атомами углерода. Кроме структурных изомеров есть изомеры положения двойной связи (бутен-1 и бутен-2). Бутен-2 может существовать в виде двух изомеров, отличающихся пространственным расположением заместителей относительно двойной связи. Поскольку свободное вращение относительно -связи невозможно (барьер 60 ккал) и весь фрагмент молекулы лежит в одной плоскости, метильные группы могут располагаться либо с одной стороны от двойной связи, либо с противоположных сторон. В названии первых используют приставку цис- (с одной стороны – лат.), вторых – транс- (через – лат.). Такой вид пространственной изомерии называется геометрической.
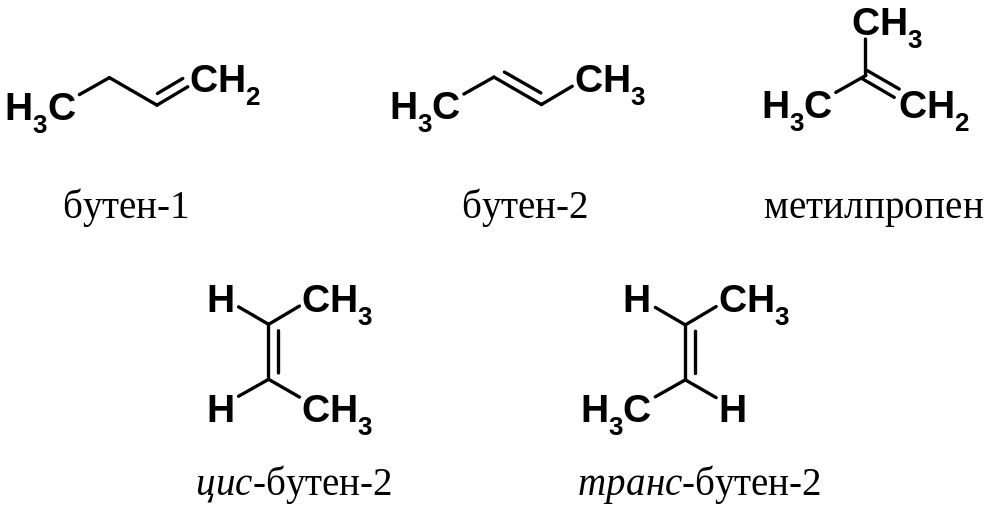
Использование цис- и транс- номенклатуры позволяет однозначно описать строение лишь тогда, когда этиленовым фрагментом связаны два типа одинаковых заместителей (в примере - СН3 и Н). Если при двойной связи более двух заместителей, то используют так называемую Е, Z-номенклатуру (от нем. Entgegen – напротив и Zusammen – вместе). В этом случае определяют взаимное расположение двух старших из имеющихся заместителей у разных углеродов двойной связи, причем старшими считаются заместители, имеющие большую молекулярную массу.
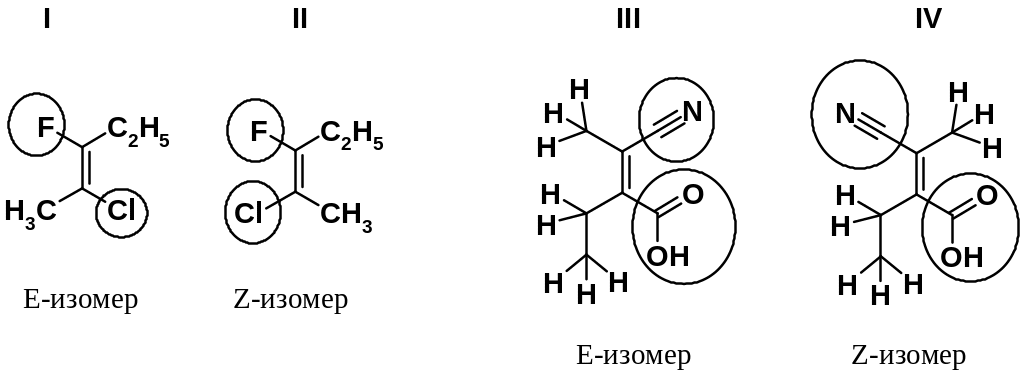
В паре соединений I и II конфигурацию молекулы определяют атомы галогена. У соединения I они расположены по разные стороны от двойной связи (Е-изомер), а у соединения II - по одну сторону (Z-изомер). В случае веществ III и IV определение старшинства заместителей провести сложнее, т.к. с тригональными углеродами связаны атомы углерода. В этом случае определение старшинства проводится по так называемому «второму слою», т.е. определяют старшинство заместителей, связанных с этими углеродами. В приведенном примере старшей группой будет СООН, затем – CN, третьей по старшинству – С2Н5 и самой младшей – СН3. Такое старшинство заместителей позволяет отнести соединения III и IV к E- и Z-изомерам соответственно.
В соответствии с номенклатурой IUPAC в качестве основы названия алкена выбирается самая длинная углеродная цепь, содержащая двойную углерод-углеродную связь. Затем следует определить, какому алкану она соответствует и использовать его название с заменой окончания –ан на -ен. Положение двойной связи указывается цифрой. Затем надо назвать заместители в боковой цепи и указать цифрами их положение.

В примере цифрами показана самая длинная углеродная цепь, содержащая двойную связь. За основу названия выбран насыщенный углеводород декан. Непредельное соединение, соответственно - децен. Поскольку, двойная связь расположена между третьим и четвертым атомами С – децен-3. С пятым атомом углерода основной цепи связан углеводородный заместитель, состоящий из пяти атомов углерода - пентил. Полное название непредельного вещества 4-(пентил-1)-децен-3. Это соединение существует в виде пары E,Z-геометрических изомеров.
