
- •Лекция №1
- •Предмет органической химии
- •Эмпирические, молекулярные и структурные формулы. Изомерия.
- •Классификация органических веществ.
- •Важнейшие функциональные производные органических веществ
- •Номенклатура органических веществ
- •Лекция № 2
- •Виды химических связей
- •Ковалентная связь
- •Образование молекулярных орбиталей из ао (лкао мо)
- •Электронная конфигурация и гибридизация углерода в органических соединениях
- •Полярность и поляризуемость связей
- •Лекция № 3
- •Классификация органических реакций: по характеру превращения
- •По типу разрыва связи в исходной молекуле
- •Энергетические аспекты химических реакций
- •Механизмы органических реакций
- •Постулат Дж. Хэммонда
- •Лекция № 4
- •Равновесные реакции
- •Кинетический и термодинамический контроль
- •Кислотно-основные свойства органических соединений
- •Кислоты и основания по Брёнстеду-Лоури
- •Кислоты и основания по Льюису
- •Лекция № 5 Углеводороды Алканы
- •Алканы (насыщенные ациклические соединения, парафины)
- •Изомерия, номенклатура
- •Конформационная изомерия
- •Номенклатура
- •Лекция № 6 Углеводороды
- •Химические свойства алканов
- •Механизм реакции галогенирования алканов
- •Лекция № 7 Углеводороды
- •Природные источники и методы получения алканов
- •Получение алканов. Лабораторные и промышленные методы синтеза
- •Лекция № 8 Углеводороды
- •Алкены (олефины, этиленовые углеводороды)
- •Получение алкенов
- •Дегидрогалогенирование алкилгалогенидов
- •Дегидратация спиртов
- •Дегалогенирование дигалогенопроизводных
- •Парциальное (частичное) гидрирование алкинов
- •Лекция № 9 Углеводороды
- •Химические свойства алкенов
- •Присоединение галогенов
- •Присоединение галогеноводородов
- •Лекция № 10 Углеводороды
- •Радикальное присоединение к алкенам
- •Гидратация алкенов
- •Образование галогенгидринов
- •Окисление алкенов
- •Образование эпоксидов
- •Окислительное расщепление двойной связи
- •Озонолиз (реакция Гарриеса)
- •Гидроксилирование алкенов (реакция Вагнера)
- •Лекция № 11 Углеводороды
- •Реакции замещения в алкильных группах алкенов
- •Полимеризация алкенов
Номенклатура
В соответствии с номенклатурой IUPAC для первых четырех алканов используют тривиальные названия, для последующих - греческие числительные с добавлением окончания –ан. Названия некоторых алканов нормального строения приведены в таблице. Нормальными называют алканы, имеющие неразветвленную углеродную цепь.
Названия некоторых алканов
-
Формула
Название
Формула
Название
CH4
Метан
C8H18
Октан
C2H6
Этан
C9H20
Нонан
C3H8
Пропан
C10H22
Декан
C4H10
Бутан
C11H24
Ундекан
C5H12
Пентан
C12H26
Додекан
C6H14
Гексан
C16H34
Гексадекан
C7H16
Гептан
C20H42
Эйкозан
Названия группировок, постоянно встречающихся как структурные единицы в органических молекулах, образуют исходя из названия исходного алкана. Так, остатки, условно образующиеся отщеплением от алкана одного атома водорода, вместо окончания –ан имеют окончание –ил. Например, CH3- называют метил, C2H5- этил и т.д. Весь массив таких остатков называют алкильными группами.
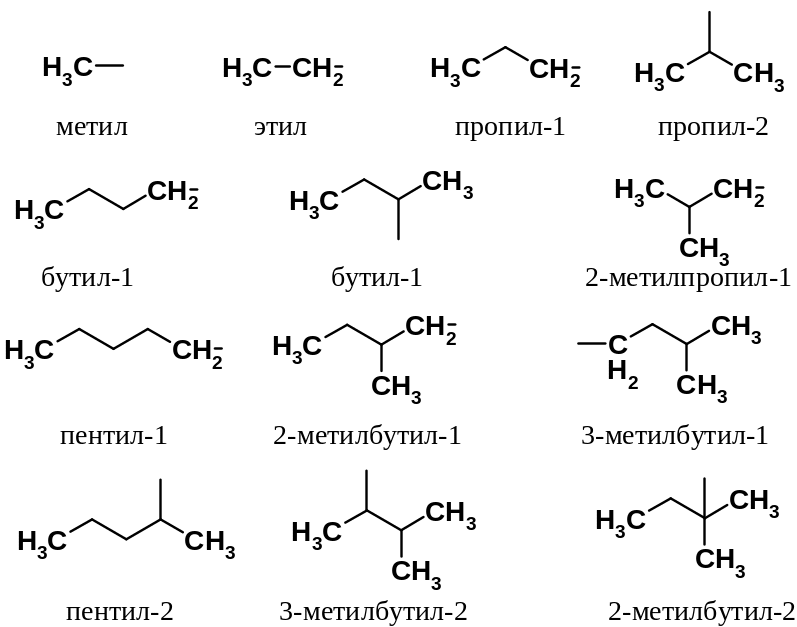
Основы номенклатурных правил IUPAC были изложены ранее.
Примеры названий алканов:

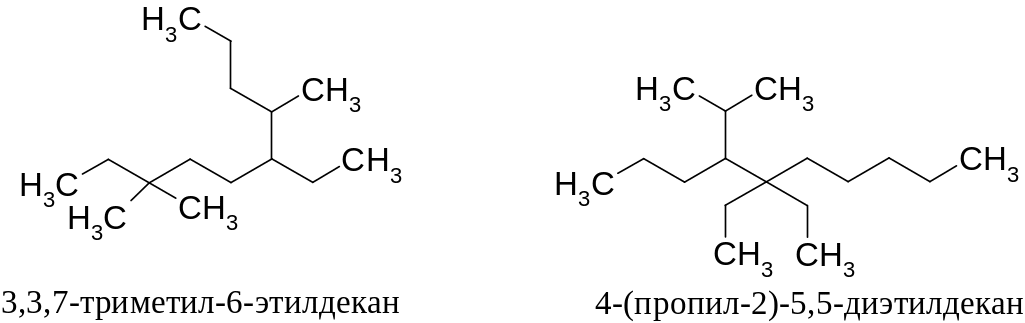
По номенклатуре IUPAC названия классов открытоцепных веществ имеют в основе названия алканов. Поэтому необходимо помнить названия, по крайней мере, первых десяти алканов и легко называть их производные. Зная названия алканов и алкильных групп легко понять, как образуются названия непредельных углеводородов, спиртов, галогенопроизводных и др.
Атомы углерода в алкане классифицируют, исходя из числа его углерод-углеродных связей.
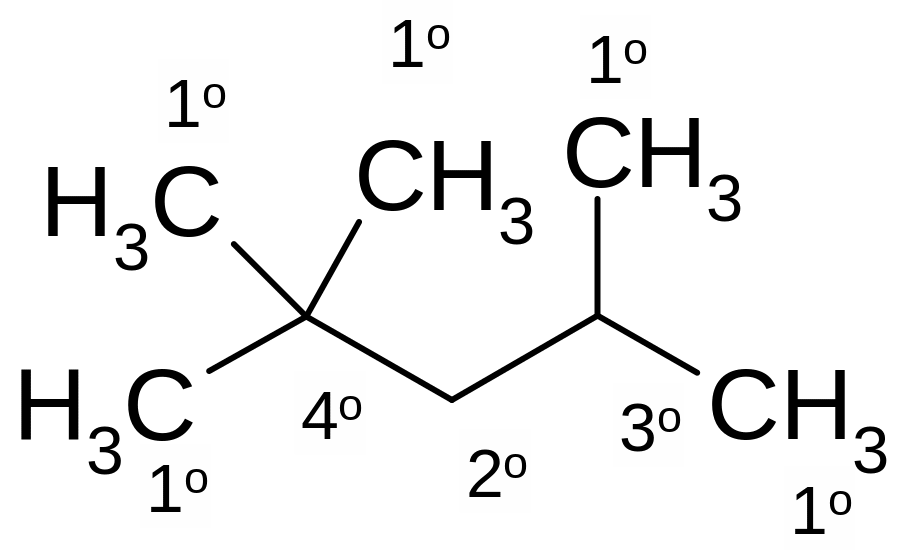
Первичный (1о) атом углерода связан с одним углеродным атомом, вторичный (2о) - с двумя, третичный (3о) – с тремя, а четвертичный (4о) - с четырьмя атомами углерода.
Лекция № 6 Углеводороды
Химические свойства алканов. Реакции свободнорадикального замещения (галогенирование, нитрование, сульфохлорирование и сульфоокисление). Понятие о цепных реакциях (стадии, квантовый выход). Селективность свободнорадикальных реакций и относительная стабильность свободных радикалов. Термические превращения алканов: изомеризация, крекинг. Окисление алканов. Применение алканов в органическом синтезе и в качестве моторного топлива. Детонационные и антидетонационные свойства топлива.
Химические свойства алканов
Старое название алканов - парафины. Этот термин происходит от латинского parum affinis (малое сродство) и говорит о низкой реакционной способности этого класса углеводородов. В обычных условиях на алканы не действуют концентрированные кислоты и щелочи, они инертны по отношению к сильным окислителям и восстановителям.
Как было отмечено ранее, в алканах все атомы углерода связаны с четыремя другими атомами. Отсутствие в молекулах этого класса веществ кратных связей не позволяет рассчитывать на возможность протекания реакций присоединения.
Для соединений этого класса характерны реакции замещения. Характерным примером такого типа реакций являются хлорирование и бромирование алканов.
Рассмотрим хлорирование метана. Реакция протекает при нагревании или облучении смеси ультрафиолетовым светом. При этом атом хлора замещает атом водорода в метане, а второй атом хлора связывает атом водорода.
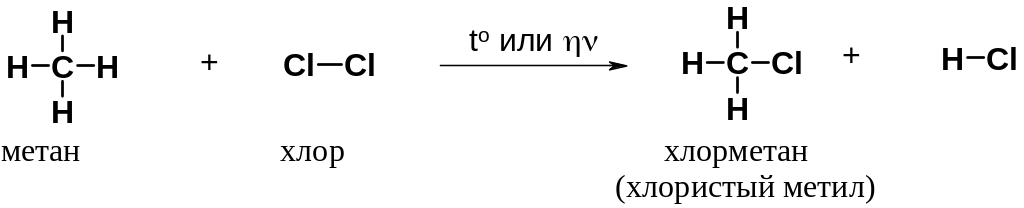
Образующийся в ходе реакции хлорметан в свою очередь вступает в реакцию с хлором с образованием дихлорметана (хлористого метилена). Далее реакция может продолжаться с образованием CHCl3 (хлороформа) и, в конце концов, -четыреххлористого углерода (CCl4).
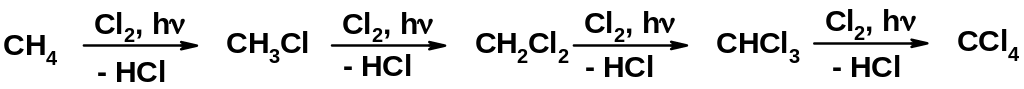
В реакции может образоваться четыре продукта. Можно ли процесс остановить на требуемой стадии?
Реакция непосредственного галогенирования используется только для получения моно- или пер-галогеноалканов. Для проведения однозначной реакции используют большой избыток одного из реагентов. Для проведения реакции монохлорирования используют большой избыток метана. Основным продуктом реакции будет хлористый метил. Большое различие в температурах кипения между метаном и хлорметаном (> 130о С) позволяет легко отделить непрореагировавший метан и использовать его повторно. Аналогично проводят реакцию получения тетрахлорметана, используя большой избыток молекулярного хлора. В этом процессе разделение продукта и непрореагировавшего реагента еще проще, т.к. при комнатной температуре хлор находится в газообразном состоянии, а четыреххлористый углерод – жидкость.
Бром взаимодействует с метаном при высокой температуре или освещении ультрафиолетовым светом с образованием соответствующих производных (от моно- до тетрабромметана).

Реакция метана с йодом не идет, а с фтором протекает со взрывом даже в темноте и при комнатной температуре. Обычно для получения насыщенных фтор- и йодпроизводных используют другие методы синтеза.
Таким образом, реакционная способность галогенов в реакции с метаном изменяется в следующем порядке: F2 > Cl2 > Br2 (> I2)
В реакциях галогенов с другими алканами порядок изменения их реакционной способности не меняется.
Термин «реакционная способность» очень распространен в органической химии. Как правило, при сравнении реакционной способности сравнивают скорость или легкость протекания реакции. Если утверждается, что хлор по отношению к метану, более реакционноспособен, чем бром, это означает, что в идентичных условиях хлорирование метана происходит быстрее, чем бромирование. Чтобы реакция с бромом протекала с такой же скоростью, как с хлором, ее надо проводить в более жестких условиях (при более высокой температуре или при больших концентрациях).
