
- •Лекция №1
- •Предмет органической химии
- •Эмпирические, молекулярные и структурные формулы. Изомерия.
- •Классификация органических веществ.
- •Важнейшие функциональные производные органических веществ
- •Номенклатура органических веществ
- •Лекция № 2
- •Виды химических связей
- •Ковалентная связь
- •Образование молекулярных орбиталей из ао (лкао мо)
- •Электронная конфигурация и гибридизация углерода в органических соединениях
- •Полярность и поляризуемость связей
- •Лекция № 3
- •Классификация органических реакций: по характеру превращения
- •По типу разрыва связи в исходной молекуле
- •Энергетические аспекты химических реакций
- •Механизмы органических реакций
- •Постулат Дж. Хэммонда
- •Лекция № 4
- •Равновесные реакции
- •Кинетический и термодинамический контроль
- •Кислотно-основные свойства органических соединений
- •Кислоты и основания по Брёнстеду-Лоури
- •Кислоты и основания по Льюису
- •Лекция № 5 Углеводороды Алканы
- •Алканы (насыщенные ациклические соединения, парафины)
- •Изомерия, номенклатура
- •Конформационная изомерия
- •Номенклатура
- •Лекция № 6 Углеводороды
- •Химические свойства алканов
- •Механизм реакции галогенирования алканов
- •Лекция № 7 Углеводороды
- •Природные источники и методы получения алканов
- •Получение алканов. Лабораторные и промышленные методы синтеза
- •Лекция № 8 Углеводороды
- •Алкены (олефины, этиленовые углеводороды)
- •Получение алкенов
- •Дегидрогалогенирование алкилгалогенидов
- •Дегидратация спиртов
- •Дегалогенирование дигалогенопроизводных
- •Парциальное (частичное) гидрирование алкинов
- •Лекция № 9 Углеводороды
- •Химические свойства алкенов
- •Присоединение галогенов
- •Присоединение галогеноводородов
- •Лекция № 10 Углеводороды
- •Радикальное присоединение к алкенам
- •Гидратация алкенов
- •Образование галогенгидринов
- •Окисление алкенов
- •Образование эпоксидов
- •Окислительное расщепление двойной связи
- •Озонолиз (реакция Гарриеса)
- •Гидроксилирование алкенов (реакция Вагнера)
- •Лекция № 11 Углеводороды
- •Реакции замещения в алкильных группах алкенов
- •Полимеризация алкенов
Кислоты и основания по Льюису
Основания по Льюису – доноры электронной пары, как и основания по Брёнстеду.
Определение Льюиса для кислот заметно отличается от привычного (по Брёнстеду). Кислотой по Льюису считается любая молекула или ион, имеющая свободную орбиталь, которая может быть в результате взаимодействия заполнена электронной парой. Если по Брёнстеду кислота – донор протона, то по Льюису сам протон (Н+) – кислота, поскольку его орбиталь пуста. Кислот Льюиса очень много: Na+, Mg2+, SnCl4, SbCl5, AlCl3, BF3, FeBr3 и т.д. Теория Льюиса позволяет описать многие реакции как кислотно-основные взаимодействия. Например:

Часто в реакциях с кислотами Льюиса в качестве оснований участвуют органические соединения, являющиеся донорами пары -электронов:
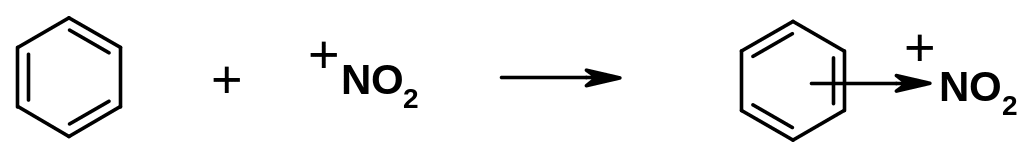
В органической химии принято следующее:
если используется термин «кислота» - подразумевается кислота по Брёнстеду;
если используют термин «кислота» в льюисовском понимании – говорят «кислота Льюиса».
Лекция № 5 Углеводороды Алканы
Гомологический ряд, номенклатура, изомерия, алкильные радикалы. Электронное строение молекул алканов, sp3-гибридизация, -связь. Длины C-C и C-H связей, валентные углы, энергии связей. Пространственная изомерия органических веществ. Способы изображения пространственного строения молекул с sp3-гибридизованными атомами углерода. Спектральные характеристики алканов. Физические свойства алканов и закономерности их изменения в гомологическом ряду.
Алканы (насыщенные ациклические соединения, парафины)
Алканы - углеводороды с открытой цепью атомов, отвечающие формуле СnH2n+2, где атомы углерода связаны между собой только σ-связями.
Термин «насыщенный» означает, что каждый углерод в молекуле такого вещества связан с максимально возможным числом атомов (с четырьмя атомами).
Строение метана подробно изложено в лекции № 2.
Изомерия, номенклатура

Три первых члена гомологического ряда (метан, этан и пропан) существуют в виде одного структурного изомера. Начиная с бутана число изомеров стремительно растет: у пентана три изомера, а у декана (С10Н22) их уже 75.
Конформационная изомерия
Стереоизомеры (пространственные изомеры) – вещества, имеющие одинаковый состав и последовательность атомов, но различное расположение их в пространстве. -Связь симметрична относительно оси, связывающей центры атомов, и при повороте фрагментов относительно друг друга энергия связи не меняется. Энергетически неравноценные формы молекул, переходящие друг в друга только за счет свободного вращения или изгиба связей, называются конформациями.
Конформация а (рис. 5.1.) называется заслоненной, конформация b – заторможенной. Возможно бесконечное количество промежуточных (скошенных) конформаций.

Рис. 5.1. Заслоненная (а) и заторможенная (b) конформации этана
Удобно изображать конформации с помощью проекций Ньюмена – взгляд вдоль связи, относительно которой происходит вращение. В заслоненной конформации атомы находятся ближе друг к другу, чем в заторможенной. Возникает сила, стремящаяся повернуть один фрагмент относительно другого – торсионное напряжение. Заторможенная конформация поэтому энергетически более выгодна, чем заслоненная. В этане энергетический барьер между конформациями составляет всего 3 ккал/моль (12 кДж/моль) (рис. 5.2).
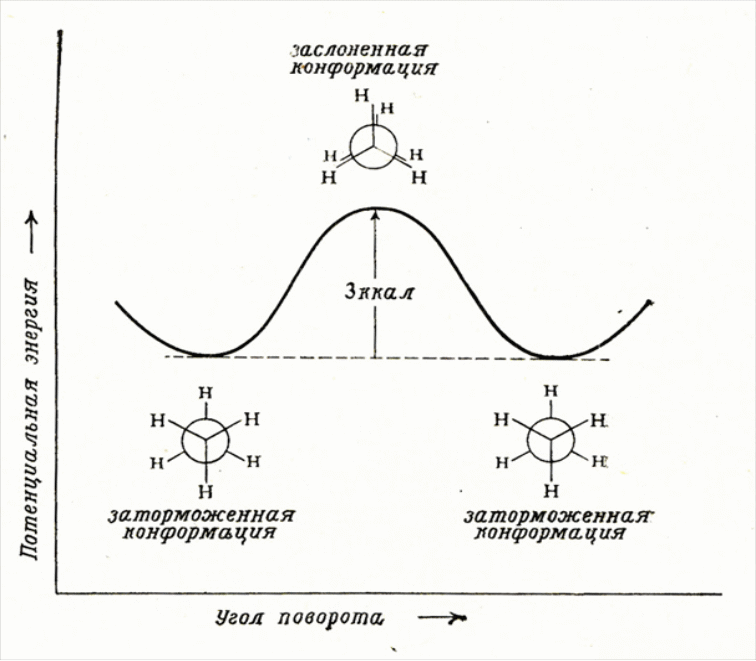
Рис. 5.2. Конформации этана и их относительные энергии
