
- •Номенклатура, строение и свойства высших жирных кислот. Физиологические функции производных арахидоновой кислоты – эйкозаноидов.
- •Простые омыляемые липиды. Свойства жиров. Воски.
- •Структура, свойства и биологические функции глицеро- и сфингофосфолипидов.
- •Свойства фосфолипидов
- •Биологическая роль фосфолипидов
- •Гликолипиды. Структура и биологические функции олигосахаридов.
- •Представители олигосахаридов
- •Полисахариды
- •5.Молекулярная организация и функции биологических мембран. Понятие об активном и пассивном транспорте.
- •7. Изопреноиды. Феромоны насекомых.
- •Феромоны насекомых.
- •8. Производные стерана: холестерин, эргостерин, желчные кислоты, сердечные гликозиды.
- •Желчные кислоты человека
- •9.Характеристика стероидных гормонов: структура, место синтеза, физиологические функции.
- •10. Производные аминокислот. Тиреоидные гормоны, катехоламины,нейромедиаторы.
- •12. Низкомолекулярные пептиды ( глутатион, карнозин, нейропептиды, пептиды- токсины).
- •13.Антибиотики. Пенициллины. Грамицидин. Сульфациламиды.
- •14.Витамины, растворимые в воде.
- •Витамин в1
- •Витамин в2
- •Витамин рр
- •Витамин в3
- •Витамин в6
- •Витамин н
- •15.Витаминоподобные соединения. Коферменты.
- •16.Жирорастворимые витамины.
- •Витамин а
- •Каротин
- •Витамин д
- •Витамин к
- •17.Биологически важные гетероциклические соединения. Алкалоиды.
- •Биологически активные производные пиридина.
- •18.Классификация, свойства и номенклатура природных кето-, гидрокси- и аминокислот.
- •Общие химические свойства.
- •Химические свойства.
- •19.Химический синтез аминокислот. Способы разделения рецематов. Понятие о ферментативном и микробиологическрм синтезе.
- •20.Компоненты нуклеиновых кислот. Пуриновые и пиримидиновые основания. Нуклеозиды, нуклеотиды.
18.Классификация, свойства и номенклатура природных кето-, гидрокси- и аминокислот.
Аминокисло́ты (аминокарбо́новые кисло́ты) — органические соединения, в молекуле которых одновременно содержатся карбоксильные и аминные группы.
Аминокислоты могут рассматриваться как производные карбоновых кислот, в которых один или несколько атомов водорода заменены на аминные группы.
Физические свойства.Аминокислоты — бесцветные кристаллические вещества, хорошо растворимые в воде. Многие из них обладают сладким вкусом.
Общие химические свойства.
Все аминокислоты амфотерные соединения, они могут проявлять как кислотные свойства, обусловленные наличием в их молекулах карбоксильной группы —COOH, так и основные свойства, обусловленные аминогруппой —NH2. Аминокислоты взаимодействуют с кислотами и щелочами:
NH2 —CH2 —COOH + HCl → HCl • NH2 —CH2 —COOH (хлороводородная соль глицина)
NH2 —CH2 —COOH + NaOH → H2O + NH2 —CH2 —COONa (натриевая соль глицина)
Растворы аминокислот в воде благодаря этому обладают свойствами буферных растворов, т.е. находятся в состоянии внутренних солей.
NH2 —CH2COOH Equilibrium rl.svg N+H3 —CH2COO-
Аминокислоты обычно могут вступать во все реакции, характерные для карбоновых кислот и аминов.
Этерификация:
NH2 —CH2 —COOH + CH3OH → H2O + NH2 —CH2 —COOCH3 (метиловый эфир глицина).Важной особенностью аминокислот является их способность к поликонденсации, приводящей к образованию полиамидов, в том числе пептидов, белков, нейлона, капрона.
Реакция образования пептидов:
HOOC —CH2 —NH —H + HOOC —CH2 —NH2 → HOOC —CH2 —NH —CO —CH2 —NH2 + H2O
Изоэлектрической точкой аминокислоты называют значение pH, при котором максимальная доля молекул аминокислоты обладает нулевым зарядом. При таком pH аминокислота наименее подвижна в электрическом поле, и данное свойство можно использовать для разделения аминокислот, а также белков и пептидов.
Классификация
По радикалу
Неполярные: глицин, аланин, валин, изолейцин, лейцин, пролин, метионин, фенилаланин, триптофан
Полярные незаряженные (заряды скомпенсированы) при pH=7: серин, треонин, цистеин, аспарагин, глутамин, тирозин
Полярные заряженные отрицательно при pH<7: аспартат, глутамат
Полярные заряженные положительно при pH>7: лизин, аргинин, гистидин
По функциональным группам
Алифатические
Моноаминомонокарбоновые: глицин, аланин, валин, изолейцин, лейцин
Оксимоноаминокарбоновые: серин, треонин
Моноаминодикарбоновые: аспартат, глутамат, за счёт второй карбоксильной группы несут в растворе отрицательный заряд
Амиды моноаминодикарбоновых: аспарагин, глутамин
Диаминомонокарбоновые: лизин, аргинин, несут в растворе положительный заряд
Серосодержащие: цистеин, метионин
Ароматические: фенилаланин, тирозин, триптофан, (гистидин)
Гетероциклические: триптофан, гистидин, пролин
Иминокислоты: пролин
По классам аминоацил-тРНК-синтетаз
Класс I: валин, изолейцин, лейцин, цистеин, метионин, глутамат, глутамин, аргинин, тирозин, триптофан
Класс II: глицин, аланин, пролин, серин, треонин, аспартат, аспарагин, гистидин, фенилаланин
Для аминокислоты лизин существуют аминоацил-тРНК-синтетазы обоих классов.
По путям биосинтеза
Пути биосинтеза протеиногенных аминокислот разноплановы. Одна и та же аминокислота может образовываться разными путями. К тому же совершенно различные пути могут иметь очень похожие этапы. Тем не менее, имеют место и оправданы попытки классифицировать аминокислоты по путям их биосинтеза. Существует представление о следующих биосинтетических семействах аминокислот: аспартата, глутамата, серина, пирувата и пентоз. Не всегда конкретную аминокислоту можно однозначно отнести к определённому семейству; делаются поправки для конкретных организмов и учитывая преобладающий путь. По семействам аминокислоты обычно распределяют следующим образом:
Семейство аспартата: аспартат, аспарагин, треонин, изолейцин, метионин, лизин.
Семейство глутамата: глутамат, глутамин, аргинин, пролин.
Семейство пирувата: аланин, валин, лейцин.
Семейство серина: серин, цистеин, глицин.
Семейство пентоз: гистидин, фенилаланин, тирозин, триптофан.
Фенилаланин, тирозин, триптофан иногда выделяют в семейство шикимата.
Кетокислоты
— это карбоновые кислоты, содержащие
помимо карбоксильной группы -COOH ещё и
карбонильную группу =CO. Примерами
кетокислот являются пировиноградная
и ацетоуксусная кислоты. Кетокислоты
обладают химическими свойствами как
кетонов, так и карбоновых кислот.
Гидроксикислоты
дают реакции, характерные для карбоновых
кислот и спиртов,при этом могут
затрагиваться как одна, так и обе функции.
Наиболее характерные реакции приведены
на схеме
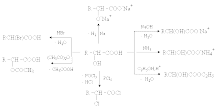
Отношение
гидроксикислот к нагреванию.Превращения
гидроксикислот при нагревании определяются
возможностью образования термодинамически
стабильных 5-ти- 6-тичленных циклов a
–Гидроксикислоты вступают в реакцию
межмолекулярного самоацилирования.
При этом образуются циклические сложные
эфиры –лактиды.

b -Гидроксикислоты при нагревании переходят a ,b -непредельные кислоты.

Специфические реакции a -гидроксикислот.
a –Гидроксикислоты образуют хелатные комплексы с ионами переходных металлов (Cu2+ , Fe3+ и др.), которые содержат металл в составе устойчивого 5-тичленного цикла.

В присутствии минеральных кислот a -гидроксикислоты разлагаются с образованием муравьиной кислоты и соответствующего альдегида.
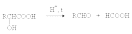
Оксикислоты (оксикарбоновые кислоты, гидрокискарбоновые кислоты) — карбоновые кислоты, в которых одновременно содержатся карбоксильная и гидроксильная группы, например молочная кислота: СН3-СН(ОН)-СООН. Оксикислоты проявляют все свойства, характерные для кислот (диссоциация, образование солей, сложных эфиров и т. д.), и свойства, характерные для спиртов (окисление, образование простых эфиров и т. д.).
