
- •8 Глав 57 параграфов. 16ти нет Физика Введение. Дуализм света. Опыт Боте.
- •Глава 1. Действие света. §1 Фотоны.
- •§2 Фотоэффект.
- •1. Основные особенности фотоэффекта.
- •2. Объяснение фотоэффекта с точки зрения волновой и квантовой теорий.
- •3. Селективный, внутренний, вентильный фотоэффект.
- •§3 Применение фотоэффекта.
- •§4 Давление света.
- •§5 Явление Комптона – рассеяние рентгеновского кванта на «свободном» электроне.
- •1. Физическая сущность
- •2. Элементарная теория комптоновского эффекта
- •3. Выводы
- •2. Квантовая гипотеза. Формула Планка.
- •3. Следствие из формул Планка.
- •2. Строение атома.
- •§2 Модель Томпсона.
- •§3 Опыты Резерфорда.
- •§4 Энергия электрона в атоме.
- •Глава 3. Теория Бора. §1 Несостоятельность классической модели атома.
- •§2 Постулаты Бора. (1913)
- •§3 Опыты Франка и Герца. (1913)
- •§4 Теория атома водорода и водородоподобных ионов по Бору.
- •1.Эксперементальные факты, объясняемые теорией Бора:
- •§2 Экспериментальное подтверждение гипотезы де Бройля. Опыты Дэвисона и Джермера. 1927-1923.
- •§3 Общие свойства волн. Волновой пакет.
- •§4 Свойства волн де Бройля.
- •4)Дисперсия волн де Бройля
- •5)Волны де Бройля и второй постулат Бора. (правило квантования орбит)
- •§5 Соотношение неопределенностей Гейзенберга.
- •1)Разрыв однозначных связей между p и X в квантовой механике
- •§6 Волны де Бройля и волновая функция.
- •§7 Вероятностное толкование волн де Бройля.
- •§8 Вероятность нахождения мкч.Нахождение средних значений функции от координат. (роль ψ –фунукции в квантовой механике)
- •Глава 5. Уравнение Шредингера. §1 Особенности волнового уравнения для микрочастицы.
- •§2 Общий вид уравнения Шредингера от времени.
- •§3 Уравнение Шредингера для стационарных состояний.
- •§4 Уравнение Шредингера для n частиц
- •§5 Анализ решений уравнений Шредингера
- •1.Сравнение с обычным волновым уравнением:
- •2.Начальные и граничные условия
- •3. Стандартные естественные условия
- •4. Собственные значения и собственные функции
- •Глава 6. Применение квантовой механики. §1 Движение мкч в свободном пространстве.
- •1.Уравнение Шредингера и его решение
- •2.Собственные функции оператора энергии
- •3. Собственные значения энергии
- •§2 Движение мкч в потенциальном ящике.
- •§3 Отражение и прохождение мкч через Потенциальный барьер.
- •2.Уравнение Шредингера и его решение
- •3.Микро и макро частицы на грани 2х сред
- •4.Определение коэффициента отражения r и коэффициента прозрачности d
- •5.Частные случаи
- •§4 Прохождение микрочастицы через потенциальный барьер конечной ширины. Туннельный эффект.
- •§5 Микрочастица в потенциальной яме конечной глубины.
- •§6 Квантово-механический осциллятор
- •1.Гармонический осциллятор
- •2.Классический гармонический осциллятор
- •3.Квантово-механический осциллятор
- •§7 Квантово-механическая модель атома.
- •1.Качественное рассмотрение
- •2. Уравнение шредингера для электрона в атоме водорода
- •3.Квантовые числа
- •4.Спектр атома водорода. Правило отбора.
- •5.Сферич. Симметрич. Случай. (1s сост)
- •6. Местонахождение электрона в атоме в 1s состоянии
- •§8 Магнитные свойства и спин электрона.
- •Глава 6. Применение квантовой механики. §1 Принцип Паули (1925).
- •§2 Распределение электронов в сложных атомах по оболочкам. Таблица Менделеева.
- •§3 Спектр сложных атомов.
- •1.Рентгеновские спектры.
- •2.Тормозное рентгеновское излучение (белое)
- •Глава 7. Элементы квантовой статистики. Проводимость металлов. §1 Понятие о квантовой статистике.
- •§3 Динамика электрона в кристаллической решетке. Эффективная масса электрона.
- •II з. Ньютона
§3 Опыты Франка и Герца. (1913)
Термо-электронная эмиссия.
Сетка положительно заряжена.

Подается напряжение (- + - +)
Катод-сетка: ускоряющее напряжение в промежуток
Сетка – Анод: наоборот тормозящее напряжение о,5 В
Атом ртути 80 Hg 200
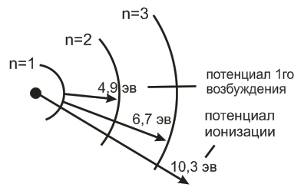
Потенциал ионизации – разность потенциалов которую должен пройти сторонний электрон чтобы при соударении с атомом выбить из него электрон. U эВ
Частота излучения та, с которой колеблется электрон.
Частота вращения = частоте излуч.
Вольтамперная характеристика из опытов Франка и Герца :
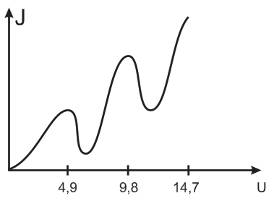
1е возрастание: ток растет тк растет U чем больше потенциал тем больше электронов.
1й спад: электрон сталкивается с электроном ртути, при этом столкновении до U=4,9 соударения упругие, начиная с 4,9 соударения неупругие (у сетки)
Далее увеличиваем U, электрон отдавший энергию находится в ускор. Поле, поэтому преодолевает напряжение, график снова растет
И т.д.
Передача энергии электроном не всегда происходит, тк атом в любом количестве энергию у электрона не принимает.
При передаче энергии есть свечение.
§4 Теория атома водорода и водородоподобных ионов по Бору.
1.Эксперементальные факты, объясняемые теорией Бора:
а- размер атома водорода r=53 пм
б- энергия ионизации атома водорода Eи = 13,6 эв
Eи – энергия бомбардирующего электрона достаточная для того чтобы при соударении выбить электрон из атома.
Потенциал ионизации Uи – разность потенциалов которую должен пройти бомбардирующий электрон чтобы приобрести энергию достаточную для ионизации атома.
Eи = eUи
в- закономерность линейчатого спектра.
1/λ = R(1/ni2-1/nj2)
2. Радиусы орбит атомов.
{ ke2/r2 = mV2/r классическая модель
mVr = nћ } – квантовая модель
k = 1/4Piε0 n=1,2,3…
момент импульса кратен ћ
kme2 r3/r2 = mV2m r3/r = m2V2 r2
m2V2 r2 = n2ћ2
kme2 r = n2ћ2
rn = n2ћ2/kme2 - закон квантования
n=1 r1= ћ2/kme2
r1=(1,05*1,05*10-68)/(9*109*9*10-31*2,56*10-38) = 53*10-12 м
[r]=дж2*с2*Ф/м*кг*кл2 = м
Кл/Ф = В*кл = дж
n2=2 r2=4r1
n3=3 r3=9r1
rn=nr1
3. Скорость электрона
признак водорода E=1 ?
Vn= ke2/ nћ
V1= ke2/ ћ : n=1
V1= (9*109*2,56*10-38)/(1,05*10-34) = 2,2*106 (м/с)
[V] = м*кл2/Ф*Дж*с = м/с
Vn = V1 / n
4. Энергия электрона в атоме
E = - ke2/ 2r
E = T + U
E = - ke2km e2/2n2 ћ 2 = - k2me4/2n2 ћ 2
En = - k2me4/2n2 ћ 2
n = 1:
E1 = (81*1018*9,1*10-31*2,56*2,56*10-76)/(2*1,05*1,05*10-68*1,6*10-15) = - 13,6 эв
[E] = м2*кг*кг4 / Ф2 * Дж2 * с2 = Дж
En = E(бесконечности) - E1
E(бесконечности) = 0
En = E1 / n2 n=1,2,3… - главное квантовое число
5. Закономерность линейчатых спектров.
1/λ = R(1/ni2-1/nj2)
По Бору:
hυ = Ej – Ei = - k2me4/2nj2 ћ 2 – (- k2me4/2ni2 ћ 2 ) = k2me4/2 ћ 2 (1/ ni2 – 1/nj2)
hυ = hC/ λ (?)
k2me4/2hCћ 2 = (81*1018*9,110-31*2,56*2,56*10-76)/( 2*1,05*1,05*10-68*6,62*10-34*3*1081) = 1,1*107 м-1
6. Спектр атома водорода.
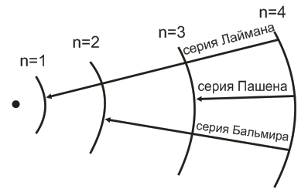
диаграмма уровней энергии в атоме водорода
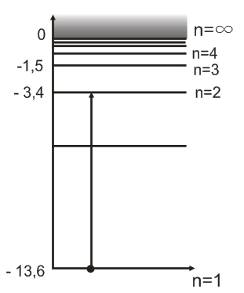
E первого возбуждения = 10,2 эв
U первого возбуждения = 10,2 эв
7. Магнитные моменты.
Гиромагнитное отношение
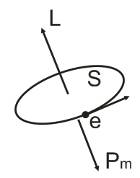
L = m [Vr] - вектор – механический момент
L = mVr
Pm = магнитный момент
Pm = JS = eVPir2/2Pir = eVr/2
J = eV/2Pir
Pm / L = eVr/2mVr = e/2m – гиромагнитное отношение
Pm = - Le/2m L= nћ
Pm = - e nћ / 2m
eћ / 2m = μБ = 0,9*10-23 – магнетон Бора – минимальная порция магнитного момента в природе
Pm = n μБ
8. Водородные ионы.
z=1
{ kze2/r2 = mV2/r классическая модель
mVr = nћ } – квантовая модель
r = n2ћ2 / kmze2
V = kze2 / nћ
En = k2mz2e4 / 2 n2ћ2
1/λ = z2R(1/ni2-1/nj2)
§6 Затруднения Теории атома водорода и водородоподобных ионов по Бору.
Решила много вопросов, объяснила эксперименты и тд.
Позже начали находить недостатки:
1)непоследовательность
{mVr = nћ - квантовое товое положение
kze2/r2 = mV2/r } классическое положение
теория не могла долго существовать и была переходной.
Не смогла объяснить интенсивность спектральных линий.
Справедлива только для водородоподобных атомов и не работает для атомов, следующих за ним в таблице Менделеева.
Теория Бора логически противоречива: не является ни классической, ни квантовой. В системе двух уравнений, лежащих в её основе, одно — уравнение движения электрона — классическое, другое — уравнение квантования орбит — квантовое.
Элементы Квантовой Механики.
Введение. История создания квантовой механики.
В ее основу легли 2 факта: теория Бора и дуализм света.
1924-1926
Шрединг, Гейзинберг, Борн
Дуализм света (одновременно электро-магнитная волна и поток фотонов):
{ε=hν = hC/λ=ħω -энергия фотона
P = hν/C = h/λ = ħk}-импульс фотона
k=2Pi/λ
дуализм света – объективный закон природы.
Глава 4. Волновые свойства микрочастиц.
§1 Гипотеза Луи де Бройля. 1923г.
Утвердилось учение о дуализме. ЛдБ предположил что дуализм присущ всей материи – электронам, протонам, нейтронам...
есть частица, перемещающаяся со скоростью V значит она обладает импульсом P и ее движение характеризует волна. О природе волн де Бройля было много споров. Это математический аппарат для описания движения частиц.
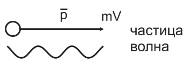
λ=h/p ω= ε/ħ
если частица свободная, нерелятивистская, T<<m0C2
1)cвободная U(x)=0 Tкин=p2/2m
λ=h/sqr(2mTкин) p=sqr(2mTкин)
2)cвязанная (в силовом поле)
U(x)!=0
E=Tкин+U(x)
Tкин=E-U(x)
λ=h/sqr(2m(E-U(x)))
Если частица релетявистская, T~m0C2 - энергия покоя
λ=h/p
E2=E02+p2C2
p2C2 = E2 – E02
E= mC2 E0 = m0C2
p2 = (E - E0)(E + E0)/C2=T(2m0C2+T)/ C2
λ=hC/sqr(T(T+2m0C2))
чуваки эту ляляку встретили негативно, только эксперименты убедили их:
определить λ шарика m=1г движущегося со скоростью V=1см/с
λ = h/mV = (6,62 10-34 дж с)/(10 -3 10 -2 м/с)=6,62 10 -29 м
длина волны настолько мало что отсутствуют методы определения такой длины волны
определим λ для электрона в атоме водорода, V=106 м/с
λ = h/mV = (6,62 10-34 дж с)/(9,1 10 -31 10 6 м/с) ~ 0,7 нм – частота рентгеновского излучения
для рентгеновских лучей наблюдается дифрагция на монокристаллах.
