
- •Электролитная коагуляция. Строение и структура дэс.
- •Коллоидно-растворённые примеси могут быть гидрофильными и гидрофобными.
- •Электролитная коагуляция. Коагуляция электролитами низшей валентности
- •Влияние концентрации электролита на ζ
- •Наблюдается аддитивное действие электролитов.
- •Имеет место антагонизм электролитов.
- •Синергизм электролитов.
- •Активная реакция воды
Электролитная коагуляция. Строение и структура дэс.
При рассмотрении классификации Кульского Л. А. было указано, что II группа примесей (коллоидно-растворённая) является агрегрегативно устойчивой и при отстаивании и фильтрации воды не удаляется.
Коллоидно-растворённые примеси могут быть гидрофильными и гидрофобными.
Агрегативная устойчивость гидрофильных коллоидно-растворённых примесей (гуминовые, фульвокислоты и др. органические вещества природной воды, обусловливающих цветность) связана с наличием в составе этих веществ гидрофильных групп типа:
- СООН – ацетатные;
- ОН – гидроксильные.
Поэтому органические вещества природной воды обладают значительной гидратной оболочкой и малым эл. зарядом. Из воды данные вещества удаляются главным образом в результате процесса сорбции на различных сорбентах (АУ, цеолиты и др. природные мат-лы).
К гидрофобным коллоидно-растворённым веществам II группы классификации Кульского относят:
- “тонкие” частицы ила, глины, песка;
- гидроксиды, частицы Fe, Al, Si.
Данные частицы имеют кристаллическую либо аморфную структуру.
Одним из основных свойств данных гидрофобных частиц является тот факт, что ядра этих гидрофобных частиц согласно правилу Фаянса способны достраивать свою решётку за счёт сорбции ионов из природной воды. При этом ядро гидрофобной частицы приобретает электрический поверхностный заряд, который затем должен быть нейтрализован ионами воды или раствора (иначе вода не была бы электронейтральной).
Схема происходящих процессов может быть представлена следующим образом:
экспериментально установлено, что гидрофобные коллоидно-растворённые частицы природных вод, при значении рН = 6,5-7,5 имеют отрицательный заряд.

Вокруг каждого ядра коллоидной частицы, которая имеет кристаллическую структуру, формируется так называемый потенциалобразующий слой из ионов природной воды. При этом происходит достройка кристаллической структуры ядра и формирование поверхностного заряда.
Ядро
потенциалообразные
ионы природной воды, способные достраивать
кристаллическую решётку
и т.о. гидрофобная частица приобретает поверхностный заряд (○ в нашем случае)
Естественно, что в растворе или природной воде заряд ядра коллоидной частицы должен быть нейтрализован другими ионами, имеющими противоположный заряд, т.е. противоионами (в нашем случае это катионы природной воды)

Окончательная нейтрализация поверхностного заряда частицы происходит за счёт образования второго диффузионного слоя, также состоящего из катионов раствора (см. след. рис. ). Сочетание А + Д = ДЭС.
Следует отметить, что противоионы (в нашем случае – катионы) испытывают на себе две силы :
электростатическую – эта сила притягивает противоионы к ядру коллоидные частицы ввиду разноименности зарядов;
диффузионные силы – они, наоборот, стремятся рассеять противоионы по раствору вследствие теплового броуновского движения;
Соответственно, в адсорбционном слое преобладают эл. статические силы, а в диффузионном слое – противоионы в большей степени подвержены тепловому броуновскому движению.
Экспериментально установлено, что
на ζ и толщину ДЭС в значительной степени влияет концентрация электролита и его валентность.
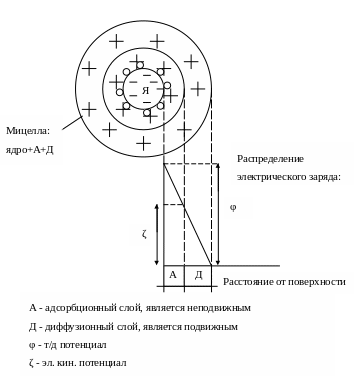
Дадим определение ζ и φ:
Полное падение потенциала на границе твёрдого вещества (ядра частицы) и раствора до нулевого значения соответствует max разности потенциалов твёрдого вещества, эта max разность потенциалов называется т/д потенциалом и обозначается (φ).
А падение потенциала частицы, соответствующее диффузионному слою (при движении) называется эл. кин. потенциалом (ζ).
Сравним φ и ζ:
Как следует из рисунка:
φ ≠ ζ
φ – возникает на границе тв.- жид. ζ - возникает на границе между подвижными и неподвижными слоями жидкости.
на величину ζ и толщину в значительной степени влияет Сэл и его валентность → коагуляция электролитами.
Следует отметить, что в вопросах очистки воды коагуляцией именно ζ – потенциалу т.е. потенциал диффузионной части ДЭС, придаётся большое значение. Это связано с тем, что при разрушении агрегативной устойчивости дисперсной системы (коллоидной взвеси) коагулянтами происходит сжатие диффузионного слоя и в конечном итоге снижение ζ – потенциала до нулевого значения, при котором имеет место max эффект коагуляции.
