
- •Москва медицина 1998 Издание рекомендовано для перевода академиком рамн
- •Майкл Ферранте
- •Значимость проблемы послеоперационной боли
- •Распространенность проблемы по данным исследований
- •Распространенность проблемы по хирургическим данным
- •Боль, обусловленная хирургическим вмешательством (в порядке снижения интенсивности)1 Операции на желудке
- •Сопоставление разных методов аналгезии (международное исследование)
- •Региональная анестезия/аналгезия и легочные осложнения
- •Региональная анестезия/аналгезия и заболевания в послеоперационном периоде
- •Аналгезия, контролируемая пациентом
- •Премедикация и техника анестезии
- •Факторы, обусловливающие неадекватный контроль послеоперационной боли
- •Недостаток рутинной количественной оценки
- •Побочное действие анальгетиков
- •Индивидуальные различия реакции на анальгетики
- •Направления и пути решения
- •Периферическая нервная система Основы анатомии
- •Микроскопическое строение
- •Трансдукция Характеристика ноцицепторов
- •Категории ноцицепторов
- •Миелинизированные ноцицепторы
- •Немиелинизированные ноцицепторы
- •Роль ноцицепторов в перцепции боли
- •Сенсибилизация и гиперсенсибилизация
- •Биохимические субстраты
- •Трансдукция в глубоких соматических тканях
- •Суставы
- •Трансдукция в висцеральных органах
- •Резюме по вопросам трансдукции
- •Центральная нервная система
- •Ультраструктура спинного мозга
- •Ультраструктура головного мозга
- •Главные структуры ствола мозга
- •Таламус
- •Трансмиссия Первичные афферентные волокна в заднем корешке
- •Первичные афферентные волокна в спинном мозге
- •Терминалы первичных афферентов
- •Нейротрансмиттеры первичных аффекторов
- •Трансмиссионные клетки в спинном мозге Анатомия
- •Центральная гиперсенсибилизация, или нервное перевозбуждение
- •Восходящие ноцицептивные проводящие пути
- •Спиноталамический путь (стп)
- •Вентральный спиноталамический путь
- •Спинно-ретикулярный путь (срп)
- •Спинно-мезэнцефалический путь (смп)
- •Дорсальный столб постсинаптической спинно-медуллярной системы
- •Проприоспинальная мультисинаптическая восходящая система
- •Ростральные центры Ретикулярная формация
- •Таламус
- •Гипоталамус и лимбическая система
- •Кора мозга
- •Резюме по вопросам трансмиссии
- •Модуляция
- •Аналгезия, возникающая при стимуляции
- •Аналгезия, обеспечиваемая опиоидами
- •Анатомия нисходящей модулирующей системы Средний мозг
- •Продолговатый мозг
- •Кора и промежуточный мозг
- •Нейротрансмиттеры нисходящих проводящих путей Норадреналин
- •Серотонин
- •Эндогенные опиоиды
- •Резюме по вопросам модуляции
- •Пути контроля теории боли
- •Периферический отдел автономной нервной системы
- •Ганглии и сплетения периферического отдела автономной нервной системы
- •Эндокринные
- •Обменные
- •Обмен липидов
- •Стрессовые гормоны - это еще не результаты (некоторые предостережения)
- •Заключение
- •Структуры, расположенные в позвоночном канале Спинной мозг
- •Кровоснабжение позвоночного канала Артерии
- •Методы, вызывающие боль Турникетный болевой тест
- •Побочные действия
- •Гастропатия
- •Нспвп и преодоление боли в послеоперационном периоде
- •Опиоиды
- •Соотношение структуры и активности
- •Фармакодинамика Эндогенные опиоидныс пептиды
- •Опиоидные рецепторы
- •Классификация типов рецепторов и их предполагаемое действие
- •Связывание рецепторов и их реакция: истинная активность
- •Пути поступления препаратов
- •Проникновение к рецепторам
- •Фармакология Действие на центральную нервную систему
- •Гипнотическое действие опиоидов (в порядке снижения активности)
- •Метадон
- •Меперидин
- •Алкалоиды Морфин
- •Синтетические опиоиды Леворфанол (лево-дроморан)
- •Метадон (дольфин)
- •Смешанные агонист-антагонисты Налбуфин (нубаин)
- •Частичные агонисты Бупренорфин (бупренекс)
- •Пероральные антагонисты Налтрексон
- •Заключение
- •Список литературы
- •Соотношение рКд к процентному содержанию основных форм и время развития 50% проводникового блока в изолированном нерве
- •Факторы, влияющие на анестезиологическую активность
- •Дозировка
- •Добавки
- •Беременность
- •Фармакокинетика
- •Абсорбция
- •Распределение
- •Метаболизм и выведение
- •Токсичность
- •Общая токсичность
- •Токсичность для центральной нервной системы
- •Токсичность для сердечно-сосудистой системы
- •Различные системные эффекты
- •Аллергические реакции
- •Местное токсическое воздействие
- •Осложнения региональной анестезии
- •Эпидуральная анестезия
- •Уровень блокады
- •Доза препарата
- •Особенности локального анестетика
- •Дополнительное введение вазоконстрикторов
- •Волемическое состояние, объем циркулирующей крови
- •Спинальная анестезия
- •Препараты для локальной анестезии Препараты из группы аминоэфиров Кокаин
- •Прокаин (новокаин)
- •Хлоропрокаин
- •Тетракаин
- •Препараты из группы аминоамидов Лидокаин
- •Мепивакаин
- •Прилокаин
- •Бупивакаин
- •Этидокаин
- •Другие препараты Дибукаин
- •Бензокаин
- •Заключение
- •Список литературы
- •Внутривенная аналгезия, контролируемая пациентом Определение методов акп и параметры дозировок
- •Инфузионная технология акп
- •Характеристика прибора
- •Факторы, относящиеся к оценке акп-инфузоров
- •Безопасность
- •Неблагоприятные реакции и побочное действие
- •Проблемы, связанные с работой приборов (механические проблемы)
- •Взаимодействие прибора и пользователя
- •Образец (парадигма) акп
- •Непрерывная инфузионная аналгезия для преодоления острой боли
- •Индивидуализация требований аналгезии
- •Вопросы фармакокинетики
- •Факторы фармакодинамики
- •Психологические факторы
- •Подкожная аналгезия, контролируемая пациентом
- •Эпидуральная аналгезия, контролируемая пациентом
- •Заключение
- •Список литературы
- •Клиническое использование эпидурального введения опиоидов Механизм действия
- •Значение растворимости в липидах
- •Опиоиды; обычно используемые для эпидурального введения
- •Клиническая характеристика эпидуральных опиоидов (после однократной инъекции)
- •Наступление аналгезии
- •Продолжительность аналгезии
- •Ростральная миграция в цсж
- •Место инъекции
- •Интермитткрующие инъекции или продолжительные инфузии?
- •Опиоиды, обычно используемые для эпидуральных инфузий 1
- •Клиническая практика госпиталя Brigham и женского госпиталя
- •Показания к применению
- •Субарахноидальное введение опиоидов в клинике
- •Побочное действие спинальных опиоидов
- •Угнетение дыхания
- •Тошнота
- •Задержка мочи
- •Активация латентной герпетической инфекции
- •Угнетение функции желудочно-кишечного тракта
- •Неврологические эффекты
- •Мониторинг
- •Заключение
- •Список литературы
- •Балансированная аналгезия
- •Эпидуральное введение локальных анестетиков
- •Влияние эпидуральной блокады на сердечно-сосудистую систему
- •Интермиттирующие инъекции
- •Продолжительные инфузии
- •Тахифилаксия
- •Общие сведения
- •Механизм тахифилаксии
- •Гипотетические механизмы тахифилаксии при эпидуральном введении локальных анестетиков
- •Клинические особенности эпидуральной анестезии при комбинации локальных анестетиков и опиоидов Синергизм аналгезии
- •Клинические особенности совместного назначения локальных анестетиков и опиоидов
- •Угнетение тахифилаксии
- •Угнетение центральной гиперсенсибилизации: концепция преимущественной аналгезии
- •Угнетение ноцицептивной трансмиссии: афферентный «барраж»
- •Продолжительность действия
- •Клинические исследования
- •Совместное эпидуральное применение локальных анестетиков и опиоидов
- •Эпидуральные инфузии локальных анестетиков и опиоидов: клиническая практика госпиталя -brigham и женского госпиталя
- •Комбинации локальных анестетиков и опиоидов для эпидуральной инфузии
- •Приготовление некоторых растворов для эпидурального введения
- •Выявление нарушений
- •Обычные проблемы, возникающие при проведении эпидуральной аналгезии
- •Осложнения и побочное действие
- •Заключение
- •Список литературы
- •Анатомия
- •Механизм действия
- •Методика Паховый параваскулярный метод
- •Противопоказания
- •Применение в клинике
- •Заключение
- •Список литературы
- •Анатомия
- •Симпатическая иннервация верхней конечности
- •Методика
- •Процедура Подмышечный подход
- •Межскаленный подход
- •Подключичный периваскулярный доступ
- •Подключичный (инфраклавикулярный) доступ
- •Выбор локального анестетика и его дозировка
- •Применение в клинике
- •Осложнения
- •Токсическое действие локальных анестетиков
- •Повреждение нерва
- •Заключение
- •Список литературы
- •Анатомия
- •Механизм действия
- •Методика Положение пациента и ориентиры
- •Выполнение процедуры
- •Возможные технические трудности
- •Варианты методики
- •Выбор локального анестетика и его дозировка
- •Интервалы между повторными введениями
- •Применение в клинике
- •Осложнения Недостаточная аналгезия
- •Пневмоторакс
- •Повреждение сосудов
- •Токсическое действие локального анестетика
- •Повреждение нерва
- •Заключение
- •Список литературы
- •Анатомия
- •Механизм аналгезии
- •Методика
- •Положение пациента и ориентиры
- •Выполнение процедуры
- •Выбор локального анестетика и его дозировка Концентрация бупивакаина
- •Объем вводимого раствора
- •Другие локальные анестетики
- •Адреналин
- •Интервалы между повторными введениями Интермиттирующие инъекции
- •Длительные внутриплевральные инфузий
- •Применение в клинике
- •Протокол по интермиттирующей дозировке препарата в случае установки внутриплеврального катетера
- •Применение в клинике внутриплевральной региональной аналгезии
- •Причины неэффективности внутриплевральной региональной аналгезии после операции торакотомии
- •Осложнения
- •Пневмоторакс
- •Токсическое действие локального анестетика
- •Противопоказания
- •Заключение
- •Список литературы
- •Анатомия
- •Механизм действия
- •Методика Положение пациента и ориентиры
- •Выполнение
- •Варианты методики
- •Выбор локального анестетика и интервалы между повторными введениями
- •Применение в клинике
- •Сообщения об аналгезии при использовании паравертебральной невральной блокады в грудном отделе
- •Осложнения
- •Список литературы
- •Анатомия
- •Методика
- •Мониторинг и подготовка
- •Положение пациента и ориентиры
- •Выполнение процедуры
- •Околосрединный подход
- •Подход по средней линии
- •Контроль проникновения в эпидуральное пространство
- •Потеря сопротивления
- •«Висящая капля»
- •Ощущение прокола желтой связки
- •Легкость введения катетера
- •Физиологические реакции
- •Выбор анальгетиков и их дозировка
- •Влияние эпидуральной аналгезии локальными анестетиками в грудном отделе на сердечно-сосудистую систему Снижение артериального давления
- •Ориентировочные дозы препаратов при торакальной эпидуральной аналгезии
- •Сегментарное распределение симпатической иннервации в грудопоясничном отделе
- •Потребность миокарда в кислороде
- •Применение в клинике
- •Осложнения Прокол твердой мозговой оболочки
- •Прокол вены
- •Парестезия
- •Задержка мочи
- •Тошнота
- •Седация
- •Гипотензия
- •Противопоказания Инфекция
- •Снижение сердечного резерва
- •Заключение
- •Список литературы
- •Система свертывания крови и ее физиологическая оценка
- •Эпидуральная гематома
- •Клинические признаки и патофизиология
- •Эпидуральная гематома после субарахноидальной пункции
- •Эпидуральная гематома после эпидуральной анестезии
- •Клинические сообщения, демонстрирующие безопасность региональной анестезии у больных, применявших антикоагулянты
- •Региональная анестезия/аналгезия у больного в состоянии антикоагуляции: ориентиры для критического решительного анализа
- •Спинальное введение опиоидов перед кардиопульмональным шунтированием
- •Предоперационная оценка
- •Подкожное введение гепарина («мини-дозы»)
- •Нестероидные противовоспалительные препараты
- •Ведение больного в операционном и послеоперационном периодах
- •Сроки сохранения факторов свертывания в плазме
- •Послеоперационный мониторинг
- •Заключение
- •Список литературы
- •Историческая справка
- •Механизм действия
- •Технические аспекты
- •Продолжительность импульса
- •Постоянный поток или постоянный вольтаж
- •Форма волн
- •Частотность
- •Амплитуда
- •Установка электродов и множественные каналы стимуляции
- •Электроды
- •Сроки стимуляции
- •Побочное действие
- •Противопоказания
- •Эффективность чэсн в послеоперационном периоде: обзор литературы Методологические аспекты
- •Абдоминальная хирургия
- •Предварительные клинические исследования по чэсн
- •Ортопедические операции
- •Акушерские операции
- •Операции на сердце и на органах грудной клетки
- •Состояние после ампутации
- •Ориентировочные показания по использованию чэсн в послеоперационном периоде
- •Пациенты, у которых ожидается улучшение от чэсн
- •Рекомендуемая установка электродов и параметры стимулирования при проведении чэсн
- •Заключение
- •Список литературы
- •Психосоциальный контекст послеоперационной боли
- •Анальгетические вмешательства нехимиотерапевтического характера
- •Обучение
- •Введение в транс
- •Погружение в транс
- •Гипнотическая работа
- •Завершение
- •Релаксационная реакция
- •Достижение релаксационной реакции
- •Заключение
- •Список литературы
- •Предоперационные факторы и подготовка
- •Оценка степени выраженности боли Боль у ребенка, не умеющего говорить
- •Оценка степени боли
- •Терапевтические возможности преодоления послеоперационной боли в педиатрии
- •Системные анальгетики Анальгетики неопиоидного типа
- •Послеоперационные режимы назначения морфина методом акп
- •Опиоиды
- •Режимы дозировок в педиатрии при региональной анестезии/аналгезии
- •Пути введения Энтеральная аналгезия
- •Внутримышечное введение
- •Интермиттирующее внутривенное введение опиоидов
- •Продолжительное внутривенное введение опиоидов
- •Аналгезия, контролируемая пациентом (акп)
- •Региональная анестезия/аналгезия
- •Каудальный блок
- •Эпидуральная аналгезия в поясничном и грудном отделах
- •Блокада подвздошно-пахового и подвздошно-подчревного нервов
- •Блокада дорсального нерва полового члена
- •Блокада бедренного и бокового кожного нервов бедра
- •Блокада отсека подвздошной фасции
- •Внутриплевральная региональная аналгезия
- •Инфильтрационная аналгезия операционной раны
- •Заключение
- •Список литературы
- •Послеродовое разрешение физиологической адаптации периода беременности
- •Физиологическая адаптация во время беременности
- •Анальгетические возможности Внутримышечное введение опиоидов
- •Внутривенное введение опиоидов
- •Эпидуральное введение опиоидов
- •Режимы дозировки эпидурально и суб-арахноидально вводимых опиоидов для аналгезии после кесарева сечения
- •Меперидин
- •Фентанил
- •Суфентанил
- •Буторфанол
- •Бупренорфин
- •Сочетанное применение препаратов
- •Субарахноидальное введение опиоидов
- •Фентанил
- •Суфентанил
- •Эпидуральное введение клофелина
- •Аналгезия опиоидами и грудное вскармливание
- •Выбор аналгезии после кесарева сечения
- •Список литературы
- •Аналгезия после некоторых ортопедических операций Артропластика и протезирование тазобедренного сустава
- •Влияние региональной анестезии на показатели смертности после операции артропластики тазобедренного сустава
- •Аналгезия, контролируемая пациентом (акп)
- •Субарахноидальное введение опиоидов
- •Эпидуральное введение опиоидов и локальных анестетиков
- •Субарахноидальное введение опиоидов при артропластике и протезировании коленного и тазобедренного суставов
- •Операции со вскрытием коленного сустава
- •Общее назначение опиоидов
- •Субарахноидальное введение опиоидов
- •Эпидуральное введение опиоидов
- •Эпидуральное введение локального анестетика
- •Комбинированная аналгезия
- •Невральная блокада поясничного сплетения
- •Клиническая практика госпиталя Brigham и женского госпиталя
- •Артроскопия коленного сустава Внутрисуставное введение бупивакаина
- •Внутрисуставное введение морфина
- •Артропластика плечевого сустава Аналгезия, контролируемая пациентом (акп)
- •Блокада плечевого сплетения
- •Эпидуральная анестезия/аналгезия в области шеи
- •Ампутация
- •Открытое вправление и внутренняя фиксация переломов лодыжки
- •Невральная блокада седалищного нерва в подколенной области
- •Заключение
- •Список литературы
- •Физиологические нарушения после операций на грудной полости
- •Причины нарушений функции дыхания после торакотомии
- •Методы аналгезии Парентеральное введение опиоидов
- •Межреберная невральная блокада
- •Внутриплевральная региональная аналгезия
- •Паравертебральная невральная блокада
- •Криоаналгезия
- •Чрескожная электростимуляция нерва
- •Субарахноидальное введение опиоидов
- •Эпидуралыюе введение локальных анестетиков и опиоидов Введение локальных анестетиков
- •Введение опиоидов
- •Установка эпидурального катетера в грудном или поясничном отделе
- •Комбинированное применение локальных анестетиков и опиоидов
- •Влияние на дыхание
- •Порядок ведения торакальной эпидуральной аналгезии после торакотомии
- •Порядок ведения торакальной эпидуральной аналгезии комбинацией локального анестетика и опиоида
- •Рекомендации по дозировке препаратов при торакальной эпидуральной аналгезии
- •Особые проблемы аналгезии после торакотомии
- •Заключение
- •Список литературы
- •Патофизиология послеоперационной абдоминальной боли
- •Кожная соматическая боль
- •Сенсибилизация ноцицепторов
- •Глубокая соматическая боль
- •Висцеральная боль Трансдукция
- •Трансмиссия
- •Иррадиирующая боль
- •Предполагаемые механизмы иррадиирующей боли
- •Последовательные рефлекторные реакции
- •Кортикальные реакции
- •Физиологические нарушения после операций на брюшной полости Нарушения функции легких
- •Осложнения со стороны желудочно-кишечного тракта
- •Тромбоэмболия
- •Аналгезия при некоторых вмешательствах на брюшной полости
- •Операции на верхнем отделе брюшной полости Нестероидные противовоспалительные препараты
- •Аналгезия, контролируемая пациентом
- •Межреберная невральная блокада
- •Внутриплевральная региональная аналгезия
- •Влияние внутриплевральной региональной аналгезии (впа) в сочетании с обычным введением опиоидов на обезболивание и на легочную функцию после операции холецистэктомии
- •Субарахноидальное введение опиоидов
- •Эпидуральное введение локальных анестетиков и опиоидов
- •Операции на нижнем отделе брюшной полости
- •Аппендэктомия
- •Операции на толстом кишечнике
- •Влияние эпидуральной анестезии/аналгезии на двигательную активность желудочно-кишечного тракта
- •Опорожнение желудка и подвижность тонкого кишечника
- •Моторика толстого кишечника
- •Заключение
- •Список литературы
- •Два мнения: аналгезия против диагностики
- •Физиологические нарушения, связанные с травмой
- •Возможности аналгезии Парентеральное назначение анальгетиков
- •Региональная анестезия/аналгезия
- •Подкожная инфильтрационная анестезия
- •Инфильтрационная анестезия
- •Фоновая блокада
- •Периферическая невральная блокада
- •Блокада сплетения
- •Внутриплевральная региональная аналгезия
- •Эпидуральная аналгезия
- •Субарахноидальная аналгезия
- •Травмы головы
- •Травмы грудной клетки
- •Повреждения скелета
- •Заключение
- •Список литературы
- •Коммуникация
- •Врачебный вклад
- •Концепция «глобального гонорара»
- •Администрация Департамент управления
- •Администрация госпиталей
- •Приобретение оборудования
- •Маркетинг
- •Заключение
- •Список литературы
- •Формирование эффективно работающих бригад по устранению боли: общий и женский госпиталь brigham
- •Группа задач, связанных с акп
- •Распределение препаратов
- •Участие медицинских сестер в переориентировке целей
- •Объекты проведения целевых усилии
- •Альтернативные методы контроля боли
- •Поза, позиционная установка
- •Сон, релаксация
- •Тошнота, рвота
- •Устранение боли дополнительное руководство по аналгезии, контролируемой пациентом
- •Общая информация:
- •Критерии акп Предлагаемые критерии акп совместно с лечением
- •Аналгезия, контролируемая пациентом
- •Общие указания Обучение пациента/родственников
- •Сестринский департамент госпиталя Протокол анестезии, контролируемой пациентом Реабилитационное отделение
- •Сестринский департамент госпиталя Соображения в случаях неадекватности аналгезии
- •Сестринский департамент госпиталя Инструкция по титрованию и введению «спасительной» дозы при акп-плюс
- •Сестринский департамент госпиталя Инструкция по титрованию и по введению «спасительной» дозы при акп-плюс
- •Список литературы
- •Персональный фактор
- •Анестезиолог
- •Сестринская помощь
- •Фармакологическая служба
- •Приготовление некоторых растворов для эпидурального введения
- •Оборудование
- •Основные требования, предъявляемые к эпиду-ральным инфузионным системам
- •Простота и легкость в обращении
- •Ограничитель скорости потока
- •Четкость в идентификации прибора (обозначение)
- •Вход для инъекций
- •Безопасность
- •Портативность
- •Мониторы
- •Процедуры, проводимые службой острой боли
- •Документация
- •Рабочий документ службы по борьбе с острой болью Служба лечения боли bwh отделение анестезиологии
- •Типичный лист стандартных назначений для пациента, получающего акп Общий и женский госпиталь Brigham Учебный филиал медицинского университета Гарварда
- •Проблемы, стоящие перед службой острой боли
- •Проблемы, стоящие перед соб
- •Список литературы
- •Молекулярная фармакология
- •Нейроэндокринная система
- •Сердечно-сосудистая система
- •Дыхательная система
- •Пищеварительная система
- •Центральная нервная система
- •Механизм аналгезии
- •Клинические исследования аналгезии Общее назначение
- •Эпидуральное назначение
- •Субарахноидальное введение
- •Заключение
- •Список литературы
- •Послеоперационная боль
- •101000, Москва, Петроверигский пер., 6/8
- •143200, Г. Можайск, ул. Мира, 93.
Пероральные антагонисты Налтрексон
Налтрексон в отличие от налоксона весьма эффективен при назначении внутрь и оказывает выраженное антагонистическое в отношении опиоидов действие на протяжении 24 ч. Препарат выпускают в таблетках по 50 мг и применяют при лечении морфинистов [308].
Заключение
Опиоиды, помимо их местного обезболивающего и нестероидного противовоспалительного действия, служат фармацевтической основой эффективного преодоления послеоперационной боли. Читатель, особенно анестезиолог, может удивиться, что при обсуждении опиоидов минимальное внимание было уделено их парентеральному или спинальному (эпидуральному и субарахноидальному) путям введения. Однако философские принципы авторов этой книги заключаются в том, что практический врач, устраняющий послеоперационные боли (можно сказать, анестезиолог), должен быть полноценным специалистом. Преодоление послеоперационной боли продолжается после прекращения сложных инвазивных вмешательств. Это требует совершенных, а не поверхностных знаний по фармакологии опиоидов. Цель данной главы – обеспечить врачей подобными знаниями.
Список литературы
1. Tainter ML: Pain. Ann NY Acad Sci 51 :3, 1948
2. Macht DI: The history of opium and some of its preparations and alkaloids. JAMA 46:477, 1915
3. Thorpe DH: Opiate structure and activity-a guide to understanding the receptor. Anesth Analg 63:143, 1984
4. Braenden OJ, Eddy NB, Hulbach H: Synthetic substances with morphine-like effect; relationship between chemical structure and analgesic action. Bull WHO 13:937, 1955
5. Janssen PAJ: A review of the chemical features associated with strong morphinelike activity. Br J Anacsth 34:260, 1962
6. Beckett АН, Casey AF: Synthetic analgesics, stereochemical considerations. J Pharm Pharmacol 6:986, 1954
7. Fields HL: Central nervous system mechanisms for control of pain transmission, p. 99. In: Pain. McGraw-Hill, New York, 1987
8. Ley sen JE, Gommeren W. Niemegeers CJ: j^HJSufentanil, a superior ligand for mu-opiate ) receptors: binding properties and regional distribution in rat brain and spinal cord. Eur J Pharmacol 87:209, 1983
9. Kosterlitz HW: Opiate actions in guinea pig ileum and mouse vas deferens. Neurosci Res Program Bull 13:68, 1975
10. Martin WR, Fades CG, Thompson J A et al'. The effects of morphine- and nalorphine-like drugs in the nondcpendent and morphine-dependent chronic spinal dog. J Pharmacol Exp Ther 197: 517, 1976
11. Gilbert PE. Martin WR: The effects of morphine- and nalorphine-like drugs in the nondcpendent, morphine-dependent and cyclazocinc-depcndcnt spinal dog. J Pharmacol Exp Ther 198:66, 1976
12. Maze M: Clinical implications of membrane receptor function in anesthesia. Anesthesiology 51:160, 1980
13. Vaught JL, Rothman RB. West/nil TC: Mu and delta receptors: their role in analgesia and in the differential effects of opiod peptides on analgesia. Life Sci 30:1443, 1982
14. Pasternack GW, Wood PJ: Multiple mu opiate receptors. Life Sci 38:1889, 1986
15. Pasternack GW: Multiple morphine and enkephalin receptors and the relief of pain. JAMA 259:1362, 1988
16. Goodman RR, Snyder SH, Kuhar MJ et til: Differentiation of delta and mu opiate receptor localizations by light microscopic autoradiography. Proc Nati Acad Sci USA 77:6239, 1988
17. Duka T, Schubert P. Wuster M et al: A selective distribution pattern of different opiate receptors in certain areas of rat brain as revealed by in vitro autoradiography. Neurosci Lett 21 :119, 1981
18. Quirion R. Zajac JM, Morqat JL et al: Autoradiographic distribution of mu- and delta-opiate receptors in rat brain using highly selective ligands. Life Sci, suppl. 1, 33:227, 1983
19. Wood PL, Richard J W, Thakur M: Mu-opiate isoreceptors: differentiation with kappa agonists. Life Sci 31:2313, 1982
20. Pasternak GW, Chiider SR, Snyder SH: Opiate analgesia: evidence for mediation by a sub-population of opiate receptors. Science 208:514, 1980
21. Nishimura SL, Rechf LD. Pasternak GW: Biochemical characterization of high affinity -^H-opioid binding: further evidence for mUi sites. Mol Pharmacol 25:29, 1984
22. Pasternak GW, Chiider SR, Snyder RH: Naloxazone, a long-acting opiate antagonist: effects in intact animals and on opiate receptor binding in vitro. J Pharmacol Exp Ther 214:455, 1980
23. Yaksh TL: Analgesic actions of intrathecal opiates in cats and primates. Brain Res 153 :205, 1978
24. Yaksh TL: In vivo studies on spinal opiate receptor systems mediating antinociccption: I. Mu-and delta-receptor profiles in the primate. J Pharcacol Exp Ther 226:303, 1983
25. Yaksh TL. Huang SP. Rudy ТА el al: The direct and specific opiate-like effect of met-enkaphalin and analogs on the spinal cord. Neuroscience 2:593, 1977
26. Moiilin DE, Max M. Kaiko RF: The analgesic efficacy of intralhecal (IT) [o-Ala2, D-Leu5] enkephalin in cancer patients with chronic pain. Pain 23:213, 1985
69. Martin WR: Pharmacology of opioid. Pharmacol Rev 35:283, 1967
70. Bellville JW. Seed J С: The effect of drugs on the respiratory response to carbon dioxide. Anesthesiology 21:727, 1960
71. EckenoffJE. Oech SR: The effects of narcotics and antagonists upon respiration and circulation in man. Clin Pharmacol Ther 1:483, 1960
72. Jaffe JH, Martin WR: Opioid analgesics and antagonists, p. 491. In Gilman AG, Goodman LS, Rail TW, Murad F (eds): The Pharmacological Basis of Therapeutics, 7th Ed. MacMillan, New York, 1985
73. Kitahata LM. Collins JG. Robinson CJ: Narcotic effects on the nervous system, p. 57. In Kitahata LM, Collins JG (eds): Narcotic Analgesics in Anesthesiology. William & Wilkins, Baltimore, 1982
74. Murphy MR. Hug CC Jr: The ennurance sparing effect of morphine, butorphanol and
nalbuphine. Anesthesiology 57:489, 1982
75. Freye E: The various effects caused by opioids. p. 27. In: Opioid Agonists Antagonists and Mixed Narcotic Analgesics: Theoretical Background and Considerations for Practical Use. Springer-Verlag, Berlin, 1987
76. Bovill JG, Sehel PS, Wauquier A et al: Electroencephalographic effects of sufentanil anaesthesia in man. Br J Anaesth 54:45, 1982
77. World Health Organization: Expert committee on drug dependence, 16th report. Technical report series no. 407. World Health Organization, Geneva, 1969
78. Porter J, Jick J: Addiction is rare in patients treated with narcotics. N Engi J Med 302:123, 1980
79. Taub A: Opioid analgesics in the treatment of chronic intractable pain of nonneoplastic origin. p. 199. In Kitahata LM, Collins JD (eds): Narcotic Analgesics in Anesthesiology. William & Wilkins, Baltimore, 1982
80. Portenoy RK. Foley FM: Chronic use of opioid analgesics in non-malignant pain: report of 38 cases. Pain 25:171, 1986 .
81. Robins LN. Davis DH, Nurco DN: How permanent was Vietnam drug addiction/ Am J Pub Health 64:38, 1974
82. Biirks TF: Gastrointestinal pharmacology. Annu Rev Pharmacol Toxicol 16:15, 1976
83. Porreca F, Burks TF: The spinal cord as a site of opioid effects on gastrointestinal transit in the mouse. J Pharmacol Exp Ther 227:22, 1983
84. McCammon RL. Stoelting RK, Madura J A: Effects of butorphanol, nalbuphine, and fentanyl on intrabiliary tract dynamics. Anesth Analg 63: 139, 1984
85. Humphreys HK, Fleming NW: Opioid-induced spasm of the sphincter of Oddi apparently reversed by nalbuphine. Anesth Analg 74:308, 1992
86. Reitan JA, Stengert KB. Wymore MC et al: Central vagal control of fentanyl induced bradycardia during halothane anesthesia. Anesth Analg 57:31, 1978
87. Laubie M, Schmitt H. Vincent M: Vagal bradycardia produced by microinjections of morphine-like drugs into the nucleus ambiguus in anesthetized dogs. Eur J Pharmacol 59:287, 1979
88. Liu WS. Bidwai AV. Stanley TH et al: Cardiovascular dynamics after large doses of fentanyl and fentanyl plus N^O in the dog. Anesth Analg 55:168, 1976
89. Strauer BE: Contractile responses to morphine, piritramide, meperidine and fentanyl: a comparative study of effects on the isolated ventricular myocardium. Anesthesiology 37:304, 1972
90. Freve E: Cardiovascular effects of high doses of fentanyl, meperidine and naloxone in dogs. Anesth Analg 53:40, 1974
91. Barash P. Kopriva С, Giles R et al: Global ventricular function and intubation: radionuclear profiles, abstracted. Anesthesiology 53:A109, 1980
92. Goldberg АН, Padget CH: Comparative effects of morphine and fentanyl on isolated heart muscle. Anesth Analg 48:978, 1969
93. Lowenstein E. Whiting RB, Bittar DA: Local and neurally mediated effects of morphine on skeletal muscle vascular resistance. J Pharmacol Exp Ther 180:359, 1972
94. Ward JW, McGrath RL, Weil JV: Effects of morphine on the peripheral vascular response to sympathetic stimulation. Am J Cardiol 29:656, 1972
95. Rosow СЕ, Moss I, Phi/bin DM el al: Histamine release during morphine and fentanyl anesthesia. Anesthesiology 56:93, 1982
96. Flacke JW, Flacke WE, Boor ВС et al: Histamine release by four narcotics: a double-blind study in humans. Anesth Analg 66:723, 1987
97. Murphy MR. Hug CC Jr: Pharmacokinetics of intravenous morphine in patients anesthetized with enflurane-nitrous oxide. Anesthesiology 54:187, 1981
98. Stunski DR, Greenblatt DJ, Lowenstein E: Kinetics of intravenous and intramuscular morphine Clin Pharmacol Ther 24:52, 1978
99. Brunk SF, Delle M: Morphine metabolism in man. Clin Pharmacol Ther 16:51, 1974
100. Hug CC, Murphy MR. Rigel EP. Olson WA: Pharmacokinetics of morphine injected intra-venously into the anesthetized dog. Anesthesiology 54:38, 1981
101. Aitkenhead AR, Vater M. Acholas К et al: Pharmacokinetics of single-dose I.V. morphine in normal volunteers and patients with end-stage renal failure. Br J Anaesth 56:813, 1984
102. Way EL, Adier TK: The pharmacologic implications of the fate of morphine and its surrogates Pharmacol Rev 12:383, 1960
103. Boerner U, Abbott S, Roe RL: The metabolism of morphine and heroin in man. Drug Metab Rev 4:39, 1975
104. Shimomura E, Kamata O, Ueki S: Analgesic effects of morphine glucuronides. Tohoku J Exp Med 105:45, 1971
105. Brunk SF, Dell M, Wilson MR: Morphine metabolism in man: effect of aspirin. Clin Pharmacol Ther 15:283, 1974
106. Sawe J, Svensson JO, Odar-Cederlof I: Kinetics of morphine in patients with renal failure Lancet i:211, 1985
107. Patwardhan RV, John.wn RF. Hoyump A et ul: Normal metabolism of morphine in cirrhosis Gastroenterology 81:1006, 1981
108. Lciidlaw J, Read A E, Sherlock S: Morphine tolerance in hepatic cirrhosis. Gastroenterologv 40:389, 1961
109. Woolner DF, Winter D, Frendin TJ et al: Renal failure does not impair the metabolism of morphine. Br J Clin Pharm 22:55, 1986
110. McQuay HJ, Moore RA: Be aware of renal function when prescribing morphine. Lancet ii • 284 1984
111. Mostert JW, Evers JL, Hobika GH et al: Cardiorespiratory effects of anaesthesia with morphine or fentanyl in chronic renal failure and cerebral toxicity with morphine. Br J Anaesth 43:1053, 1971
112. Don HF, Dieppa RA, Taylor P: Narcotic analgesics in anuric patients. Anesthesiology 42-745 1975
113. Barnes JN, Goodwin FJ: Dihydrocodeine narcosis in renal failure. Br Med J (Clin Res Ed) 286:438, 1983
114. Redfern N: Dihydrocodeine overdose treated with naloxone infusion. Br Med J (Clin Res Ed) 287:751, 1983
115. Twycross RG, Lack S A: Symptom Control in Far Advanced Cancer: Pain Relief. Pitman London, 1983
116. Misra AL: Metabolism of opiates, p. 297. In Adier ML, Maanara L, Samanin R (eds): Factors Affecting the Action of Narcotics. Raven Press, New York, 1978
117. Sevelius H, McCoy JF, Colmore JP: Dose response to codeine in patients with chronic cough. Clin Pharmacol Ther 12:449, 1971
118. Cooper SA, Beaver WT: A model to evaluate mild analgesics in oral surgery outpatients Clin Pharmacol Ther 20:241, 1976
119. Intwrisi СЕ, Мах MB, Foley FM: The pharmacokinetics of heroin in patients with chronic pain N Engi J Med 310:1213, 1984
120. Twycross RG, Wald SJ: Long term use of diamorphine in advanced cancer, p. 653. In Bonica JJ, Albe-Fessard DG (eds): Advances in Pain Research and Therapy. Vol. 1. Raven Press, New York,
1976
121. Mahler DL, Forresi WH, Jr: Relative analgesic potencies of morphine and hydromorphone in postoperative pain. Anesthesiology 42:602, 1975
122. Наппа С, Mazuzan JE Jr, Abajian J, Jr: An evaluation of dihydromorphonc in treating postoperative pain. Anesth Analg 41:755, 1962
123. McKenzie R: Pharmacologic developments: nalbuphine hydrochloride and hydromorphone. In Ferrante FM, Osthcimer GW, Covino BG (eds): Patient-Controlled Analgcsia. Blackwell Scientific, Boston, 1990
124. Hill HF, Coda BA. Akira T. Schaffer R: Multiple-dose evaluation of intravenous hydromorphone pharmacokinetics in normal human subjects. Anesth Analg 72:330, 1991
125. Ritschel WA, Parah PV, Denson DD et al: Absolute bioavailability of hydromorphone after peroral and rectal administration in humans: saliva/plasma ratio and clinical effects. J Clin Pharmacol 27:647, 1987
126. Parab PV, Ritschel WA, Coyle DE et ad: Pharmacokinetics of hydromorphone after intravenous, peroral and rectal administration to human subjects. Biopharm Drug Dipos 9:187, 1988
127. Sinatra RS, Harrison DM: A comparison of oxymorphone and fentanyl as narcotic supplements in general anesthesia. J Clin Anesth 1 :253, 1989
128. Beaver WT, Wallenstein SL, Houde RW. Rogers A: Comparisons of the analgesic effects of oral and intramuscular oxymorphone and of intramuscular oxymorphone and morphine in patients with cancer. J Clin Pharmacol 17:186, 1977
129. Hermens JM, EhertzJM, HanifinJM, Hirschman С A: Comparison of histamine release in human mast cells induced by morphine, fentanyl and oxymorphone. Anesthesiology 62:124, 1985
130. Robinson EP, Faggella AM, Henry DP, Russell WP: Comparison of histamine release induced by morphine and oxymorphone administration in dogs. Am J Vet Res 49:1699, 1988
131. Loew GH, Berkowitz DS: Quantum chemical studies at N-substituent variation in the oxymorphone scries of opiate narcotics. J Med Chem 21 :101, 1978
132. Ronai AZ. Foldes FF, HahnEF, Fishmun J: Orientation of the oxygen atom at C-6 as a determinant of agonistic activity in the ohymorphone series. J Pharmacol Exp Ther 200:496, 1977
133. HahnEF, Itzhak Y, Nishimura S et al: Irreversible opiate agonists and antagonists. HI. Phcnylhydrazone derivatives of naloxone and oxymorphone. J Pharmacol Exp Ther 235:846, 1985
134. Botros S. Lipkowski A W, Larson DL et al: Opioid agonist and antagonist activities of peripherally selective derivatives of naltrexamine and oxymorphamine. J Med Chem 32:2068, 1989
135. Cone EJ. Darwin WD, Buchwald WF, Gorodetzky CW: Oxymorphone metabolism and urinary excretion in human, rat, guinea pig, rabbit and dog. Drug Metab Dispos 11:446, 1983
136. White PF: Subcutaneous-PCA: an alternative to IV-PCA for postoperative pain management. Clin J Pain 6:297, 1990
137. Sinatra R, Chung KS, Silverman DG et al: An evaluation of morphine and oxymorphone administered via patient-controlled analgesia (PCA) or PCA plus basal infusion in postcesarean-delivery patients. Anesthesiology 71:502, 1989
138. Sinatra RS, Lodge K, Sibert К et al: A comparison of morphine, meperidine, and oxymorphone as utilized in patient-controlled analgesia following cesarean delivery. Anesthesiology 70:585, 1989
139. Sinatra RS, Harrison DM: Oxymorphone in patient-controlled analgesia. Chn Pharm 8:541, 1989
140. August BJ, Blake J A, Rogers NJ, Hussain MA: Transdermal oxymorphone formulation development and methods for evaluating flux and lag times for two skin permeation-enhancing vehicles. J Pharm Sci 79: 1072, 1990
141. Beaver WT, Feise GA: A comparison of the analgesic effect of oxymorphone by rectal suppository and intramuscular injection in patients with postoperative pain. J Clin Pharmacol 17:276, 1977
142. Cone EJ. Darwin WD, Gorodetzky CW. Tan T: Comparative metabolism of hydrocodone in man, rat, guinea pig, rabbit and dog. Drug Metab Dispos 6:488, 1978
143. Park Jl, Nakamura GR, Griesemer EC, Noguchi TT: Hydromorphone detected in bile following hydrocodone ingcstion. J Forensic Sci 27:223, 1982
144. Beaver WT: Combination analgesics. Am J Med 77:38, 1984
145. Maruta T, Swanson DW, F inlay son RE: Drug abuse and dependency in patients with chronic pain. Mayo Clin Proc 54:241, 1979
146. Poyhia R. Oikkola KT. Seppala T, Kalso E: The pharmacokinetics of oxycodone after intravenous injection in adults. Br J Clin Pharmacol 32:516, 1991
147. Weinstein SH, Gay-lord J С: Determination of oxycodone in plasma and identification of a major metabolite. J Pharm Sci 68:527, 1979
148. Tien JH: Transdermal-controlled administration of oxycodone. J Pharm Sci 80:741, 1991
149. Dixon R, Crews T, Mochacsi Eel ah Levorphanol: radioimmunoassay and plasma concentration profiles in dog and man. Res Commun Chem Pathol Pharmacol 29:535, 1980
150. Dixon R, Crews T, Inturrisi C, Foley K: Levorphanol: pharmacokinetics and steady-stale plasma concentrations in patients with pain. Res Commun Chem Pathol Pharmacol 41 :3, 1983
151. Portenoy RK, Moulin DE, Rogers A et al: I.V. infusion ofopioids for cancer pain: clinical review and guidelines for use. Cancer Treat Rep 70:575, 1986
152. Mother LE. Tucker GT: Systemic availability of orally administered meperidine. Clin Pharmacol Ther 20:535, 1976
153. Austin KL, Stapleton JV, Mother LE: Multiple intramuscular injections: a major source of variability in analgesic response to meperidine. Pain 8:47, 1980
154. Kosku AJ, Kramer WG, Romagnoli A et al: Pharmacokinetics of high-dose meperidine in surgical patients. Anesth Analg 60:8, 1981
155. Mother LE, Tucker GT, Pflug AE et al: Meperidine kinetics in man. Clin Pharmacol Ther 17-21 1975 ' '
156. Burns JJ, Berger BL, Lie)f PA et al: The physiological disposition and fate of meperidine (Demerol) in man and a method for its estimation in plasma. J Pharmacol Exp Ther 16:667, 1979
157. Mother LE, Gourlay GK: Biotransformation of opioids: significance for pain therapy, p. 31. In Nimmo WS, Smith G (eds): Opioid Agonist/Antagonist Drugs in Clinical Practice. Excerpta Medica, Amsterdam, 1984
158. Inturrisi СЕ, Umans JG: Pethidinc and its active metabolite, norpethidine. Clinics Anesthesiol 1:123, 1983
159. Verbeeck RK, Branch RA, Wlkinson GR: Meperidine disposition in man: influence of urinary pH and route of administration. Clin Pharmacol Ther 30:619, 1981
160. Armstrong PJ, Berslen A: Normeperidine toxicily. Anesth Analg 65:536, 1986
161. Kaiko RR, Foley KM, Grabinski et al: Central nervous system excitatory effects ofnormeperidine in cancer patients. Ann Neurol 13:180, 1983
162. Szeto HH, Inturrisi СЕ, Hondo R el al: Accumulation ofnormeperidine, an active metabolite of meperidine, in patients with renal failure or cancer. Ann Intern Med 86:738, 1977
163. Pond SM, Tong T, Benowitz NL et al: Presystemic metabolism of meperidine to normeperidine in normal and cirrhotic subjects. Clin Pharmacol Ther 30:183, 1981
164. Radney PA. Brodman E, Munkikar D, Duncalf D: The effect of equi-analgesic doses of fentanyl, morphine, meperidine and pentazocine on common bile duct pressure. Anaesthetist 29:26, 1980
165. Marks RM. Sachar EJ: Undertrealment of medical inpatients with narcotic analgesics. Ann Intern Med 78:173, 1973
166. Lasagna L, Beecher HK: The optimal dose of morphine. JAMA 156:230, 1954
167. Stapleton JV, Austin KL, Mother LE: A pharmacokinetic approach to postoperative pain:
continuous infusion of pethidine. Anaesth Intensive Care 7:25, 1979
168. Tamsen A. Hartvig P, Fagerlund С, Dahlstrdm В: Patient-controlled analgesic plasma concentrations of pethidine in postoperative pain. Clin Pharmacokinet 7:164, 1982
169. Tamsen A, Sakurada T, Wahlstrom A et al: Postoperative demand for analgesics in relation to individual levels of endorphins and substance P in ccrebrospinal fluid. Pain 13:171, 1982
170. Castro J, van de Water A, Woulers L et al: Comparative study of cardiovascular, neurologic and metabolic side effects of eight narcotics in dogs. Acta Anaesthcsiol Beig 30:5, 1979
171. Hug CC, Murphy MR: Tissue redistribution of fentanyl and termination of its effects in rats Anesthesiology 55:369, 1981
172. Murphy MR, Olson WA. Hug CC: Pharmacokinetics of ЗН-fenlanyl in the dog anesthetized with enflurane. Anesthesiology 50:13, 1979
173. McClain DA. Hugg CC: Intravenous fentanyl kinetics. Clin Pharmacol Ther 22:106, 1980
174. Corall IM, Moore AR, Strumin L: Plasma concentrations of fentanyl in normal surgical patients and those with severe renal and hepatic disease. Br J Anaesth 52: 101, 1980
175. Haberer JP, Schoeffler P. Couderc E, Duvaldestin P: Fentanyl pharmacokinetics in anesthetized patients with cirrhosis. Br J Anaesth 54:1267, 1982
176. Hudson RJ. Thomson 1R, Cannon JE et al: Pharmacokinetics of fentanyl in patients undergoing abdominal aortic surgery. Anesthesiology 64:334, 1986
177. Singleton MA, Rosen JI. Fisher DM: Pharmacokinetics of fentanyl in the elderly. Br J Anaesth 60:619, 1988
178. Bennett GM, Stanley TH: The cardiovascular effects of fentanyl during enflurane anesthesia in man. Anesth Analg 58:179, 1979
179. Streisand JB, Varvel J R. StanskiDR et al: Absorption and bioavailability of oral transmucosal fentanyl citrate. Anesthesiology 75:223, 1991
Fold LH, Champeau MW. van Steenis С A, Scott JC: Preanesthctic medication in children:
a comparison of oral transmucosal fentanyl citrate versus placebo. Anesthesiology 71:374, 1989
181. Friesen RH, Lockhart CH: Oral transmucosal fentanyl citrate for preanesthetic medication of pediatric day surgery patients with and without dropcridol as a prophylactic anti-emetic. Anesthesiology 76:46, 1992
182. Ashburn MA, Fine PG, Stanley TH: Oral transmucosal fentanyl citrate for the treatment of breakthrough cancer pain: a case report. Anesthesiology 71 :615, 1989
183. Fine PG, Marcus M, De Boer AJ et al: An open label study of oral transmucosal fentanyl citrate (OTEC) for the treatment of breakthrough cancer pain. Pain 45:149, 1991
184. Goldstein-Dresner MC, Davis PJ, Kretchman E et al: Double-blind comparison of oral transmucosal fentanyl citrate with oral meperidine, diazepam, and atropinc as preanesthetic medication in children with congenital heart disease. Anesthesiology 74:28, 1991
185. Nelson PS, Streisand JB, Mulder SM et al: Comparison of oral transmucosal fentanyl citrate and an oral solution of meperidine, diazepam, and atropine for premedication in children. Anesthesiology 70:616, 1989
186. LindGH, Marcus MA, Mears SL et al: Oral transmucosal fentanyl citrate for analgesia and sedation in the emergency department. Ann Emerg Med 20:1117, 1991
187. Striehel H W, Koenigs D. Kramer J: Postoperative pain management by intranasal demand-adapted fentanyl titration. Anesthesiology 77:281, 1992 188 Sandier AN: New techniques of opioid administration for the control of acute pain. Anesthesiol Clin North Am 10:271, 1992
189. Tarver SD, Stanley TH: Alternative routes of drug administration and new drug delivery systems. p. 337. In Stoelting RK, Barash P, Gallagher TJ (eds): Advances in Anesthesia. Vol. 7. Year Book Medical, Chicago, 1990
190. Hill HF: Clinical pharmacology of transdermal fentanyl. Eur J Pain 11:81, 1990 191 Caplan RA, Ready LB, Oden RVet al: Transdermal fentanyl for postoperative pain management. A double blind placebo study. JAMA 261 :1036, 1989
192. McLeskey CH: Fentanyl TTS for postoperative analgesia. Eur J Pain 11 :92, 1990
193. Plezia PM. Linjord J. Kramer TH et al: Transdermally administered fentanyl for postoperative pain: a randomized double blind placebo controlled trial, abstracted. Anesthesiology 69:A364,
1988
194. von Bormann B, Ratthey K, Schwetlick G et al: Postoperative schmerztherapic durch transdcr-males fentanyl. Anasth'Intensivther Notfallmed 23:3, 1988
195. Sandier AN, Baxter AD, Norman P et al: A double blind, placebo-controlled trial of transdermal fentanyl for posthysterectomy pain relief. II. Respiratory effects, abstracted. Can J Anaesth 38:A114, 1991
196. Rowhotham DJ, Wyald R, Peacock JE et al: Transdermal fentanyl for the relief of pain after upper abdominal surgery. Br J Anaesth 63:56, 1989
197. Stahl KD, van Bever W, Janssen P. Simon EJ: Receptor affinity and pharmacologic potency of a series of narcotic analgesic, anti-diarrheal and neuroleptic drugs. Eur J Pharmacol 46: 199, 1977
198. Bovill JG, Sebel PS, Blackburn CL et al: The pharmacokinetics of sufentanil in surgical patients. Anesthesiology 57:439, 1982
199. Weldon ST, Perry DF, Cork RC. Gandolfi AJ: Detection of picogram levels of sufentanil by capillary gas chromatography. Anesthesiology 63:684, 1985
200. Waggum DC, Cork RC. Weldon ST et al: Postoperative respiratory depression and elevated sufentanil levels in a patient with chronic renal failure. Anesthesiology 63:708, 1985
201. Davis PJ. Stiller RL, Cook DR et al: Pharmacokinetics of sufentanil in adolescent patients with chronic renal failure. Anesth Analg 67:268, 1988
202. Matteo RS, Schwartz AE, Ornstein E et al: Pharmacokinetics of sufentanil in the elderly surgical patient. Can J Anaesth 37:852, 1990
203. Sebel PS, Barren CW, Kirk CJ, Hevkants J: Transdermal absorption of fentanyl and sufentanil in man. Eur J Clin Pharmacol 32:529, 1987
204. Roy SD. Flynn GL: Transdermal delivery of narcotic analgesics: pH, anatomical, and subject influences on cutaneous permeability of fentanyl and sufentanil. Pharm Res 7:842, 1990
205. Lehmann KA, Gerhard A. Horrichs-Haermeyer G et al: Postoperative patientcontrolled analgesia with sufentanil: analgesic efficacy and minimum effective concentrations. Acta Anaesthesiol
Scand 35:221, 1991
206. VedSA, Dubois M, Can-on H, Leu D: Sufentanil and alfentami pattern of consumption during patient-controlled analgesia: a comparison with morphine. Clin J Pain, suppl. 1 : S63, 1989
207. Grqf G. Sinulrti R. Chung J et ul: Epidural sufentanil for postoperative analgesia: dose-response in patients recovering from major gynceologic surgery. Ancsth Analg 73:405, 1991
208. Dyer RA. Andersen BJ, Michell WL, Hull JM: Postoperative pain control with a continuous infusion of epidural sufentanil in the intensive care unit: a comparison with epidural morphine Anesth Analg 71 : 130, 1990
209. Bovill JG, Sebel PS, Blackburn CL, Heykants J: The pharmacokinetics of alfentanil (R39209):
a new opioid analgesic. Ancsthesiology 57:439, 1982
210. Camu F, Gepts E, Rucquoi M. Heykants J: Pharmacokinetics of alfentanil in man. Anesth Anale 61:657, 1982
211. Stanski DR. Hug CC: Alfentanil-a kinetically predictable narcotic analgesic. Anesthesiology 57:435, 1982
212. Ferrir С, MartyJ, Bouffard Y et cil: Alfentanil pharmacokinetics in patients with cirrhosis Anesthesiology 62:480, 1985
213. Camu F, Duhucquoy F: Alfentanil infusion for postoperative pain: a comparison of epidural and intravenous routes. Anesthesiology 75:171, 1991
214. Репоп С. Negre I. Ecoffey C el ul: Analgesia and ventilatory responses to carbon dioxide after intramuscular and epidural alfentanil. Ancsth Analg 67:313, 1988
215. Owen H, Brose WG, Plummet- JL, Mother LE: Variables of patient-controlled analgesia. 3. Test of an infusion demand system using alfentanil. Anaesthesia 45:452, 1990
216. Owen H, Currie JC, Plummer JL: Variation in the blood concentration/analgesic response relationship during patient-controlled analgesia with alfentanil. Anaesth Intensive Care 19-555 1991
217. Meresaur V, Nf/sson MI, Holmstrand J, Anggard E: Single dose pharmacokinetics and bio-availability of mcthadone in man studied with a stable isotope method. Eur J Clin Pharmacol 20:473, 1981
218. Nilsson Ml. Meresaar V. Anggard E: Clinical pharmacokinetics of methadone. Acta Anaesthe-siol Scand, suppl. 74:66, 1982
219. Nils4(m MI, Anggard E, Holmstrand J, Gunne LM: Pharmacokinetics of methadone during maintenance treatment: adaptive changes during the induction phase. Eur J Clin Pharmacol 22:343, 1982
220. Anggard E, Gunne LM. Holmstrand J et ai. Disposition of methadone in methadone maintenance. Clin Pharmacol Ther 17:258, 1975
221. Verebely К, Voluvku J. Mule S et al: Methadone in man: pharmacokinetic and excretion studies in acute and chronic treatment. Clin Pharmacol Ther 18:180, 1975
222. Nilsson MI, Widerlov E, Meresaar U, Anggard E: Effect of urinary pH on the disposition of methadone in man. Eur J Clin Pharmacol 22:337, 1982
223. Gour lay GK, Wilson PR. Glynn CJ: Pharmacodynamics and pharmacokinetics of methadone during the periopcrative period. Anesthesiology 57:458, 1982
224. Beaver WT, Wullenstein SL. Houde RW, Rogers A: A clinical comparison of the analgesic effects of methadone and morphine administered intramuscularly, and of orally and parenterally administered methadone. Clin Pharmacol Ther 8:415, 1967
225. Hansen J, Ginman C, Hartvig P et al: Clinical evaluation of oral methadone in treatment of cancer pain. Acta Anaesthesiol Scand, suppl. 74:124, 1982
226. Ventqfridda V. Ripamonfi C. Biunchi M et al: A randomized study on oral administration of morphine and methadone in the treatment of cancer pain. J Pain Symptom Manage 1:203, 1986
227. Welch DB, Hrynaszkiewiez A: Postoperative analgesia using epidural methadone. Administration by the lumbar route for thoracic pain relief. Anaesthesia 36:1051, 1981
228. Nyska I, Klin B, Sliapiru Yet al: Epidural methadone for preoperative analgesia in patients with proximal femoral fractures. Br Med J (Clin Res Ed) 293:1347, 1986
229. Gourlay GK, Willis RJ, Wilson PR: Postoperative pain control with methadone: influence of supplementary melhadone doses and blood concentration-response relationships. Anesthesiology 61:19, 1984
230. Gourlay GK. Willis RJ, Lamherty J: A double-blind comparison of the efficacy of methadone and morphine in postoperative pain control. Anesthesiology 64:332, 1986
231. Gram LF, Schou J, Way WL et al: ^/-Propoxyphene kinetics after single oral and intravenous doses in man. Clin Pharmacol Ther 26:473, 1979
232. Beaver WT: Mild analgesics, a review of their clinical pharmacology (Part II). Am J Med Sci 251:576, 1966
233. Errick JK, Heel RC: Nalbuphine: a preliminary review of its pharmacologic properties and therapeutic efficacy. Drugs 26: 191, 1983
234. Lake CL. DiFazio C A, Duekworth EN et al: High performance liquid chromatographic analysis of plasma levels of nalbuphine in cardiac surgical patients. J Chromatogr 233:410, 1982
235. Jansinski DR: Human pharmacology of narcotic antagonists. Br J Clin Pharmacol, suppl. 7: 287S, 1979
236. Gal T J,DiFazio C A. Moscicki J: Analgesic and respiratory depressant activity of nalbuphine: a comparison with morphine. Anesthesiology 57:367, 1982
237 Latasch L, Probst S, Dudziak R: Reversal by nalbuphine of respiratory depression caused by fentanyl. Anesth Analg 63:814, 1984
238. Moldenhauer CC, Roach GW, Finlayson DC et al: Nalbuphine antagonism of ventilatory depression following high-dose fentanyl anesthesia. Anesthesiology 62:647, 1985
239. Davies GG, From R: A blinded study using nalbuphine for prevention of pruritus induced by epidural fentanyl. Anesthesiology 69:763, 1988
240. Henderson SK. Cohen H: Nalbuphine augmentation of analgesia and reversal of side effects following epidural hydromorphone. Anesthesiology 65:216, 1986
241. Lee G, De Maria A, Amsterdam A et al: Comparative effects of morphine, meperidine and pentazocine on cardiocirculatory dynamics in patients with acute myocardial infarction. Am J Med 60:949, 1976
242. Lehman KA, Tenhuhs В: Patient-controlled analgesia with nalbuphine, a new narcotic agonist-antagonist for the treatment of postoperative pain. Eur J Clin Pharmacol 31 :267, 1986
243. Sprigg E. Otton PE: Nalbuphine versus meperidine for postoperative analgesia: a double-blind comparison using patient controlled analgesic technique. Can Anaesth Soc J 30:517, 1983
244. Camann W R. Hurley RH, Gilbertson LI el al: Epidural nalbuphine for analgesia following cesarean delivery: dose-response and effect of local anaesthetic choice, Can J Anaesth 38:728, 1991
245. Baxter AD, Langaniere S, Samson В et a!: A dose-response study of nalbuphine for post-thoracolomy epidural analgesia. Can J Anaesth 38:175, 1991
246. Ehrnebo M, Boreus L. Lonroth V: Bioavailability and first pass metabolism of oral pentazocine in man. Clin Pharmacol Ther 22:888, 1972
247. Berkowilz BA, Asling JH. Shnider SM, Way EL: Relationship of pentazocine plasma levels to pharmacologic activity in man. Clin Pharmacol Ther 10:320, 1969
248. Brogden RN. Speight TM, Avery GS: Pentazocine: a review of its pharmacologic properties, therapeutic efficacy, and dependance liability. Drugs 5:6, 1973
249. Lal S, Savidge RS, Chabra GP: Cardiovascular and respiratory effects of morphine and pentazocine in patients with myocardial infarction. Lancet i:379, 1969
250. Schmucker P, VanAckern K. Franke N et al: Hemodynamic and respiratory effects of pentazocine. Studies on surgical cardiac patients. Anaesthesist 29:475, 1980
251. Есопотои G. Ward-McQuaid JN: A cross-over comparison of the effect of morphine, pethidine and pentazocine on biliary pressure. Gut 12:218, 1971
252. Radnor PA, Brodman E, Manikikar D, Dunealf D: The effect of equianalgesic doses of fentanyl, morphine, meperidine and pentazocine on common bile duct pressures. Br J Clin Pharmacol, suppl. 7:28 IS, 1979
253 Houde RW- Analgesic effectiveness of the narcotic agonist-antagonists. Br J Clin Pharmacol, suppl. 7:297S, 1979
254. Heel RC. Brogden RN. Speight TM, Avery GS: Butorphanol: a review of its pharmacological properties and therapeutic efficacy. Drugs 16:473, 1978
255. Vandam LD: Butorphanol. N Engi J Med 302:381, 1980
256. Popio К A, Jackson DH, Ross AM et al: Hemodynamic and respiratory effects of morphine and butorphanol. Clin Pharmacol Ther 23:281, 1978
257. Lawhorn CD. McNitt JB, Fibuch ЕЕ et al: Epidural morphine wiih butorphanol for postoperative anaglesia after cesarean delivery. Anesth Analg 72:53, 1991
258. Naulty JS, Weintraub S, MeMahon J et al: Epidural butorphanol for post-cesarean delivery pain management, abstracted. Anesthesiology 61 :A415, 1984
259. Abboud TK. Moore M, Zhu J: Epidural butorphanol for the relief of postoperative pain after cesarian section, abstracted. Anesthesiology 65:A397. 1986
260. Abboud TK, Moore M, Zhu ZJ et al: Epidural butorphanol or morphine for relief of postcesarean section pain: ventilatory responses to carbon dioxide. Anesth Analg 66:887, 1987
261. Lanz E. SimkoG, Theiss D. Glocke MH: Epidural buprcnorphine- a double-blind study of postoperative analgesia and side effects. Anesthesiology 41 :169, 1974
262. Heel RC, Brogden RN. Speigt TM, Avery GS: Buprcnorphine: a review of its pharmacological properties and therapeutic efficacy. Drugs 17:81, 1979
263. Bullingham RES, McQuav HJ. Moore A, Bennett MRD: Buprenorphme kinetics. Clin Pharmacol Ther 28:667, 1980
264. Ranee MJ: Animal and molecular pharmacology of mixed agonist-antagonist drugs. Br J Clin Pharmacol, suppl. 7:28 IS. 1979
265. Sekar M, Mimpriss TJ: Buprenorphinc, benzodiazepines and prolonged respiratory depression (letter). Anaesthesia 42:567, 1987
266. McQuay HJ, Bullingham RE, Bennett MR, Moore RA: Delayed respiratory depression. A case report and a new hypothesis. Acta Anaesthesiol Beig, suppl. 30:245, 1979
267. Gal TJ: Naloxone reversal of buprenorphine-induced respiratory depression. Clin Pharmacol Ther 45:66, 1989
268. Orwin JM: The effect of doxapram on buprenorphine induced respiratory depression. Acta Anaesthesiol Beig 28:93, 1977
269. Boysen К, Hertel S, Chraemmer-Jorgensen В et al: Buprenorphine antagonism of ventilatory depression following fentanyl anaesthesia. Acta Anaesthesiol Scand 32:490, 1988
270. Budd К: High dose buprenorphine for postoperative analgesia. Anaesthesia 36:900, 1981
271. Albert LH: Newer potent analgesics. Buprenorphine. Ration Drug Ther 16:4, 1982
272. Shan MV, Jones DI, Rosen M: "Patient demand" postoperative analgesia with buprenorphine. Comparison between sublingual and IM buprenorphine. Br J Anaesth 58:508, 1986
273. Hull CJ: The pharmacokinetics of opioid analgesics, with special reference to patient-controlled administration, p. 7. In Harmer M, Rosen M, Vickers MD (eds): Patient-Controlled Analgesia. Blackwell Scientific, Oxford, 1985
274. Lehmann К A, Grond S, FreierJ, Zech D: Postoperative pain management and respiratory depression after thoracotomy: a comparison of intramuscular piritramide and intravenous patient-controlled analgesia using fentanyl or buprenorphine. J Clin Anesth 3:194, 1991
275. Ouchi К, Takeda, Mutsuno S: Efficacy of patient-controlled analgesia for management of pain after abdominal surgery. Tohoku J Exp Med 165:193, 1991
276. Cohen S, Amar D, Pantuck CB et al: Epidural patient-controlled anaglesia ftcr cesarean section:
buprenorphine 0.015% bupivacaine with epinephrine versus fentanyl-0.015% bupivacaine with and without epinephrine. Anesth Analg 74:226, 1992
277. Cohen S, Amur D, Pantuck CB et al: Epidural patient-controlled analgesia after cesarean section: buprenorphine-0.03% vs. fentanyl-bupivacaine 0.03%, abstracted. Anesthesiology 73:A975, 1990
278. Murphy DF, McGrath P, Struck M: Postoperative analgesia in hip surgery. A controlled comparison of epidural buprenorphine with intramuscular morphine. Anaesthesia 39:181, 1984
279. Keaveny JP, Harper NJ: Treatment of epidural morphine-induced pruritus with buprenorphine (letter). Anaesthesia 44:691, 1989
280. Celleno D, Capogna G: Spinal buprenorphine for postoperative analgesia after cesarean delivery. Acta Anaesthesiol Scand 33:236, 1989
281. Locniskar A, Greenblatt DJ, Zinng MA: Pharmacokinetics of dezocine, a new analgesic: effect of dose and route of administration. Eur J Clin Pharmacol 30: 121, 1986
282. Shulman MS: New systemic analgesic agents. Anesthesiol Clin North Am 10:299, 1991
283. Gal TJ, DiFazio CA: Ventilatory and analgesic effects of dezocine in humans. Anesthesiology 61:716, 1984
284. Malis J, Rosenthale ME, Gluckman Ml: Animal pharmacology of Wy-16, 225, a new analgesic agent. J Pharmacol Exp Ther 194:488, 1975
285. Vinik HR, McFarland L, Wright D et al: Double-blind postoperative study comparing multiple doses of dezocine (WY 16225) with morphine and placebo, abstracted. Anesthesiology 57:A189, 1982
286. Pandit SK, Kothary SP, Pandit UA el al: Double-blind placebo-controlled comparison of dezocine and morphine for postoperative pain relief. Can Anaesth Soc J 32:583, 1985
287. Romagnoli A, Keats AS: Ceiling respiratory depression by dezocine. Clin Pharmacol Ther 35:367, 1984
288. Rothbard RL, Schreiner BF, Yu PN: Hemodynamic and respiratory effects of dezocine. Clin Pharmacol Ther 38:84, 1985
289. WHO Technical Report Series 775, Geneva, 1989
290. Jasinski DR, Preslon KL: Assessment of dezocine for morphine-like subjective effects and miosis. Clin Pharmacol Ther 38:544, 1985
291. Zacny JP, Lichtor JL, deWtt H: Subjective behavioral, and physiologic responses to intravenous dezocine in healthy volunteers. Anesth Analg 74:523, 1992
292. Galloway FM, Farma S: Double-blind comparison of intravenous doses of dezocine, butorphanol and placebo for relief of postoperative pain. Anesth Analg 65:283, 1986
293. Finucane ВТ. Floyd JB, Petro DJ: Postoperative pain relief: a double-blind comparison of dezocine, butorphanol and placebo. South Med J 79:548, 1986
294. Gravenstein JS: Dezocine for postoperative wound pain. Int J Clin Pharmacol Ther Toxicol 22:502, 1984
Camu F Gepts E: Analgesic properties of dezocine for relief of postoperative pain. Acta Anaesthesiol Beig, suppl. 30:183, 1979
Keats AS, Talford J: Subjective effects of nalorphme and nalorphinc-morphme combinations in man. J Pharmacol Exp Ther 112:356, 1954.
297. Gal TJ, DiFazio CA: Prolonged antagonism ofopioid action with intravenous nalmetene in man. Anesthesiology 64:175, 1986.
298. Paris PL, Komisariik BR, Watkins LR, Mayor DJ: Evidence for the neuropeptide cholecystokmm as an antagonist of opiate analgesia. Science 219:310, 1983
299. Nqai SH, Berkowitz BA, Yang YC et al: Pharmacokinetics of naloxone in rats and man. Basis for its potency and short duration of action. Anesthesiology 44:398, 1976
300. Berkowit: В A: Research review. The relationship of pharmacokinetics to pharmacological activity morphine, methadone and naloxone. Clin Pharmacokinet 1:219, 1976
301. Rawal N, Schott U, Dahlstrom В et al: Influence of naloxone infusion on analgesia and respiratory depression following epidural morphine. Anesthesiology 64: 194, 1986
302. Gueneron JP, Ecoffey Cl, Carii P et al: Effects of naloxone infusion on analgesia and respiratory depression after epidural fentanyl. Anesth Analg 67:35, 1988
303. Kripke BJ Finck AJ, Shah N, Snow JC: Naloxone antagonism after narcotic supplemented ancsthesia. Anesth Analg 55:800, 1976.
304. Longnecker DE, Grazis PA, Eggers GWN: Naloxone for antagonism of morphine induced respiratory depression. Anesth Analg 52:447, 1973
305. Flacke JW. Flacke WE. Williams GD: Acute pulmonary edema following naloxone reversal ot high-dose morphine anesthesia. Anesthesiology 47:376, 1977
306. Tanaka GY: Hypertensive reaction to naloxone. JAMA 228:25, 1974
307. Michaelis LL, Hickey PR, Clark ТА, Dixon WM: Ventricular irritability associated with the use of naloxone. Ann Thorac Surg 18:608, 1974
308. Martin W R. Jasinski DR. Mansky PA: Naltrexone, an antagonist for the treatment ol heroin dependence. Arch Gen Psychiatry 28:748, 1973
9
Локальные анестетики
Бенджамин Г. Ковино (Benjamin G. Covino)
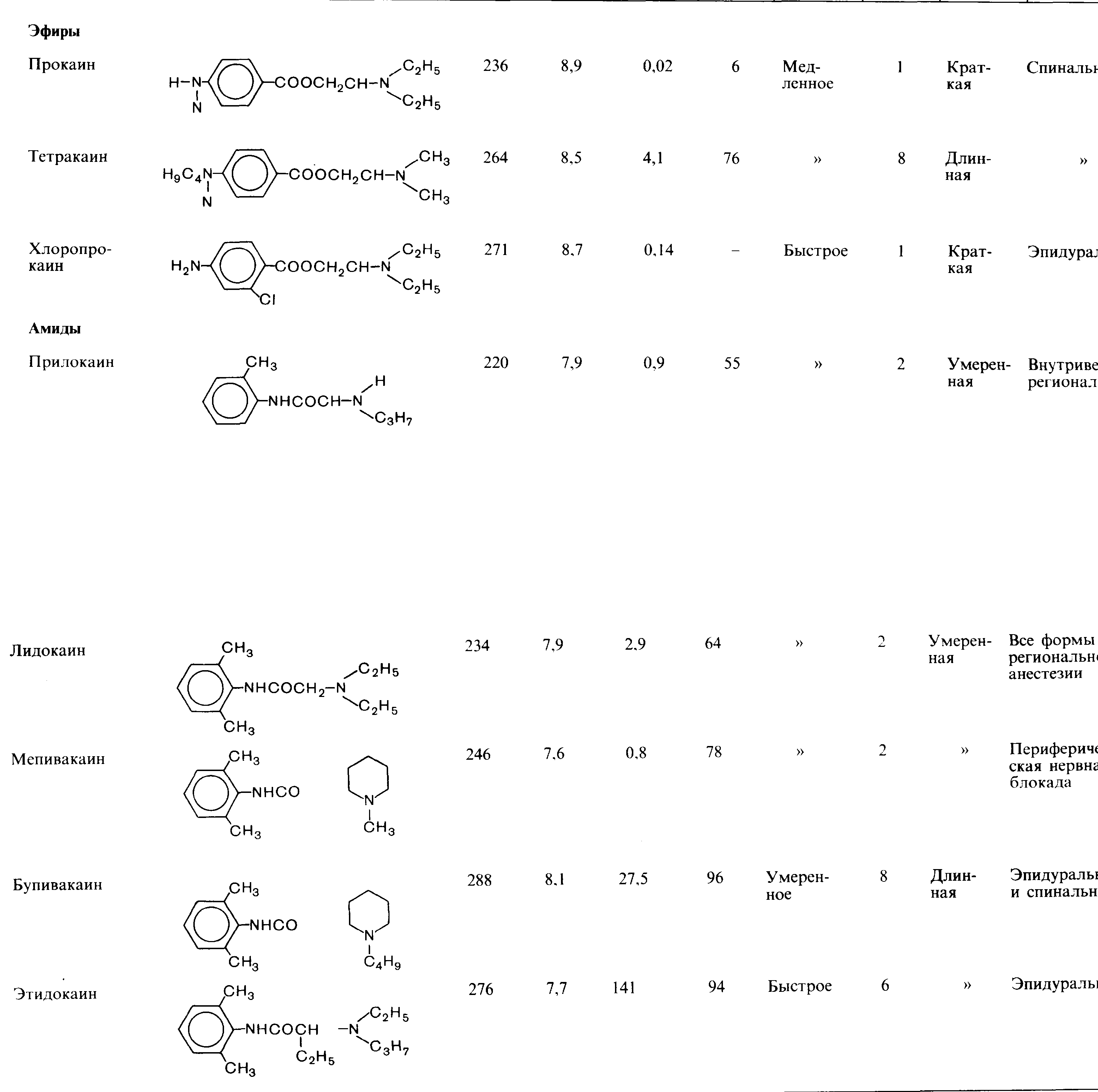
Локальными анестетиками называют фармакологические препараты, вызывающие потерю чувствительности на ограниченном участке тела. Подобные локальные формы анестезии обусловлены либо угнетением процессов возбуждения нервных окончаний, либо блокадой процессов проведения по периферическим нервам. Региональная анестезия берет свое начало с 1884 г., когда Koller описал местные обезболивающие свойства кокаина, алкалоида, выделенного из листьев Erytroxylin coca. В последующем было синтезировано большое число средств со свойствами локальных анестетиков. Эти средства в настоящее время используются для региональной анестезии. Особенности их применения в клинике отражены в табл. 9-1.
ФАРМАКОДИНАМИКА
Механизм действия
В состоянии покоя трансмембранный потенциал нервный клетки отрицателен и равен 60-90 мВ (так называемый мембранный потенциал покоя). При стимуляции нерва вначале наблюдается фаза относительно медленной деполяризации. Отрицательный электрический потенциал клетки в это время прогрессивно снижается (рис. 9-1). Когда электрический потенциал между внутренней и наружной поверхностями мембраны достигает критического уровня (так называемый пороговый потенциал), наступает фаза быстрой деполяризации. Это приводит к реверсии электрических потенциалов: внутренняя поверхность клеточной мембраны приобретает положительный заряд, а наружная - отрицательный. На пике потенциала действия положительный заряд на внутренней поверхности мембраны достигает примерно 40 мВ по отношению к наружной поверхности. Общая амплитуда потенциала действия равна примерно 100 мВ. После завершения фазы деполяризации начинается фаза реполяризации нерва. На внутренней поверхности клетки прогрессивно растет отрицательный заряд до восстановления потенциала покоя на уровне 60-90 мВ. Весь процесс деполяризации и реполяризации длится 1 мс, и около 30% этого времени занимает деполяризация. Фаза реполяризации протекает медленнее (70% периода потенциала действия).
Течение указанных электрофизиологических процессов зависит от следующих факторов:
1) соотношение концентрации электролитов в цитоплазме нервной клетки и в экстрацеллюлярной жидкости;
2) проницаемость клеточной мембраны для различных ионов, особенно ионов натрия и калия.
Мембранный потенциал покоя тесно связан с соотношением ионов калия внутри (К;) и снаружи (Кд) мембраны. В состоянии покоя соотношение Кi/Кo равно примерно 30:1. Клеточные мембраны относительно непроницаемы для ионов натрия, поэтому они не создают мембранного потенциала покоя.
После возбуждения проницаемость клеточной мембраны возрастает. Ионы натрия начинают проходить внутрь клетки по натриевому каналу. Это движение ионов натрия внутрь клетки характеризует деполяризационную фазу потенциала действия (приток катионов объясняет положительный мембранный потенциал). По мере нарастания деполяризации проницаемость ее для ионов натрия падает (инактивация натриевого канала). Усиливающийся поток ионов калия из клетки приводит к реполяризации клеточной мембраны.
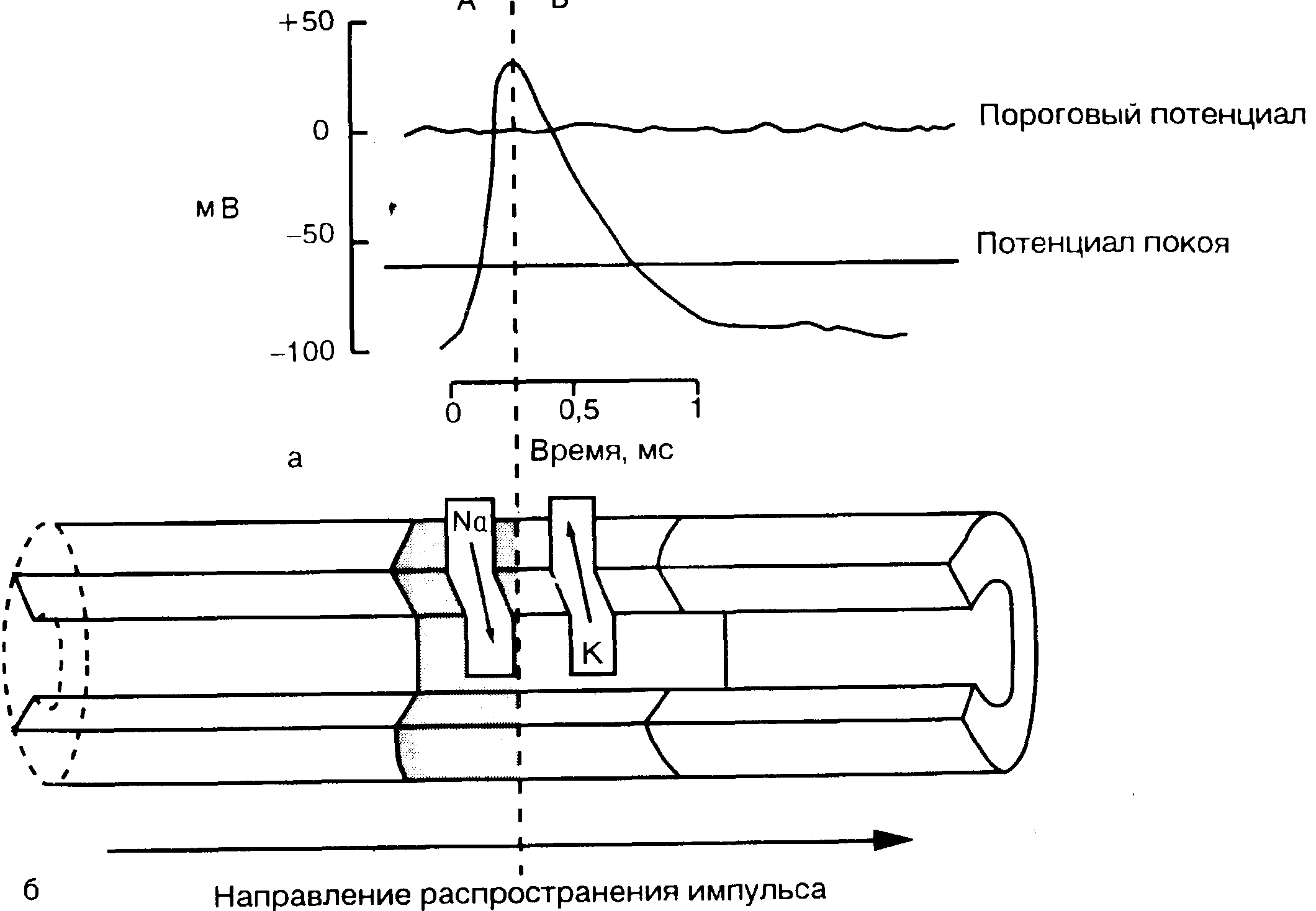
Рис. 9-1. Поверхностный потенциал действия, записанный на изолированном нерве (а). Активация натриевого канала в фазе деполяризации и открытие калиевого канала в фазе реполяризации (б).
Таблица 9-1. Химическая структура, физико-химические, фармакологические свойства и преимущественное kj] ческое использование локальных анестетиков
Препарат |
Химическая структура |
Физико-химические свойства |
Фармакологичес-кие свойства |
|||||||||
ароматическая липо-фильность |
промежуточная цепь |
амины гидрофильные |
мол. масса основания |
рКа (25 °С) |
разделительный коэффициент |
связывание белками, % |
начало действия |
относительная мощность |
длительность |
основк примени В КЛИН] |
||
Поток ионов натрия и калия во время возбуждения - это пассивный феномен, поскольку передвижение этих ионов происходит в соответствии с градиентом их концентрации. В конце потенциала действия образуется избыток ионов натрия внутри клетки при избытке ионов калия вне клетки. Восстановление ионного соотношения по обе стороны клеточной мембраны требует затрат энергии для выталкивания ионов натрия против градиента их концентрации. Ионы калия также активно транспортируются снаружи внутрь нервной мембраны. Ионы калия могут перемещаться также и пассивно в силу электростатического градиента. Энергия, необходимая для активного транспорта ионов натрия и калия (так называемый натриевый насос), обеспечивается метаболизмом аденозинтрифосфата (АТФ).
Воздействие локального анестетика на изолированный нерв заметно не меняет потенциал покоя и пороговый потенциал. Под влиянием 0,005% раствора лидокаина (0,2 мМ) максимальная скорость подъема потенциала действия снижается по сравнению с контролем со 190 В/с до 120 В/с. Скорость реполяризации при этом не изменяется [I].
Локальные анестетики снижают проницаемость мембраны нервных клеток к натрию. Например, при обычной концентрации натрия, равной 116 мМ, высота потенциала действия снижается на 50% при воздействии 3,3 ммоль кокаина на изолированный седалищный нерв лягушки [2]. Однако если концентрация натрия в окружающем нерв растворе снижена до 12 ммоль, достаточно 0,15 ммоль кокаина, чтобы вызвать подобное снижение амплитуды потенциала действия. При непосредственных исследованиях проводимости натрия и калия было выявлено полное прекращение потока натрия в присутствии 1 ммоль лидокаина. В то же время 3,5 ммоль лидокаина снижают проведение калия всего на 5% [3, 4].
Большинство используемых в клинике локальных анестетиков выпускают в виде растворов солей (например, 0,5-2% раствор лидокаина гидрохлорида). В таких растворах соли локальных анестетиков присутствуют как в виде незаряженных оснований (В), так и в виде положительно заряженных катионов (ВН+). Соотношение между этими компонентами определяется специфичностью состава самого вещества (рНа) и величиной рН раствора. Это соотношение можно выразить следующей формулой:
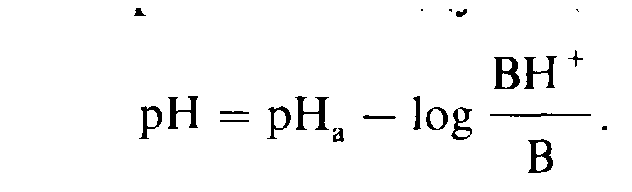
Поскольку рНа является величиной постоянной для любого химического соединения, то соотношение свободной основы (В) и заряженного катиона (BН+) будет зависеть от величины рН раствора местного анестетика. По мере снижения величины рН и роста концентрации H+ равновесие будет смещаться в сторону заряженных катионных форм. И напротив, по мере роста рН и снижения концентрации ионов H+ равновесие будет смещаться в сторону свободных основных форм.
В действии локального анестетика принимают участие два фактора:
диффузия через оболочки нерва и его мембраны;
процессы связывания на некоторых участках клеточной мембраны.
В изолированном нерве с интактным эпиневрием при повышении рН омывающего раствора анестетика (что благоприятствует формированию В) значительно увеличивается скорость падения высоты поверхностного потенциала действия. Однако в нервах, лишенных оболочки, более слабые щелочные растворы (способствующие накоплению заряженных катионов) усиливают действие локальных анестетиков. Эти наблюдения показывают, что незаряженные основные формы (В) играют важную роль в оптимальной проницаемости оболочки нерва [5, 6]. Равновесие между В и ВН+ восстанавливается благодаря диффузии через периневрий. Что касается клеточной мембраны, то заряженные катионы в конечном счете определяют супрессию электрофизиологических процессов в периферическом нерве [7] (рис. 9-2).
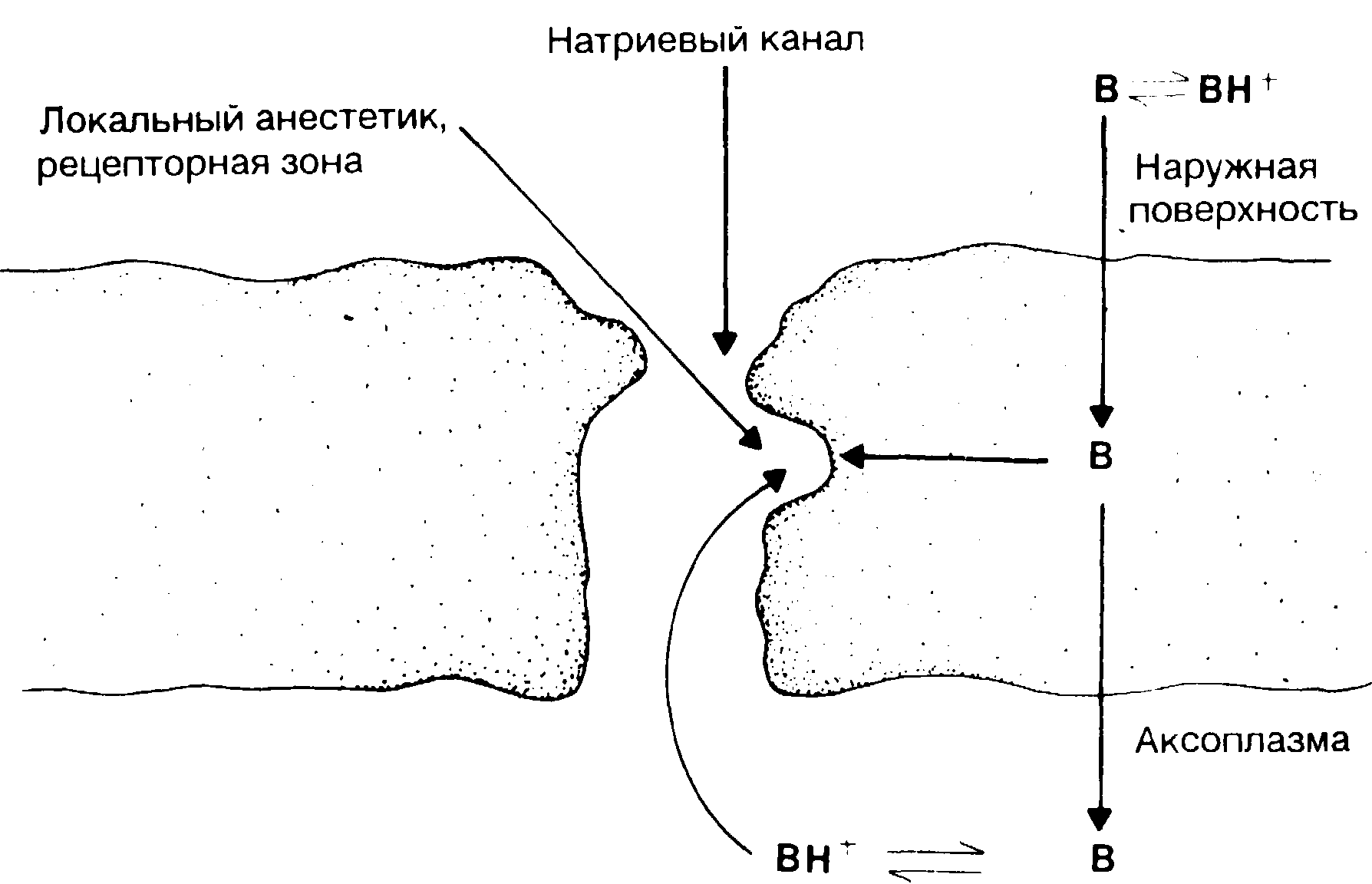
Рис. 9-2. Схематическое отображение действия локального анестетика, блокирующего проводимость. Основная форма (В) определяет преимущественную диффузию через нервную мембрану в направлении аксоплазмы, где происходит конверсия в катионы (ВН+). Катионы главным образом вовлекаются в соединение с рецепторными зонами в натриевом канале, что и приводит к его блокаде.
Локальный анестетик проявляет свое фармакологическое действие в натриевом канале. Полагают, что именно там препараты этого ряда связываются с рецепторами и это связывание в конечном счете инактивирует натриевый канал, блокируя его [8]. Исследования, проведенные с третичными амидами локальных анестетиков и с четвертичными производными лидокаина, установили, что анестезирующее действие этих веществ усиливается при их нанесеннии на внутреннюю поверхность нервной мембраны [9]. Таким образом, полагают, что обычные локальные анестетики (например, лидокаин) входят в натриевый канал со стороны аксоплазмы (см. рис. 9-2).
Высказано предположение, что проводниковая блокада натриевого канала определяется главным образом катионами локальных анестетиков благодаря их взаимодействию с расположенными в нем рецепторными зонами. Однако незаряженные основания также могут влиять на действие этих анестетиков. Незаряженные основания проникают через липидные участки клеточной мембраны и вызывают структурные изменения в липопротеиновой матрице. При этом диаметр натриевого канала уменьшается, что и угнетает проведение натрия. Таким образом, последовательность процессов, приводящих к проводниковой блокаде периферического нерва под влиянием локального анестетика, можно представить следующим образом.
1. Диффузия основных форм локального анестетика через оболочку нерва и нервную мембрану.
2. Восстановление равновесия между основными и катионными формами локального анестетика на аксиальной поверхности нервной мембраны.
3. Проникновение внутрь и фиксация локального анестетика в зоне рецепторов в натриевом канале.
4. Блокада натриевого канала.
5. Угнетение проведения натрия.
6. Снижение скорости и степени фазы деполяризации потенциала действия.
7. Невозможность достигнуть порогового уровня потенциала.
8. Недостаточное развитие потенциала действия.
9. Проводниковая блокада.
ВЗАИМООТНОШЕНИЕ СТРУКТУРЫ И ДЕЙСТВИЯ
Соединения, обладающие клинически выраженным обезболивающим действием, имеют следующую химическую структуру: ароматическая часть–промежуточная цепь–аминная часть. Изменения в каждом из звеньев этой структуры сказываются на обезболивающем действии препарата. Например, увеличение молекулярной массы, удлинение промежуточной цепи, включение дополнительного атома углерода в ароматическую или в аминную часть анестетика усиливает собственные анестезирующие свойства препарата, приближая их к максимально возможным [10]. Дальнейшее увеличение молекулярной массы, напротив, приводит к ослаблению анестезирующего действия препарата. Ароматическая часть молекулы локального анестетика обычно определяет степень его липофильности, а аминная часть ассоциируется с гидрофильностью. Изменения в ароматическом или в аминном компоненте нарушают водно-липидный коэффициент распределения соответствующего анестетика. Химическая модификация любого из краевых участков молекулы нарушает связывание препарата с протеинами, что в свою очередь сказывается на его анестезирующих характеристиках. Например, присоединение бутиловой группы к ароматическому звену молекулы прокаина повышает его липофильность и связывание с протеинами. Это сопровождается усилением обезболивающего действия препарата и удлинением продолжительности его действия (тетракаин) [11]. Присоединение бутиловой группы к аминному концу молекулы мепивакаина трансформирует этот препарат, делая его еще более липофильным и прочно связывающимся с протеинами. Этот новый препарат (бупивакаин) обладает более мощным и продолжительным действием [12] (см. табл. 9-1). Если в молекуле лидокаина подставить пропил вместо этиловой группы на аминном конце и этиловую группу к а-углероду промежуточной цепи, получаем препарат этидокаин. Последний лучше растворим в липидах, прочнее связывается с белками, обладает более выраженным и стойким местным анестезирующим действием [13].
Локальные анестетики, используемые в клинической практике, можно распределить на две различные в химическом отношении категории.
1. Препараты с эфирным звеном, расположенным между ароматическим концом молекулы и промежуточной цепью. Примерами таких амино-эфирных препаратов являются прокаин, хлорпрокаин, тетракаин.
2. Соединения, содержащие аминное звено между ароматическим концом и промежуточной цепью.
Представителями подобных аминоамидных препаратов являются лидокаин, мепивакаин, прилокаин, бупивакаин и этидокаин.
Основные различия между соединениями, содержащими эфир или амид, заключаются, во-первых, в путях их метаболизма и, во-вторых, в их аллергизирующем потенциале.
Эфиросодержащие препараты гидролизируются в плазме под действием псевдохолинэстеразы, а аминосодержащие соединения разрушаются ферментами печени. Парааминобензойная кислота является одним из метаболитов, образующихся при гидролизе эфиросодержащих препаратов. У некоторых больных эта кислота способна индуцировать реакции аллергического типа. Соединения аминоамидного типа не распадаются с образованием парааминобензойной кислоты и крайне редко вызывают аллергические реакции.
ФАРМАКОЛОГИЯ
В клинике имеют значение такие свойства локального анестетика как сила обезболивающего действия, скорость наступления обезболивания, его продолжительность, а также способность к дифференцированной сенсорной и моторной блокаде. Профиль клинического действия локального анестетика в каждом случае зависит от особенностей его физико-химических характеристик, определяемых химической структурой вещества. Подобными физико-химическими характеристиками, влияющими на анестезирующие возможности, служат растворимость в липидах, связывание с протеинами, а также рКа. Даже минимальные модификации молекулярной структуры могут коренным образом изменить указанные характеристики.
Возможности обезболивающего действия
Растворимость в липидах, по-видимому, является первостепенным показателем обезболивающей способности препарата. Мембрана нервной клетки в основном - представлена липопротеиновым матриксом. Аксолемма на 90% состоит из липидов и на 10% - из протеинов. В результате этого химические вещества с высокой липофильностью легче и быстрее преодолевают клеточные мембраны. Проводниковая блокада обеспечивается небольшим числом молекул, что отражает высокую действенность препарата. Экспериментальные исследования на изолированном нерве подтвердили существование четкой корреляции между коэффициентом разделения локального анестетика и величиной минимальной концентрации (Сm), обеспечивающей проводниковую анестезию [14, 15]. Например, мепивакаин, прилокаин и препараты из группы аминоамидов в наименьшей степени растворимы в липидах и соответственно обладают самым слабым обезболивающим действием. В противоположность этому этидокаин, наиболее липофильный препарат этой группы, является и наиболее действенным анестетиком (см. табл. 9-1). Подобная же зависимость между растворимостью в липидах и клиническим действием наблюдается и у препаратов эфирного ряда. Прокаин наименее растворим в липидах и малоэффективен. В то же время тетракаин обладает высокой липофильностью и наиболее выраженным обезболивающим действием среди препаратов эфирного ряда.
Помимо растворимости препарата в липидах, его обезболивающее действие определяется также и другими факторами. Сопоставление величин коэффициентов распределения и анестезирующего действия локальных анестетиков эфирного и амидного рядов показало, что это действие у аминоэфиров значительно выше, чем у аминоамидов даже при одинаковых коэффициентах распределения (см. табл. 9-1). Аминоэфиры взаимодействуют с большим числом различных рецепторов, что обеспечивает им значительно большие возможности действия [16].
Экспериментальные исследования показали, что в организме человека корреляция между липофильностью анестетика и его действенностью не столь выражена, как в опытах на изолированном нерве. Лидокаин был почти вдвое активнее прилокаина и мепивакаина в опытах на препаратах изолированного нерва. Однако у человека все три анестетика оказывали примерно одинаковое действие. Точно так же этидокаин, более активный, чем бупивакаин в опытах на изолированном нерве, в условиях клиники оказался слабее.
Разное действие локальных анестетиков в лабораторных условиях и в клинике может быть обусловлено различным их распределением в тканях и сосудорасширяющим эффектом. Например, лидокаин расширяет сосуды сильнее, чем мепивакаин или прилокаин, и поэтому быстрее абсорбируется. Меньшие по размерам молекулы лидокаина также предрасполагают к более быстрому наступлению блокады при клиническом использовании. Очень высокая липофильность этидокаина приводит к тому, что весьма значительные количества этого препарата захватываются жировой тканью эпидурального пространства. Поэтому для создания невральной блокады остается меньшее число молекул, чем это имеет место при назначении бупивакаина.
Продолжительность действия
Продолжительность обезболивания под влиянием локальных анестетиков зависит прежде всего от степени их связывания с белками. Эти препараты, по-видимому, образуют комплексы с белковыми рецепторами, расположенными в натриевом канале нервной мембраны. Чем выше аффинитет и прочнее связь этих химических соединений, тем дольше будет блокирован рецептор в натриевом канале. Результатом этого и станет более продолжительная блокада проводимости нерва. Большая часть информации о связывании локальных анестетиков с белками получена на примере взаимодействия этих веществ с белками плазмы. При этом постулировано, что процессы связывания локальных анестетиков в нервной мембране и в плазме крови идентичны.
Лабораторные исследования установили, что локальные анестетики, слабо комплексирующиеся с белками (например, прокаин), быстро вымываются из изолированного нерва. В то же время такие препараты, как тетракаин, бупивакаин, этидокаин, длительно задерживаются в нем. Опыты in vivo, в том числе и в клинических условиях, подтвердили, что существует зависимость между белковым связыванием местных анестиков и продолжительностью их действия. Например, прокаин обеспечивает блокаду плечевого сплетения в течение 30-60 мин, в то время как бупивакаин или этидокаин поддерживают ее на протяжении до 10 ч [17].
Продолжительность местной анестезии у человека в значительной степени зависит от сосудистых изменений на периферии, вызванных самими обезболивающими средствами. Все локальные анестетики, за исключением кокаина, оказывают двоякое влияние на гладкие мышцы сосудов. В малой концентрации эти вещества вызывают сужение сосудов, а в терапевтической - их расширение [18, 19]. Однако величина вазодилатации, вызываемой отдельными анестетиками, весьма различна. Например, лидокаин обладает более мощным сосудорасширяющим действием, чем мепивакаин или прилокаин. В экспериментах на изолированном нерве эти препараты блокируют проведение нервного импульса примерно на одинаковый срок, однако in vivo лидокаин обеспечивает анестезию на более короткое время, чем мепивакаин или прилокаин. Если же одновременно с анестетиками вводятся сосудосуживающие вещества, то продолжительность действия всех трех локальных анестетиков становится одинаковой.
Наступление действия
Развитие блока проводимости в изолированном нерве зависит прежде всего от величины рКa соответствующего анестетика [5]. Эта величина равна показателю рН при условии, что ионизированная и неионизированная формы этого химического соединения присутствуют в равных количествах. Диффузия локального анестетика через оболочку нерва и через нервную мембрану определяется прежде всего незаряженной формой препарата. Поэтому сроки наступления обезболивания находятся в прямой зависимости от количества препарата в его основной форме (табл. 9-2).
Процентное содержание локального анестетика в форме основания при его введении в ткани с рН 7,4 обратно пропорционально рКд этого вещества. Например, мепивакаин, лидокаин, прилокаин и этидокаин имеют рН 7,7. Когда эти препараты вводят в ткани с рН 7,4, то около 65% их общего количества находятся в ионизированной форме и остальные 35% остаются неионизированными. Тетракаин имеет рКa 8,6. Поэтому в тканях с рН 7,4 только 5% этого препарата остаются неионизированными, а остальные 95% приобретают форму заряженного катиона. Величина рКa бупивакаина - 8,1, и в тканях с обычным рН лишь около 15% его количества присутствуют в неионизированной форме, а 85% - в форме заряженного катиона. Следовательно, лидокаин, мепивакаин, прилокаин и этидокаин относятся к препаратам с быстрым наступлением действия (низкие показатели рКa), в то время как действие прокаина и тетракаина наступает медленно (высокие величины pKa)(см. табл. 9-2). Бупивакаин занимает промежуточное положение как по величине рКд, так и по срокам наступления его действия [20, 21].
Таблица 9-2.
