
- •Москва медицина 1998 Издание рекомендовано для перевода академиком рамн
- •Майкл Ферранте
- •Значимость проблемы послеоперационной боли
- •Распространенность проблемы по данным исследований
- •Распространенность проблемы по хирургическим данным
- •Боль, обусловленная хирургическим вмешательством (в порядке снижения интенсивности)1 Операции на желудке
- •Сопоставление разных методов аналгезии (международное исследование)
- •Региональная анестезия/аналгезия и легочные осложнения
- •Региональная анестезия/аналгезия и заболевания в послеоперационном периоде
- •Аналгезия, контролируемая пациентом
- •Премедикация и техника анестезии
- •Факторы, обусловливающие неадекватный контроль послеоперационной боли
- •Недостаток рутинной количественной оценки
- •Побочное действие анальгетиков
- •Индивидуальные различия реакции на анальгетики
- •Направления и пути решения
- •Периферическая нервная система Основы анатомии
- •Микроскопическое строение
- •Трансдукция Характеристика ноцицепторов
- •Категории ноцицепторов
- •Миелинизированные ноцицепторы
- •Немиелинизированные ноцицепторы
- •Роль ноцицепторов в перцепции боли
- •Сенсибилизация и гиперсенсибилизация
- •Биохимические субстраты
- •Трансдукция в глубоких соматических тканях
- •Суставы
- •Трансдукция в висцеральных органах
- •Резюме по вопросам трансдукции
- •Центральная нервная система
- •Ультраструктура спинного мозга
- •Ультраструктура головного мозга
- •Главные структуры ствола мозга
- •Таламус
- •Трансмиссия Первичные афферентные волокна в заднем корешке
- •Первичные афферентные волокна в спинном мозге
- •Терминалы первичных афферентов
- •Нейротрансмиттеры первичных аффекторов
- •Трансмиссионные клетки в спинном мозге Анатомия
- •Центральная гиперсенсибилизация, или нервное перевозбуждение
- •Восходящие ноцицептивные проводящие пути
- •Спиноталамический путь (стп)
- •Вентральный спиноталамический путь
- •Спинно-ретикулярный путь (срп)
- •Спинно-мезэнцефалический путь (смп)
- •Дорсальный столб постсинаптической спинно-медуллярной системы
- •Проприоспинальная мультисинаптическая восходящая система
- •Ростральные центры Ретикулярная формация
- •Таламус
- •Гипоталамус и лимбическая система
- •Кора мозга
- •Резюме по вопросам трансмиссии
- •Модуляция
- •Аналгезия, возникающая при стимуляции
- •Аналгезия, обеспечиваемая опиоидами
- •Анатомия нисходящей модулирующей системы Средний мозг
- •Продолговатый мозг
- •Кора и промежуточный мозг
- •Нейротрансмиттеры нисходящих проводящих путей Норадреналин
- •Серотонин
- •Эндогенные опиоиды
- •Резюме по вопросам модуляции
- •Пути контроля теории боли
- •Периферический отдел автономной нервной системы
- •Ганглии и сплетения периферического отдела автономной нервной системы
- •Эндокринные
- •Обменные
- •Обмен липидов
- •Стрессовые гормоны - это еще не результаты (некоторые предостережения)
- •Заключение
- •Структуры, расположенные в позвоночном канале Спинной мозг
- •Кровоснабжение позвоночного канала Артерии
- •Методы, вызывающие боль Турникетный болевой тест
- •Побочные действия
- •Гастропатия
- •Нспвп и преодоление боли в послеоперационном периоде
- •Опиоиды
- •Соотношение структуры и активности
- •Фармакодинамика Эндогенные опиоидныс пептиды
- •Опиоидные рецепторы
- •Классификация типов рецепторов и их предполагаемое действие
- •Связывание рецепторов и их реакция: истинная активность
- •Пути поступления препаратов
- •Проникновение к рецепторам
- •Фармакология Действие на центральную нервную систему
- •Гипнотическое действие опиоидов (в порядке снижения активности)
- •Метадон
- •Меперидин
- •Алкалоиды Морфин
- •Синтетические опиоиды Леворфанол (лево-дроморан)
- •Метадон (дольфин)
- •Смешанные агонист-антагонисты Налбуфин (нубаин)
- •Частичные агонисты Бупренорфин (бупренекс)
- •Пероральные антагонисты Налтрексон
- •Заключение
- •Список литературы
- •Соотношение рКд к процентному содержанию основных форм и время развития 50% проводникового блока в изолированном нерве
- •Факторы, влияющие на анестезиологическую активность
- •Дозировка
- •Добавки
- •Беременность
- •Фармакокинетика
- •Абсорбция
- •Распределение
- •Метаболизм и выведение
- •Токсичность
- •Общая токсичность
- •Токсичность для центральной нервной системы
- •Токсичность для сердечно-сосудистой системы
- •Различные системные эффекты
- •Аллергические реакции
- •Местное токсическое воздействие
- •Осложнения региональной анестезии
- •Эпидуральная анестезия
- •Уровень блокады
- •Доза препарата
- •Особенности локального анестетика
- •Дополнительное введение вазоконстрикторов
- •Волемическое состояние, объем циркулирующей крови
- •Спинальная анестезия
- •Препараты для локальной анестезии Препараты из группы аминоэфиров Кокаин
- •Прокаин (новокаин)
- •Хлоропрокаин
- •Тетракаин
- •Препараты из группы аминоамидов Лидокаин
- •Мепивакаин
- •Прилокаин
- •Бупивакаин
- •Этидокаин
- •Другие препараты Дибукаин
- •Бензокаин
- •Заключение
- •Список литературы
- •Внутривенная аналгезия, контролируемая пациентом Определение методов акп и параметры дозировок
- •Инфузионная технология акп
- •Характеристика прибора
- •Факторы, относящиеся к оценке акп-инфузоров
- •Безопасность
- •Неблагоприятные реакции и побочное действие
- •Проблемы, связанные с работой приборов (механические проблемы)
- •Взаимодействие прибора и пользователя
- •Образец (парадигма) акп
- •Непрерывная инфузионная аналгезия для преодоления острой боли
- •Индивидуализация требований аналгезии
- •Вопросы фармакокинетики
- •Факторы фармакодинамики
- •Психологические факторы
- •Подкожная аналгезия, контролируемая пациентом
- •Эпидуральная аналгезия, контролируемая пациентом
- •Заключение
- •Список литературы
- •Клиническое использование эпидурального введения опиоидов Механизм действия
- •Значение растворимости в липидах
- •Опиоиды; обычно используемые для эпидурального введения
- •Клиническая характеристика эпидуральных опиоидов (после однократной инъекции)
- •Наступление аналгезии
- •Продолжительность аналгезии
- •Ростральная миграция в цсж
- •Место инъекции
- •Интермитткрующие инъекции или продолжительные инфузии?
- •Опиоиды, обычно используемые для эпидуральных инфузий 1
- •Клиническая практика госпиталя Brigham и женского госпиталя
- •Показания к применению
- •Субарахноидальное введение опиоидов в клинике
- •Побочное действие спинальных опиоидов
- •Угнетение дыхания
- •Тошнота
- •Задержка мочи
- •Активация латентной герпетической инфекции
- •Угнетение функции желудочно-кишечного тракта
- •Неврологические эффекты
- •Мониторинг
- •Заключение
- •Список литературы
- •Балансированная аналгезия
- •Эпидуральное введение локальных анестетиков
- •Влияние эпидуральной блокады на сердечно-сосудистую систему
- •Интермиттирующие инъекции
- •Продолжительные инфузии
- •Тахифилаксия
- •Общие сведения
- •Механизм тахифилаксии
- •Гипотетические механизмы тахифилаксии при эпидуральном введении локальных анестетиков
- •Клинические особенности эпидуральной анестезии при комбинации локальных анестетиков и опиоидов Синергизм аналгезии
- •Клинические особенности совместного назначения локальных анестетиков и опиоидов
- •Угнетение тахифилаксии
- •Угнетение центральной гиперсенсибилизации: концепция преимущественной аналгезии
- •Угнетение ноцицептивной трансмиссии: афферентный «барраж»
- •Продолжительность действия
- •Клинические исследования
- •Совместное эпидуральное применение локальных анестетиков и опиоидов
- •Эпидуральные инфузии локальных анестетиков и опиоидов: клиническая практика госпиталя -brigham и женского госпиталя
- •Комбинации локальных анестетиков и опиоидов для эпидуральной инфузии
- •Приготовление некоторых растворов для эпидурального введения
- •Выявление нарушений
- •Обычные проблемы, возникающие при проведении эпидуральной аналгезии
- •Осложнения и побочное действие
- •Заключение
- •Список литературы
- •Анатомия
- •Механизм действия
- •Методика Паховый параваскулярный метод
- •Противопоказания
- •Применение в клинике
- •Заключение
- •Список литературы
- •Анатомия
- •Симпатическая иннервация верхней конечности
- •Методика
- •Процедура Подмышечный подход
- •Межскаленный подход
- •Подключичный периваскулярный доступ
- •Подключичный (инфраклавикулярный) доступ
- •Выбор локального анестетика и его дозировка
- •Применение в клинике
- •Осложнения
- •Токсическое действие локальных анестетиков
- •Повреждение нерва
- •Заключение
- •Список литературы
- •Анатомия
- •Механизм действия
- •Методика Положение пациента и ориентиры
- •Выполнение процедуры
- •Возможные технические трудности
- •Варианты методики
- •Выбор локального анестетика и его дозировка
- •Интервалы между повторными введениями
- •Применение в клинике
- •Осложнения Недостаточная аналгезия
- •Пневмоторакс
- •Повреждение сосудов
- •Токсическое действие локального анестетика
- •Повреждение нерва
- •Заключение
- •Список литературы
- •Анатомия
- •Механизм аналгезии
- •Методика
- •Положение пациента и ориентиры
- •Выполнение процедуры
- •Выбор локального анестетика и его дозировка Концентрация бупивакаина
- •Объем вводимого раствора
- •Другие локальные анестетики
- •Адреналин
- •Интервалы между повторными введениями Интермиттирующие инъекции
- •Длительные внутриплевральные инфузий
- •Применение в клинике
- •Протокол по интермиттирующей дозировке препарата в случае установки внутриплеврального катетера
- •Применение в клинике внутриплевральной региональной аналгезии
- •Причины неэффективности внутриплевральной региональной аналгезии после операции торакотомии
- •Осложнения
- •Пневмоторакс
- •Токсическое действие локального анестетика
- •Противопоказания
- •Заключение
- •Список литературы
- •Анатомия
- •Механизм действия
- •Методика Положение пациента и ориентиры
- •Выполнение
- •Варианты методики
- •Выбор локального анестетика и интервалы между повторными введениями
- •Применение в клинике
- •Сообщения об аналгезии при использовании паравертебральной невральной блокады в грудном отделе
- •Осложнения
- •Список литературы
- •Анатомия
- •Методика
- •Мониторинг и подготовка
- •Положение пациента и ориентиры
- •Выполнение процедуры
- •Околосрединный подход
- •Подход по средней линии
- •Контроль проникновения в эпидуральное пространство
- •Потеря сопротивления
- •«Висящая капля»
- •Ощущение прокола желтой связки
- •Легкость введения катетера
- •Физиологические реакции
- •Выбор анальгетиков и их дозировка
- •Влияние эпидуральной аналгезии локальными анестетиками в грудном отделе на сердечно-сосудистую систему Снижение артериального давления
- •Ориентировочные дозы препаратов при торакальной эпидуральной аналгезии
- •Сегментарное распределение симпатической иннервации в грудопоясничном отделе
- •Потребность миокарда в кислороде
- •Применение в клинике
- •Осложнения Прокол твердой мозговой оболочки
- •Прокол вены
- •Парестезия
- •Задержка мочи
- •Тошнота
- •Седация
- •Гипотензия
- •Противопоказания Инфекция
- •Снижение сердечного резерва
- •Заключение
- •Список литературы
- •Система свертывания крови и ее физиологическая оценка
- •Эпидуральная гематома
- •Клинические признаки и патофизиология
- •Эпидуральная гематома после субарахноидальной пункции
- •Эпидуральная гематома после эпидуральной анестезии
- •Клинические сообщения, демонстрирующие безопасность региональной анестезии у больных, применявших антикоагулянты
- •Региональная анестезия/аналгезия у больного в состоянии антикоагуляции: ориентиры для критического решительного анализа
- •Спинальное введение опиоидов перед кардиопульмональным шунтированием
- •Предоперационная оценка
- •Подкожное введение гепарина («мини-дозы»)
- •Нестероидные противовоспалительные препараты
- •Ведение больного в операционном и послеоперационном периодах
- •Сроки сохранения факторов свертывания в плазме
- •Послеоперационный мониторинг
- •Заключение
- •Список литературы
- •Историческая справка
- •Механизм действия
- •Технические аспекты
- •Продолжительность импульса
- •Постоянный поток или постоянный вольтаж
- •Форма волн
- •Частотность
- •Амплитуда
- •Установка электродов и множественные каналы стимуляции
- •Электроды
- •Сроки стимуляции
- •Побочное действие
- •Противопоказания
- •Эффективность чэсн в послеоперационном периоде: обзор литературы Методологические аспекты
- •Абдоминальная хирургия
- •Предварительные клинические исследования по чэсн
- •Ортопедические операции
- •Акушерские операции
- •Операции на сердце и на органах грудной клетки
- •Состояние после ампутации
- •Ориентировочные показания по использованию чэсн в послеоперационном периоде
- •Пациенты, у которых ожидается улучшение от чэсн
- •Рекомендуемая установка электродов и параметры стимулирования при проведении чэсн
- •Заключение
- •Список литературы
- •Психосоциальный контекст послеоперационной боли
- •Анальгетические вмешательства нехимиотерапевтического характера
- •Обучение
- •Введение в транс
- •Погружение в транс
- •Гипнотическая работа
- •Завершение
- •Релаксационная реакция
- •Достижение релаксационной реакции
- •Заключение
- •Список литературы
- •Предоперационные факторы и подготовка
- •Оценка степени выраженности боли Боль у ребенка, не умеющего говорить
- •Оценка степени боли
- •Терапевтические возможности преодоления послеоперационной боли в педиатрии
- •Системные анальгетики Анальгетики неопиоидного типа
- •Послеоперационные режимы назначения морфина методом акп
- •Опиоиды
- •Режимы дозировок в педиатрии при региональной анестезии/аналгезии
- •Пути введения Энтеральная аналгезия
- •Внутримышечное введение
- •Интермиттирующее внутривенное введение опиоидов
- •Продолжительное внутривенное введение опиоидов
- •Аналгезия, контролируемая пациентом (акп)
- •Региональная анестезия/аналгезия
- •Каудальный блок
- •Эпидуральная аналгезия в поясничном и грудном отделах
- •Блокада подвздошно-пахового и подвздошно-подчревного нервов
- •Блокада дорсального нерва полового члена
- •Блокада бедренного и бокового кожного нервов бедра
- •Блокада отсека подвздошной фасции
- •Внутриплевральная региональная аналгезия
- •Инфильтрационная аналгезия операционной раны
- •Заключение
- •Список литературы
- •Послеродовое разрешение физиологической адаптации периода беременности
- •Физиологическая адаптация во время беременности
- •Анальгетические возможности Внутримышечное введение опиоидов
- •Внутривенное введение опиоидов
- •Эпидуральное введение опиоидов
- •Режимы дозировки эпидурально и суб-арахноидально вводимых опиоидов для аналгезии после кесарева сечения
- •Меперидин
- •Фентанил
- •Суфентанил
- •Буторфанол
- •Бупренорфин
- •Сочетанное применение препаратов
- •Субарахноидальное введение опиоидов
- •Фентанил
- •Суфентанил
- •Эпидуральное введение клофелина
- •Аналгезия опиоидами и грудное вскармливание
- •Выбор аналгезии после кесарева сечения
- •Список литературы
- •Аналгезия после некоторых ортопедических операций Артропластика и протезирование тазобедренного сустава
- •Влияние региональной анестезии на показатели смертности после операции артропластики тазобедренного сустава
- •Аналгезия, контролируемая пациентом (акп)
- •Субарахноидальное введение опиоидов
- •Эпидуральное введение опиоидов и локальных анестетиков
- •Субарахноидальное введение опиоидов при артропластике и протезировании коленного и тазобедренного суставов
- •Операции со вскрытием коленного сустава
- •Общее назначение опиоидов
- •Субарахноидальное введение опиоидов
- •Эпидуральное введение опиоидов
- •Эпидуральное введение локального анестетика
- •Комбинированная аналгезия
- •Невральная блокада поясничного сплетения
- •Клиническая практика госпиталя Brigham и женского госпиталя
- •Артроскопия коленного сустава Внутрисуставное введение бупивакаина
- •Внутрисуставное введение морфина
- •Артропластика плечевого сустава Аналгезия, контролируемая пациентом (акп)
- •Блокада плечевого сплетения
- •Эпидуральная анестезия/аналгезия в области шеи
- •Ампутация
- •Открытое вправление и внутренняя фиксация переломов лодыжки
- •Невральная блокада седалищного нерва в подколенной области
- •Заключение
- •Список литературы
- •Физиологические нарушения после операций на грудной полости
- •Причины нарушений функции дыхания после торакотомии
- •Методы аналгезии Парентеральное введение опиоидов
- •Межреберная невральная блокада
- •Внутриплевральная региональная аналгезия
- •Паравертебральная невральная блокада
- •Криоаналгезия
- •Чрескожная электростимуляция нерва
- •Субарахноидальное введение опиоидов
- •Эпидуралыюе введение локальных анестетиков и опиоидов Введение локальных анестетиков
- •Введение опиоидов
- •Установка эпидурального катетера в грудном или поясничном отделе
- •Комбинированное применение локальных анестетиков и опиоидов
- •Влияние на дыхание
- •Порядок ведения торакальной эпидуральной аналгезии после торакотомии
- •Порядок ведения торакальной эпидуральной аналгезии комбинацией локального анестетика и опиоида
- •Рекомендации по дозировке препаратов при торакальной эпидуральной аналгезии
- •Особые проблемы аналгезии после торакотомии
- •Заключение
- •Список литературы
- •Патофизиология послеоперационной абдоминальной боли
- •Кожная соматическая боль
- •Сенсибилизация ноцицепторов
- •Глубокая соматическая боль
- •Висцеральная боль Трансдукция
- •Трансмиссия
- •Иррадиирующая боль
- •Предполагаемые механизмы иррадиирующей боли
- •Последовательные рефлекторные реакции
- •Кортикальные реакции
- •Физиологические нарушения после операций на брюшной полости Нарушения функции легких
- •Осложнения со стороны желудочно-кишечного тракта
- •Тромбоэмболия
- •Аналгезия при некоторых вмешательствах на брюшной полости
- •Операции на верхнем отделе брюшной полости Нестероидные противовоспалительные препараты
- •Аналгезия, контролируемая пациентом
- •Межреберная невральная блокада
- •Внутриплевральная региональная аналгезия
- •Влияние внутриплевральной региональной аналгезии (впа) в сочетании с обычным введением опиоидов на обезболивание и на легочную функцию после операции холецистэктомии
- •Субарахноидальное введение опиоидов
- •Эпидуральное введение локальных анестетиков и опиоидов
- •Операции на нижнем отделе брюшной полости
- •Аппендэктомия
- •Операции на толстом кишечнике
- •Влияние эпидуральной анестезии/аналгезии на двигательную активность желудочно-кишечного тракта
- •Опорожнение желудка и подвижность тонкого кишечника
- •Моторика толстого кишечника
- •Заключение
- •Список литературы
- •Два мнения: аналгезия против диагностики
- •Физиологические нарушения, связанные с травмой
- •Возможности аналгезии Парентеральное назначение анальгетиков
- •Региональная анестезия/аналгезия
- •Подкожная инфильтрационная анестезия
- •Инфильтрационная анестезия
- •Фоновая блокада
- •Периферическая невральная блокада
- •Блокада сплетения
- •Внутриплевральная региональная аналгезия
- •Эпидуральная аналгезия
- •Субарахноидальная аналгезия
- •Травмы головы
- •Травмы грудной клетки
- •Повреждения скелета
- •Заключение
- •Список литературы
- •Коммуникация
- •Врачебный вклад
- •Концепция «глобального гонорара»
- •Администрация Департамент управления
- •Администрация госпиталей
- •Приобретение оборудования
- •Маркетинг
- •Заключение
- •Список литературы
- •Формирование эффективно работающих бригад по устранению боли: общий и женский госпиталь brigham
- •Группа задач, связанных с акп
- •Распределение препаратов
- •Участие медицинских сестер в переориентировке целей
- •Объекты проведения целевых усилии
- •Альтернативные методы контроля боли
- •Поза, позиционная установка
- •Сон, релаксация
- •Тошнота, рвота
- •Устранение боли дополнительное руководство по аналгезии, контролируемой пациентом
- •Общая информация:
- •Критерии акп Предлагаемые критерии акп совместно с лечением
- •Аналгезия, контролируемая пациентом
- •Общие указания Обучение пациента/родственников
- •Сестринский департамент госпиталя Протокол анестезии, контролируемой пациентом Реабилитационное отделение
- •Сестринский департамент госпиталя Соображения в случаях неадекватности аналгезии
- •Сестринский департамент госпиталя Инструкция по титрованию и введению «спасительной» дозы при акп-плюс
- •Сестринский департамент госпиталя Инструкция по титрованию и по введению «спасительной» дозы при акп-плюс
- •Список литературы
- •Персональный фактор
- •Анестезиолог
- •Сестринская помощь
- •Фармакологическая служба
- •Приготовление некоторых растворов для эпидурального введения
- •Оборудование
- •Основные требования, предъявляемые к эпиду-ральным инфузионным системам
- •Простота и легкость в обращении
- •Ограничитель скорости потока
- •Четкость в идентификации прибора (обозначение)
- •Вход для инъекций
- •Безопасность
- •Портативность
- •Мониторы
- •Процедуры, проводимые службой острой боли
- •Документация
- •Рабочий документ службы по борьбе с острой болью Служба лечения боли bwh отделение анестезиологии
- •Типичный лист стандартных назначений для пациента, получающего акп Общий и женский госпиталь Brigham Учебный филиал медицинского университета Гарварда
- •Проблемы, стоящие перед службой острой боли
- •Проблемы, стоящие перед соб
- •Список литературы
- •Молекулярная фармакология
- •Нейроэндокринная система
- •Сердечно-сосудистая система
- •Дыхательная система
- •Пищеварительная система
- •Центральная нервная система
- •Механизм аналгезии
- •Клинические исследования аналгезии Общее назначение
- •Эпидуральное назначение
- •Субарахноидальное введение
- •Заключение
- •Список литературы
- •Послеоперационная боль
- •101000, Москва, Петроверигский пер., 6/8
- •143200, Г. Можайск, ул. Мира, 93.
Алкалоиды Морфин
Морфин служит прототипом агониста (рис. 8-11). Как указано выше, он относится к опиатам, т. е. к алкалоидам, получаемым из самого опиумного мака. Это растение все еще остается основным источником морфина, поскольку его химический синтез затруднен.
Фармакокинетика. После внутривенного введения морфин быстро распределяется в органах и тканях. Уже через 10 мин 96-98% этого препарата исчезает из плазмы крови. Объем распределения морфина относительно велик, что указывает на его интенсивное поглощение тканями, в том числе скелетными мышцами [97, 98].
Stanski и сотр. [98] показали, что пик концентрации препарата в крови наступает через 7,5-20 мин после его внутримышечного введения. Brunk и Delle [99] нашли, что в период от 15 мин до 3 ч концентрация морфина в крови поддерживается на более высоком уровне после внутримышечного и подкожного введения, чем после внутривенной инфузии. Очевидно, в последнем случае морфин быстрее выходит из плазмы, а при внутримышечном и подкожном введении создаются депо препарата, служащие источником его последующего поступления в кровь.
Быстрое исчезновение морфина из плазмы при внутривенном введении приводит к тому, что уровень его в крови не коррелирует с фармакологическим действием [100, 101]. Относительно замедленное проникновение морфина через гематоэнцефалический барьер можно объяснить его гидрофильностью. Пик концентрации морфина в цереброспинальной жидкости наступает через 15-30 мин после его внутривенной инфузии, а последующее снижение уровня происходит медленнее, чем соответствующее падение концентрации препарата в крови. Таким образом, аналгетическое действие морфина может не иметь явной связи с пиком его концентрации в крови после внутривенного введения.
Метаболизм: значение глюкуронидовых метаболитов. Основной путь метаболизма морфина - это его глюкуронизация, происходящая в печени, а также в других органах, например в почках [102]. Основные метаболиты морфина - морфин-3-глюкуронид и морфин-6-глюкуронид (рис. 8-12) [62, 103]. Морфин-6-глюкуронид обладает выраженными аналгезирующими свойствами и, возможно, в определенной степени определяет обезболивающее действие препарата. Этот метаболит в 45 раз активнее морфина при внутримозговом введении и в 4 раза - при подкожном введении [104].
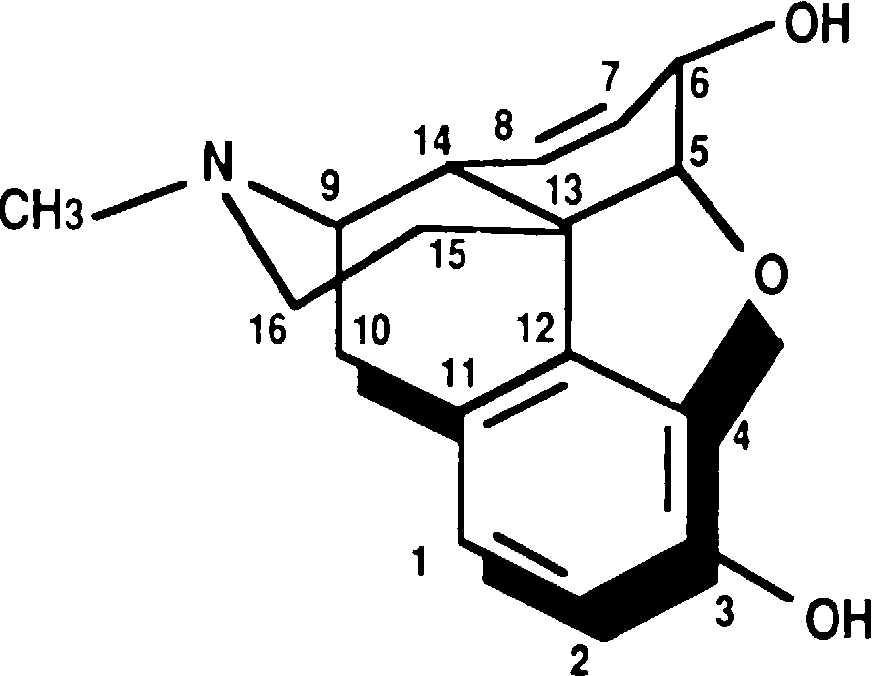
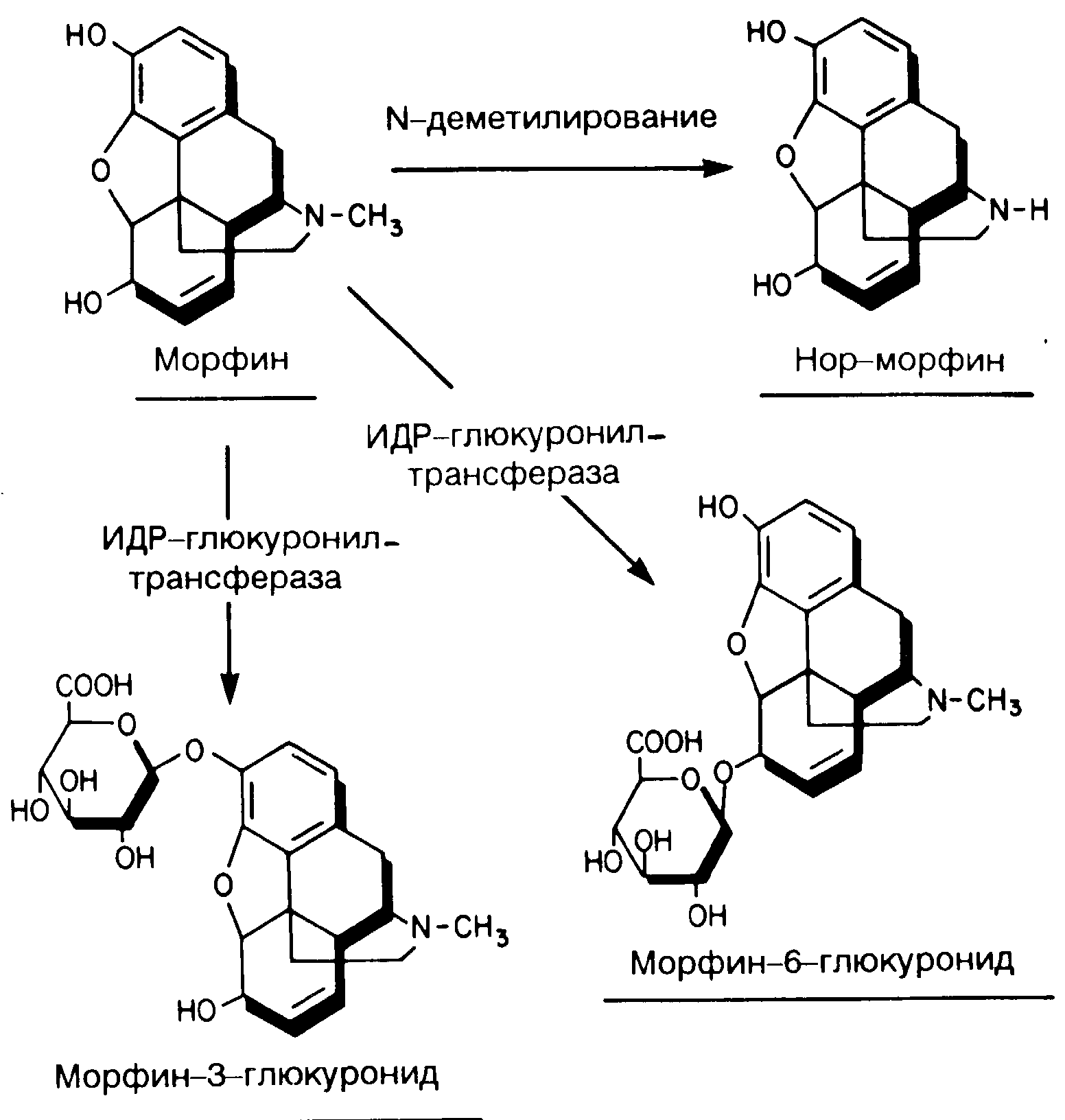
Рис. 8-12. Метаболизм морфина.
Основными метаболитами являются морфин-3-глюкуронид и морфин-6-глюкуронид. Последний обладает выраженным аналгезирующим действием и в значительной степени обусловливает обезболивающее влияние морфина. Оба метаболита выделяются с мочой и могут аккумулироваться при повторном назначении у больных с почечной недостаточностью. Деметилирование играет незначительную роль в метаболизме морфина.
Деметилирование играет незначительную роль в метаболизме морфина. Этому типу метаболизма подвергается около 5% введенной дозы препарата, преобразующегося в норморфин [105]. Проявлением обычного метаболизма морфина может быть также продукция небольшого количества кодеина.
Печень служит главным органом, осуществляющим метаболизм морфина [106]. Печеночная недостаточность почти не отражается на процессах глюкуронизации, и морфин хорошо переносится пациентами вплоть до развития состояния прекомы [107, 108].
Метаболиты морфина выводятся в основном с мочой, с желчью выделяется не более 7-10% продуктов его обмена. Менее 10% морфина выделяется почками в неизмененном виде. Процессы выведения не нарушаются даже у больных с почечной недостаточностью [62, 101, 109], однако активный метаболит (морфин-6-глюкуронид) может кумулироваться при снижении выделительной функции почек. Это вызывает продление действия, седацию и угнетение дыхания [110-114]. Поэтому у больных с почечной недостаточностью для обезболивания следует выбирать не опиоиды, а другие препараты.
Фармакологическое действие. Как указано выше, морфин является прототипом опиоидов. Основные его фармакологические свойства уже обсуждены в предыдущих разделах этой главы.
Использование в клинике и фармацевтические препараты. Морфин выпускают в виде гидрохлорида и сульфата. Для энтерального употребления имеются таблетки быстрого и замедленного действия, а также эликсир. Метаболизм принятого энтерально морфина проходит по первому из указанных выше путей, в общую циркуляцию попадает около 30% принятой дозы препарата. Несмотря на это, повторное назначение препаратов медленного действия обеспечивает хорошее обезболивание при выраженных и тяжелых болях хронического характера. Препараты быстрого действия используются для устранения внезапно возникающих болей и обеспечивают дополнительную аналгезию [115]. Морфин можно назначать ректально в свечах, а также в виде инъекций.
Кодеин
Кодеин это натуральный алкалоид группы морфина. Он образуется при субституции метиловой группы в С3 молекулы морфина (рис. 8-13). В результате подобного замещения снижается метаболизм этого препарата в печени (метаболизм первого прохождения), что усиливает эффект действия кодеина.
Фармакокинетика. После всасывания кодеин подвергается метаболизму в печени (преимущественно деметилирование с образованием норкодеина) и затем выделяется почками. В отличие от морфина он выводится преимущественно в неактивной форме. Около 10% введенной дозы кодеина после деметилирования трансформируется в морфин. Именно данная фракция объясняет обезболивающее действие кодеина, поскольку сам он обладает очень слабым аффинитетом к опиоидным рецепторам [73, 116].
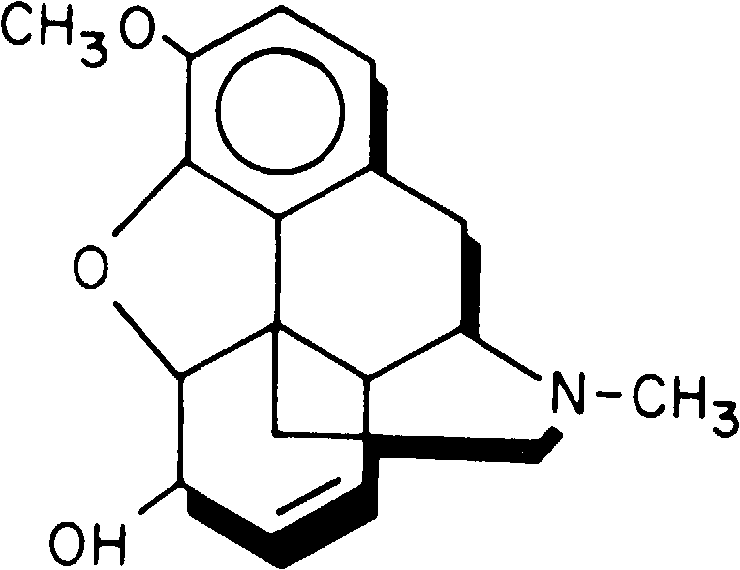
Рис. 8-13. Кодеин синтезируется путем подстановки метильной группы к С3 в молекуле морфина. Кодеин относится к алкалоидам, встречающимся в природе. Он значительно активнее при энтеральном приеме, так как в незначительной степени подвержен метаболизму при первичном прохождении.
Фармакологическое действие. Кодеин обладает слабым или умеренным обезболивающим действием, его не следует применять при выраженных болях. Точно так же ограничена его способность вызывать седативный эффект, тошноту, рвоту и угнетать дыхание. Кодеин выпускают и для инъекций, но внутривенное введение препарата не рекомендовано, поскольку его способность стимулировать высвобождение гистамина выражена даже сильнее, чем у морфина. Вероятность развития наркотической зависимости при приеме кодеина очень невелика (см. табл. 8-11).
Использование в клинике и фармацевтические препараты. Энтеральный прием кодеина в дозе 15 мг оказывает выраженное противокашлевое действие. При повышении дозы до 60 мг этот эффект усиливается [117]. Кодеин обычно включают в состав комплексных препаратов, используя его противокашлевое действие, а также часто комбинируют с неопиоидными анальгетиками для снятия легких или умеренных болей [118]. Максимальный обезболивающий эффект отмечают при дозе 60 мг, эквивалентной 650 мг ацетилсалициловой кислоты (аспирин). При внутримышечном введении 130 мг кодеина эквивалентны 10 мг морфина.
Полусинтетические опиоиды
Эта группа опиоидов объединяет препараты, получаемые синтетическим путем при простой химической модификации молекулы морфина (см. рис. 8-2). В природных условиях данные препараты не встречаются.
Диацетилморфин (героин, диаморфин)
Диацетилморфин (рис. 8-14) это представитель препаратов, не связывающихся с опиоидными рецепторами и не оказывающих аналгезирующего действия. Он подвержен быстрому гидролизу с образованием 6-моно-ацетилморфина и морфина. Фармакологический профиль диацетилморфина очень похож на профиль морфина и не имеет преимуществ перед ним при внутримышечном или энтеральном введении [119, 120]. До сих пор не установлено, есть ли у диацетилморфина какие-либо преимущества перед морфином при внутривенном, эпидуральном или субарахноидальном при менении. Диацетилморфин запрещен к производству и применению в США из-за его способности быстро вызывать наркотическую зависимость.
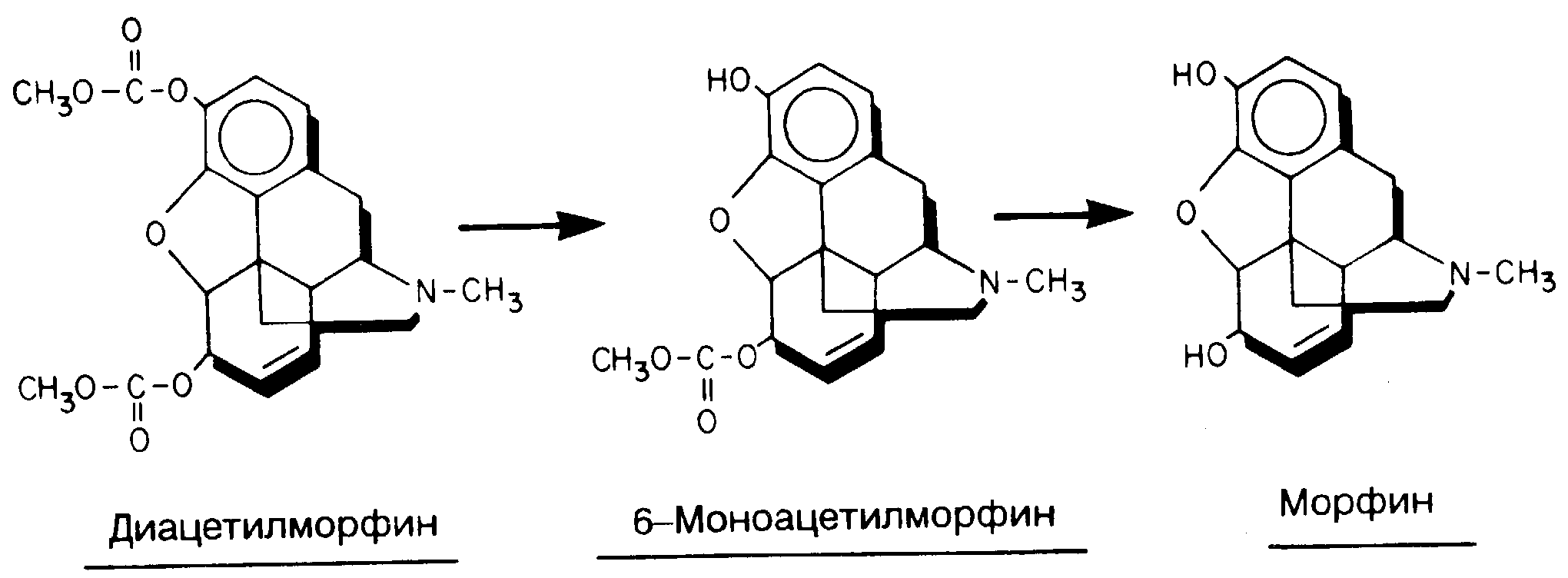
Рис. 8-14. Диацетилморфин относится к продуктам, быстро гидролизирующимся в плазме с образованием моноацетилморфина (обладающего болеутоляющим действием) и морфина.
Гидроморфон (дилаудид)
Гидроморфон (см. рис. 8-2) при парентеральном введении действует примерно в 7-8 раз сильнее морфина. Клинико-морфологический его профиль такой же, как у морфина [121, 122]. Есть не внушающие большого доверия сообщения о меньшей частоте побочных реакций (тошнота, рвота, угнетение дыхания, ретенция мочи и запоры), однако подтверждений подобных сведений мало [121].
Фармакокинетика. Несмотря на многолетнее применение гидроморфона в клинике, фармакокинетика этого препарата изучена недостаточно [123]. Недавно было установлено, что скорость распределения препарата в тканях такая же, как и у морфина. Около 90% препарата исчезают из плазмы крови уже через 10 мин после его введения. Выделение гидроморфона, как и морфина, зависит от его быстрого потребления тканями с последующим медленным выходом обратно в кровь [124].
Использование в клинике и фармацевтические препараты. Гидроморфон в отличие от морфина, кодеина и меперидина не подвергается метаболизму с образованием норгидроморфона [116]. Эта особенность делает применение гидроморфона особенно целесообразным у пациентов с почечной недостаточностью. В остальных отношениях фармакологический профиль гидроморфона почти не отличается от такового морфина, что не позволяет говорить о его преимуществах.
Гидроморфон выпускают в таблетках, содержащих от 1 до 4 мг препарата. Растворы для инъекций содержат его в дозах 1, 2 и 4 мг/мл. Внутримышечное введение 1,5 мг гидроморфона оказывает действие, эквивалентное 10 мг морфина. Аналгезирующий эффект продолжается 3-5 ч. Обезболивающее действие препарата при энтеральном приеме в 5 раз слабее, чем при внутримышечном введении. Имеются свечи с гидроморфоном для ректального введения [125, 126].
Оксиморфон (нуморфан)
Оксиморфон синтезируют путем присоединения гидроксильной группы к С14 в молекуле гидроморфона (см. рис. 8-2). При парентеральном введении оксиморфон примерно в 10 раз активнее морфина [127, 128]. Соотношение активности оксиморфона при энтеральном и парентеральном назначении составляет 1:6 [128]. Клинико-фармакологический профиль в остальных отношениях такой же, как у морфина. Отмечается быстрое развитие наркотической зависимости (такое же, как у героина) и слабое высвобождение гистамина (см. табл. 8-11) [129, 130]. Отдельные сообщения о большой частоте побочных реакций (тошнота и рвота) большинством исследователей подтверждены не были.
Важное значение имеет структурное сходство между оксиморфоном и налоксоном (рис. 8-15). Налоксон (опиоидный антагонист) представляет собой N-аллил-(—СН2—СН=СН2)-замещенный аналог оксиморфона. Структурное сходство этих двух опиоидов используют для изучения взаимоотношений между структурой и активностью, для уточнения взаимодействия агонистов, антагонистов и рецепторов, а также для синтеза новых агонистов [131 134].
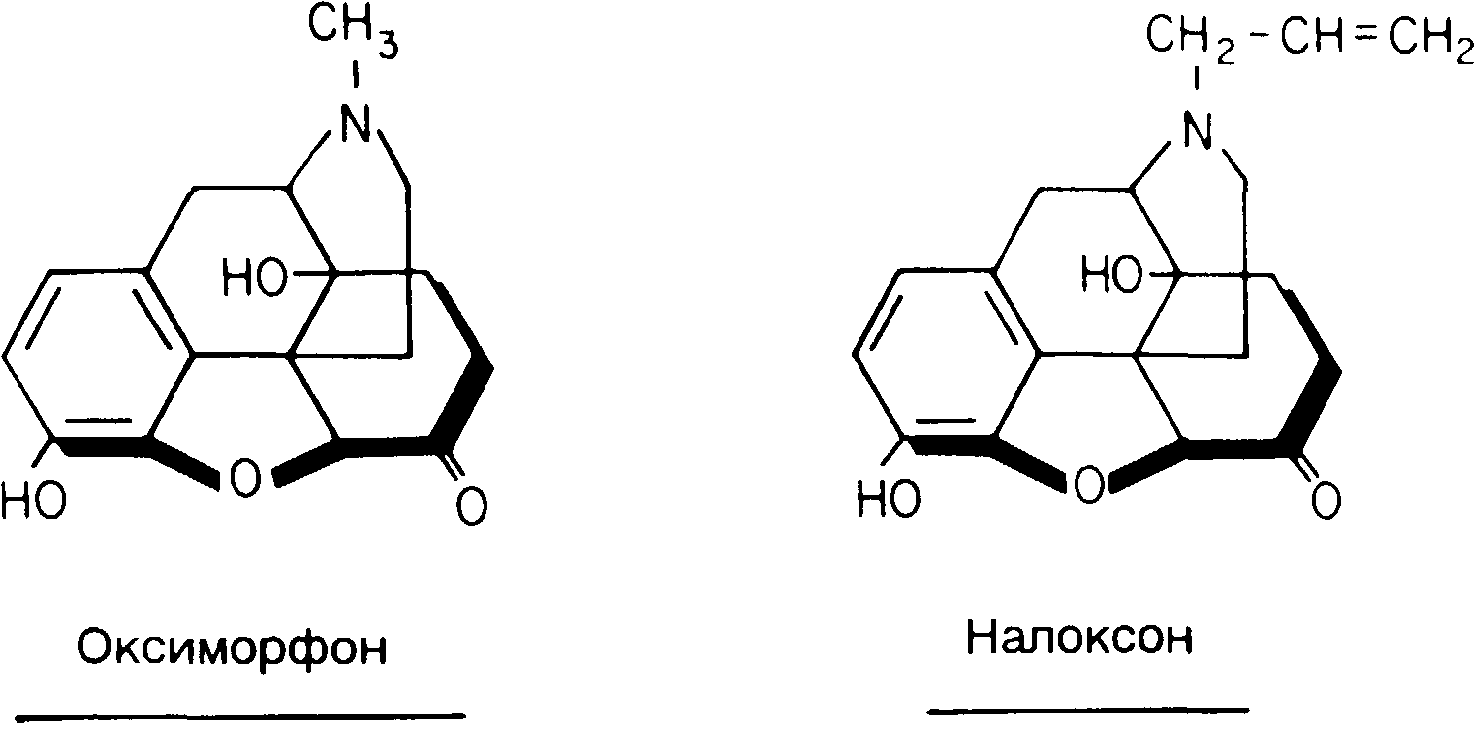
Рис. 8-15. Налоксон (антагонист опиоидов) является N-аллил-(—СН2—СН=СН2)-замещенным аналогом оксиморфона, мощного μ-агониста.
Фармакокинетика. Фармакокинетика оксиморфона изучена недостаточно Менее 10% введенной дозы препарата выводится мочой в неизмененном виде [135].
Использование в клинике и фармацевтические препараты. Проводились обширные исследования по использованию оксиморфона для подкожной и внутривенной АКП [136-139]. Высокая активность препарата, кратковременность его действия и возможность энтерального приема сделала перспективными исследования по трансдермальному введению оксиморфона [140]. Обычная доза при чрескожном и внутримышечном введении оксиморфона равна 1-1,5 мг каждые 4-6 ч. При внутривенной инфузии начальная доза составляет 1,5 мг.
Выпускают оксиморфон в ампулах, содержащих 1 или 1,5 мг/мл вещества. Имеются также ректальные свечи, активность препарата в которых в 10 раз меньше, чем активность той же дозы при внутримышечном введении [141].
Гидрокодон (гикодан, лортаб, викодин, туссионекс)
Клинико-фармакологический профиль гидрокодона такой же, как у кодеина. Он хорошо всасывается при энтеральном приеме (около 50%) и оказывает выраженное противокашлевое действие (см. табл. 8-10). Гидрокодон используют только энтерально обычно в комбинации с другими неопиоидными анальгетиками для получения обезболивающего эффекта.
Фармакокинетика. Гидрокодон подвергается 0-демегилированию, N-деалкализации и 6-кеторедукции [142]. Полагают, что при метаболизме в печени он может образовать гидроморфон. Последнее обстоятельство способно объяснить два описанных в литературе случая смерти после приема гидрокодона в качестве противокашлевого средства [143].
Использование в клинике и фармацевтические препараты. Гидрокодон обычно выпускают в комбинации с ацетаминофеном или с ацетилсалициловой кислотой. Подобное сочетание обеспечивает синергизм действия, уровень обезболивания соответствует действию удвоенной дозы каждого из этих препаратов. Побочные же эффекты при этом ослабевают [144].
Оксикодон (перкоцет, перкодон, роксицет, роксикодон, тилокс)
Фармакологический профиль оксикодона такой же, как у морфина. Подобно кодеину и гидрокодону, оксикодон хорошо всасывается после приема внутрь, оказывая обезболивающее действие в течение не менее получаса. Оксикодон выпускают обычно в комбинации с другими анальгетиками неопиоидного ряда. Оксикодон не используют как противокашлевое средство. Кроме того, препарат обладает значительным потенциалом в отношении наркотической зависимости [145].
Фармакокинетика. Фармакокинетика оксикодона, как и большинства других полусинтетических опиоидов, изучена недостаточно. Продуктом его метаболизма является нороксикодон [146, 147].
Использование в клинике и фармацевтические препараты. В США оксикодон назначают только энтерально. При этом его действие в 4 раза слабее, чем у гидрокодона. Препараты для парентерального применения в США не используют. Продолжается изучение средств для трансдермального введения [148].
