
- •Москва медицина 1998 Издание рекомендовано для перевода академиком рамн
- •Майкл Ферранте
- •Значимость проблемы послеоперационной боли
- •Распространенность проблемы по данным исследований
- •Распространенность проблемы по хирургическим данным
- •Боль, обусловленная хирургическим вмешательством (в порядке снижения интенсивности)1 Операции на желудке
- •Сопоставление разных методов аналгезии (международное исследование)
- •Региональная анестезия/аналгезия и легочные осложнения
- •Региональная анестезия/аналгезия и заболевания в послеоперационном периоде
- •Аналгезия, контролируемая пациентом
- •Премедикация и техника анестезии
- •Факторы, обусловливающие неадекватный контроль послеоперационной боли
- •Недостаток рутинной количественной оценки
- •Побочное действие анальгетиков
- •Индивидуальные различия реакции на анальгетики
- •Направления и пути решения
- •Периферическая нервная система Основы анатомии
- •Микроскопическое строение
- •Трансдукция Характеристика ноцицепторов
- •Категории ноцицепторов
- •Миелинизированные ноцицепторы
- •Немиелинизированные ноцицепторы
- •Роль ноцицепторов в перцепции боли
- •Сенсибилизация и гиперсенсибилизация
- •Биохимические субстраты
- •Трансдукция в глубоких соматических тканях
- •Суставы
- •Трансдукция в висцеральных органах
- •Резюме по вопросам трансдукции
- •Центральная нервная система
- •Ультраструктура спинного мозга
- •Ультраструктура головного мозга
- •Главные структуры ствола мозга
- •Таламус
- •Трансмиссия Первичные афферентные волокна в заднем корешке
- •Первичные афферентные волокна в спинном мозге
- •Терминалы первичных афферентов
- •Нейротрансмиттеры первичных аффекторов
- •Трансмиссионные клетки в спинном мозге Анатомия
- •Центральная гиперсенсибилизация, или нервное перевозбуждение
- •Восходящие ноцицептивные проводящие пути
- •Спиноталамический путь (стп)
- •Вентральный спиноталамический путь
- •Спинно-ретикулярный путь (срп)
- •Спинно-мезэнцефалический путь (смп)
- •Дорсальный столб постсинаптической спинно-медуллярной системы
- •Проприоспинальная мультисинаптическая восходящая система
- •Ростральные центры Ретикулярная формация
- •Таламус
- •Гипоталамус и лимбическая система
- •Кора мозга
- •Резюме по вопросам трансмиссии
- •Модуляция
- •Аналгезия, возникающая при стимуляции
- •Аналгезия, обеспечиваемая опиоидами
- •Анатомия нисходящей модулирующей системы Средний мозг
- •Продолговатый мозг
- •Кора и промежуточный мозг
- •Нейротрансмиттеры нисходящих проводящих путей Норадреналин
- •Серотонин
- •Эндогенные опиоиды
- •Резюме по вопросам модуляции
- •Пути контроля теории боли
- •Периферический отдел автономной нервной системы
- •Ганглии и сплетения периферического отдела автономной нервной системы
- •Эндокринные
- •Обменные
- •Обмен липидов
- •Стрессовые гормоны - это еще не результаты (некоторые предостережения)
- •Заключение
- •Структуры, расположенные в позвоночном канале Спинной мозг
- •Кровоснабжение позвоночного канала Артерии
- •Методы, вызывающие боль Турникетный болевой тест
- •Побочные действия
- •Гастропатия
- •Нспвп и преодоление боли в послеоперационном периоде
- •Опиоиды
- •Соотношение структуры и активности
- •Фармакодинамика Эндогенные опиоидныс пептиды
- •Опиоидные рецепторы
- •Классификация типов рецепторов и их предполагаемое действие
- •Связывание рецепторов и их реакция: истинная активность
- •Пути поступления препаратов
- •Проникновение к рецепторам
- •Фармакология Действие на центральную нервную систему
- •Гипнотическое действие опиоидов (в порядке снижения активности)
- •Метадон
- •Меперидин
- •Алкалоиды Морфин
- •Синтетические опиоиды Леворфанол (лево-дроморан)
- •Метадон (дольфин)
- •Смешанные агонист-антагонисты Налбуфин (нубаин)
- •Частичные агонисты Бупренорфин (бупренекс)
- •Пероральные антагонисты Налтрексон
- •Заключение
- •Список литературы
- •Соотношение рКд к процентному содержанию основных форм и время развития 50% проводникового блока в изолированном нерве
- •Факторы, влияющие на анестезиологическую активность
- •Дозировка
- •Добавки
- •Беременность
- •Фармакокинетика
- •Абсорбция
- •Распределение
- •Метаболизм и выведение
- •Токсичность
- •Общая токсичность
- •Токсичность для центральной нервной системы
- •Токсичность для сердечно-сосудистой системы
- •Различные системные эффекты
- •Аллергические реакции
- •Местное токсическое воздействие
- •Осложнения региональной анестезии
- •Эпидуральная анестезия
- •Уровень блокады
- •Доза препарата
- •Особенности локального анестетика
- •Дополнительное введение вазоконстрикторов
- •Волемическое состояние, объем циркулирующей крови
- •Спинальная анестезия
- •Препараты для локальной анестезии Препараты из группы аминоэфиров Кокаин
- •Прокаин (новокаин)
- •Хлоропрокаин
- •Тетракаин
- •Препараты из группы аминоамидов Лидокаин
- •Мепивакаин
- •Прилокаин
- •Бупивакаин
- •Этидокаин
- •Другие препараты Дибукаин
- •Бензокаин
- •Заключение
- •Список литературы
- •Внутривенная аналгезия, контролируемая пациентом Определение методов акп и параметры дозировок
- •Инфузионная технология акп
- •Характеристика прибора
- •Факторы, относящиеся к оценке акп-инфузоров
- •Безопасность
- •Неблагоприятные реакции и побочное действие
- •Проблемы, связанные с работой приборов (механические проблемы)
- •Взаимодействие прибора и пользователя
- •Образец (парадигма) акп
- •Непрерывная инфузионная аналгезия для преодоления острой боли
- •Индивидуализация требований аналгезии
- •Вопросы фармакокинетики
- •Факторы фармакодинамики
- •Психологические факторы
- •Подкожная аналгезия, контролируемая пациентом
- •Эпидуральная аналгезия, контролируемая пациентом
- •Заключение
- •Список литературы
- •Клиническое использование эпидурального введения опиоидов Механизм действия
- •Значение растворимости в липидах
- •Опиоиды; обычно используемые для эпидурального введения
- •Клиническая характеристика эпидуральных опиоидов (после однократной инъекции)
- •Наступление аналгезии
- •Продолжительность аналгезии
- •Ростральная миграция в цсж
- •Место инъекции
- •Интермитткрующие инъекции или продолжительные инфузии?
- •Опиоиды, обычно используемые для эпидуральных инфузий 1
- •Клиническая практика госпиталя Brigham и женского госпиталя
- •Показания к применению
- •Субарахноидальное введение опиоидов в клинике
- •Побочное действие спинальных опиоидов
- •Угнетение дыхания
- •Тошнота
- •Задержка мочи
- •Активация латентной герпетической инфекции
- •Угнетение функции желудочно-кишечного тракта
- •Неврологические эффекты
- •Мониторинг
- •Заключение
- •Список литературы
- •Балансированная аналгезия
- •Эпидуральное введение локальных анестетиков
- •Влияние эпидуральной блокады на сердечно-сосудистую систему
- •Интермиттирующие инъекции
- •Продолжительные инфузии
- •Тахифилаксия
- •Общие сведения
- •Механизм тахифилаксии
- •Гипотетические механизмы тахифилаксии при эпидуральном введении локальных анестетиков
- •Клинические особенности эпидуральной анестезии при комбинации локальных анестетиков и опиоидов Синергизм аналгезии
- •Клинические особенности совместного назначения локальных анестетиков и опиоидов
- •Угнетение тахифилаксии
- •Угнетение центральной гиперсенсибилизации: концепция преимущественной аналгезии
- •Угнетение ноцицептивной трансмиссии: афферентный «барраж»
- •Продолжительность действия
- •Клинические исследования
- •Совместное эпидуральное применение локальных анестетиков и опиоидов
- •Эпидуральные инфузии локальных анестетиков и опиоидов: клиническая практика госпиталя -brigham и женского госпиталя
- •Комбинации локальных анестетиков и опиоидов для эпидуральной инфузии
- •Приготовление некоторых растворов для эпидурального введения
- •Выявление нарушений
- •Обычные проблемы, возникающие при проведении эпидуральной аналгезии
- •Осложнения и побочное действие
- •Заключение
- •Список литературы
- •Анатомия
- •Механизм действия
- •Методика Паховый параваскулярный метод
- •Противопоказания
- •Применение в клинике
- •Заключение
- •Список литературы
- •Анатомия
- •Симпатическая иннервация верхней конечности
- •Методика
- •Процедура Подмышечный подход
- •Межскаленный подход
- •Подключичный периваскулярный доступ
- •Подключичный (инфраклавикулярный) доступ
- •Выбор локального анестетика и его дозировка
- •Применение в клинике
- •Осложнения
- •Токсическое действие локальных анестетиков
- •Повреждение нерва
- •Заключение
- •Список литературы
- •Анатомия
- •Механизм действия
- •Методика Положение пациента и ориентиры
- •Выполнение процедуры
- •Возможные технические трудности
- •Варианты методики
- •Выбор локального анестетика и его дозировка
- •Интервалы между повторными введениями
- •Применение в клинике
- •Осложнения Недостаточная аналгезия
- •Пневмоторакс
- •Повреждение сосудов
- •Токсическое действие локального анестетика
- •Повреждение нерва
- •Заключение
- •Список литературы
- •Анатомия
- •Механизм аналгезии
- •Методика
- •Положение пациента и ориентиры
- •Выполнение процедуры
- •Выбор локального анестетика и его дозировка Концентрация бупивакаина
- •Объем вводимого раствора
- •Другие локальные анестетики
- •Адреналин
- •Интервалы между повторными введениями Интермиттирующие инъекции
- •Длительные внутриплевральные инфузий
- •Применение в клинике
- •Протокол по интермиттирующей дозировке препарата в случае установки внутриплеврального катетера
- •Применение в клинике внутриплевральной региональной аналгезии
- •Причины неэффективности внутриплевральной региональной аналгезии после операции торакотомии
- •Осложнения
- •Пневмоторакс
- •Токсическое действие локального анестетика
- •Противопоказания
- •Заключение
- •Список литературы
- •Анатомия
- •Механизм действия
- •Методика Положение пациента и ориентиры
- •Выполнение
- •Варианты методики
- •Выбор локального анестетика и интервалы между повторными введениями
- •Применение в клинике
- •Сообщения об аналгезии при использовании паравертебральной невральной блокады в грудном отделе
- •Осложнения
- •Список литературы
- •Анатомия
- •Методика
- •Мониторинг и подготовка
- •Положение пациента и ориентиры
- •Выполнение процедуры
- •Околосрединный подход
- •Подход по средней линии
- •Контроль проникновения в эпидуральное пространство
- •Потеря сопротивления
- •«Висящая капля»
- •Ощущение прокола желтой связки
- •Легкость введения катетера
- •Физиологические реакции
- •Выбор анальгетиков и их дозировка
- •Влияние эпидуральной аналгезии локальными анестетиками в грудном отделе на сердечно-сосудистую систему Снижение артериального давления
- •Ориентировочные дозы препаратов при торакальной эпидуральной аналгезии
- •Сегментарное распределение симпатической иннервации в грудопоясничном отделе
- •Потребность миокарда в кислороде
- •Применение в клинике
- •Осложнения Прокол твердой мозговой оболочки
- •Прокол вены
- •Парестезия
- •Задержка мочи
- •Тошнота
- •Седация
- •Гипотензия
- •Противопоказания Инфекция
- •Снижение сердечного резерва
- •Заключение
- •Список литературы
- •Система свертывания крови и ее физиологическая оценка
- •Эпидуральная гематома
- •Клинические признаки и патофизиология
- •Эпидуральная гематома после субарахноидальной пункции
- •Эпидуральная гематома после эпидуральной анестезии
- •Клинические сообщения, демонстрирующие безопасность региональной анестезии у больных, применявших антикоагулянты
- •Региональная анестезия/аналгезия у больного в состоянии антикоагуляции: ориентиры для критического решительного анализа
- •Спинальное введение опиоидов перед кардиопульмональным шунтированием
- •Предоперационная оценка
- •Подкожное введение гепарина («мини-дозы»)
- •Нестероидные противовоспалительные препараты
- •Ведение больного в операционном и послеоперационном периодах
- •Сроки сохранения факторов свертывания в плазме
- •Послеоперационный мониторинг
- •Заключение
- •Список литературы
- •Историческая справка
- •Механизм действия
- •Технические аспекты
- •Продолжительность импульса
- •Постоянный поток или постоянный вольтаж
- •Форма волн
- •Частотность
- •Амплитуда
- •Установка электродов и множественные каналы стимуляции
- •Электроды
- •Сроки стимуляции
- •Побочное действие
- •Противопоказания
- •Эффективность чэсн в послеоперационном периоде: обзор литературы Методологические аспекты
- •Абдоминальная хирургия
- •Предварительные клинические исследования по чэсн
- •Ортопедические операции
- •Акушерские операции
- •Операции на сердце и на органах грудной клетки
- •Состояние после ампутации
- •Ориентировочные показания по использованию чэсн в послеоперационном периоде
- •Пациенты, у которых ожидается улучшение от чэсн
- •Рекомендуемая установка электродов и параметры стимулирования при проведении чэсн
- •Заключение
- •Список литературы
- •Психосоциальный контекст послеоперационной боли
- •Анальгетические вмешательства нехимиотерапевтического характера
- •Обучение
- •Введение в транс
- •Погружение в транс
- •Гипнотическая работа
- •Завершение
- •Релаксационная реакция
- •Достижение релаксационной реакции
- •Заключение
- •Список литературы
- •Предоперационные факторы и подготовка
- •Оценка степени выраженности боли Боль у ребенка, не умеющего говорить
- •Оценка степени боли
- •Терапевтические возможности преодоления послеоперационной боли в педиатрии
- •Системные анальгетики Анальгетики неопиоидного типа
- •Послеоперационные режимы назначения морфина методом акп
- •Опиоиды
- •Режимы дозировок в педиатрии при региональной анестезии/аналгезии
- •Пути введения Энтеральная аналгезия
- •Внутримышечное введение
- •Интермиттирующее внутривенное введение опиоидов
- •Продолжительное внутривенное введение опиоидов
- •Аналгезия, контролируемая пациентом (акп)
- •Региональная анестезия/аналгезия
- •Каудальный блок
- •Эпидуральная аналгезия в поясничном и грудном отделах
- •Блокада подвздошно-пахового и подвздошно-подчревного нервов
- •Блокада дорсального нерва полового члена
- •Блокада бедренного и бокового кожного нервов бедра
- •Блокада отсека подвздошной фасции
- •Внутриплевральная региональная аналгезия
- •Инфильтрационная аналгезия операционной раны
- •Заключение
- •Список литературы
- •Послеродовое разрешение физиологической адаптации периода беременности
- •Физиологическая адаптация во время беременности
- •Анальгетические возможности Внутримышечное введение опиоидов
- •Внутривенное введение опиоидов
- •Эпидуральное введение опиоидов
- •Режимы дозировки эпидурально и суб-арахноидально вводимых опиоидов для аналгезии после кесарева сечения
- •Меперидин
- •Фентанил
- •Суфентанил
- •Буторфанол
- •Бупренорфин
- •Сочетанное применение препаратов
- •Субарахноидальное введение опиоидов
- •Фентанил
- •Суфентанил
- •Эпидуральное введение клофелина
- •Аналгезия опиоидами и грудное вскармливание
- •Выбор аналгезии после кесарева сечения
- •Список литературы
- •Аналгезия после некоторых ортопедических операций Артропластика и протезирование тазобедренного сустава
- •Влияние региональной анестезии на показатели смертности после операции артропластики тазобедренного сустава
- •Аналгезия, контролируемая пациентом (акп)
- •Субарахноидальное введение опиоидов
- •Эпидуральное введение опиоидов и локальных анестетиков
- •Субарахноидальное введение опиоидов при артропластике и протезировании коленного и тазобедренного суставов
- •Операции со вскрытием коленного сустава
- •Общее назначение опиоидов
- •Субарахноидальное введение опиоидов
- •Эпидуральное введение опиоидов
- •Эпидуральное введение локального анестетика
- •Комбинированная аналгезия
- •Невральная блокада поясничного сплетения
- •Клиническая практика госпиталя Brigham и женского госпиталя
- •Артроскопия коленного сустава Внутрисуставное введение бупивакаина
- •Внутрисуставное введение морфина
- •Артропластика плечевого сустава Аналгезия, контролируемая пациентом (акп)
- •Блокада плечевого сплетения
- •Эпидуральная анестезия/аналгезия в области шеи
- •Ампутация
- •Открытое вправление и внутренняя фиксация переломов лодыжки
- •Невральная блокада седалищного нерва в подколенной области
- •Заключение
- •Список литературы
- •Физиологические нарушения после операций на грудной полости
- •Причины нарушений функции дыхания после торакотомии
- •Методы аналгезии Парентеральное введение опиоидов
- •Межреберная невральная блокада
- •Внутриплевральная региональная аналгезия
- •Паравертебральная невральная блокада
- •Криоаналгезия
- •Чрескожная электростимуляция нерва
- •Субарахноидальное введение опиоидов
- •Эпидуралыюе введение локальных анестетиков и опиоидов Введение локальных анестетиков
- •Введение опиоидов
- •Установка эпидурального катетера в грудном или поясничном отделе
- •Комбинированное применение локальных анестетиков и опиоидов
- •Влияние на дыхание
- •Порядок ведения торакальной эпидуральной аналгезии после торакотомии
- •Порядок ведения торакальной эпидуральной аналгезии комбинацией локального анестетика и опиоида
- •Рекомендации по дозировке препаратов при торакальной эпидуральной аналгезии
- •Особые проблемы аналгезии после торакотомии
- •Заключение
- •Список литературы
- •Патофизиология послеоперационной абдоминальной боли
- •Кожная соматическая боль
- •Сенсибилизация ноцицепторов
- •Глубокая соматическая боль
- •Висцеральная боль Трансдукция
- •Трансмиссия
- •Иррадиирующая боль
- •Предполагаемые механизмы иррадиирующей боли
- •Последовательные рефлекторные реакции
- •Кортикальные реакции
- •Физиологические нарушения после операций на брюшной полости Нарушения функции легких
- •Осложнения со стороны желудочно-кишечного тракта
- •Тромбоэмболия
- •Аналгезия при некоторых вмешательствах на брюшной полости
- •Операции на верхнем отделе брюшной полости Нестероидные противовоспалительные препараты
- •Аналгезия, контролируемая пациентом
- •Межреберная невральная блокада
- •Внутриплевральная региональная аналгезия
- •Влияние внутриплевральной региональной аналгезии (впа) в сочетании с обычным введением опиоидов на обезболивание и на легочную функцию после операции холецистэктомии
- •Субарахноидальное введение опиоидов
- •Эпидуральное введение локальных анестетиков и опиоидов
- •Операции на нижнем отделе брюшной полости
- •Аппендэктомия
- •Операции на толстом кишечнике
- •Влияние эпидуральной анестезии/аналгезии на двигательную активность желудочно-кишечного тракта
- •Опорожнение желудка и подвижность тонкого кишечника
- •Моторика толстого кишечника
- •Заключение
- •Список литературы
- •Два мнения: аналгезия против диагностики
- •Физиологические нарушения, связанные с травмой
- •Возможности аналгезии Парентеральное назначение анальгетиков
- •Региональная анестезия/аналгезия
- •Подкожная инфильтрационная анестезия
- •Инфильтрационная анестезия
- •Фоновая блокада
- •Периферическая невральная блокада
- •Блокада сплетения
- •Внутриплевральная региональная аналгезия
- •Эпидуральная аналгезия
- •Субарахноидальная аналгезия
- •Травмы головы
- •Травмы грудной клетки
- •Повреждения скелета
- •Заключение
- •Список литературы
- •Коммуникация
- •Врачебный вклад
- •Концепция «глобального гонорара»
- •Администрация Департамент управления
- •Администрация госпиталей
- •Приобретение оборудования
- •Маркетинг
- •Заключение
- •Список литературы
- •Формирование эффективно работающих бригад по устранению боли: общий и женский госпиталь brigham
- •Группа задач, связанных с акп
- •Распределение препаратов
- •Участие медицинских сестер в переориентировке целей
- •Объекты проведения целевых усилии
- •Альтернативные методы контроля боли
- •Поза, позиционная установка
- •Сон, релаксация
- •Тошнота, рвота
- •Устранение боли дополнительное руководство по аналгезии, контролируемой пациентом
- •Общая информация:
- •Критерии акп Предлагаемые критерии акп совместно с лечением
- •Аналгезия, контролируемая пациентом
- •Общие указания Обучение пациента/родственников
- •Сестринский департамент госпиталя Протокол анестезии, контролируемой пациентом Реабилитационное отделение
- •Сестринский департамент госпиталя Соображения в случаях неадекватности аналгезии
- •Сестринский департамент госпиталя Инструкция по титрованию и введению «спасительной» дозы при акп-плюс
- •Сестринский департамент госпиталя Инструкция по титрованию и по введению «спасительной» дозы при акп-плюс
- •Список литературы
- •Персональный фактор
- •Анестезиолог
- •Сестринская помощь
- •Фармакологическая служба
- •Приготовление некоторых растворов для эпидурального введения
- •Оборудование
- •Основные требования, предъявляемые к эпиду-ральным инфузионным системам
- •Простота и легкость в обращении
- •Ограничитель скорости потока
- •Четкость в идентификации прибора (обозначение)
- •Вход для инъекций
- •Безопасность
- •Портативность
- •Мониторы
- •Процедуры, проводимые службой острой боли
- •Документация
- •Рабочий документ службы по борьбе с острой болью Служба лечения боли bwh отделение анестезиологии
- •Типичный лист стандартных назначений для пациента, получающего акп Общий и женский госпиталь Brigham Учебный филиал медицинского университета Гарварда
- •Проблемы, стоящие перед службой острой боли
- •Проблемы, стоящие перед соб
- •Список литературы
- •Молекулярная фармакология
- •Нейроэндокринная система
- •Сердечно-сосудистая система
- •Дыхательная система
- •Пищеварительная система
- •Центральная нервная система
- •Механизм аналгезии
- •Клинические исследования аналгезии Общее назначение
- •Эпидуральное назначение
- •Субарахноидальное введение
- •Заключение
- •Список литературы
- •Послеоперационная боль
- •101000, Москва, Петроверигский пер., 6/8
- •143200, Г. Можайск, ул. Мира, 93.
Фармакология Действие на центральную нервную систему
Опиоиды способны как подавлять, так и возбуждать центральную нервную систему. Подавление ЦНС клинически проявляется аналгезией, изменением характера дыхания, снижением уровня сознания и соответствующими сдвигами на электроэнцефалограмме. Стимулирующий или возбуждающий эффект выражается миозом, тошнотой и рвотой.
Аналгезия
Все экзогенные опиоиды оказывают обезболивающее действие, влияя на специфические рецепторы точно таким же образом, как это делают эндогенные опиоидные нейротрансмиттеры. Невральные проводящие пути и рецепторные механизмы развития аналгезии подробно описаны в гл. 2 и в предыдущем разделе данной главы.
Концепция дозирования для равной аналгезии
Интенсивность аналгезии или действенность отдельных опиоидов определяется, как было показано выше, следующими факторами:
доступом к рецепторам и
аффинитетом связывания («подгонка» к рецептору).
Доступ к рецептору для μ-агонистов зависит от следующих физико-химических и общих фармакологических характеристик:
липофильность;
величина рКа;
степень ионизации;
доля несвязанного препарата;
явный объем распределения;
клиренс;
пути введения препарата.
Таким образом, различия в клиническом действии отдельных опиоидов на самом деле отражают особенности физико-химических и фармакокинетических характеристик разных препаратов, а не различия их фармакодинамики. Эта концепция крайне важная для правильного клинического использования опиоидов. Так, все опиоиды способны обеспечить одинаковый обезболивающий эффект, быть одинаково действенными при соответствующей коррекции их дозировки с учетом путей введения и физико-химических и фармакологических характеристик (рис. 8-7, табл. 8-8). Эта концепция известна как концепция равнообезболиваюгцего дозирования [52, 53].
Схему равнообезболивающего дозирования, изображенную на рис. 8-7 и в табл. 8-8, следует использовать лишь в качестве ориентира. При создании подобных конверсионных таблиц приходится сталкиваться со множеством методологических проблем. Поэтому практический врач не должен быть догматиком при интерпретации приведенных в ней данных.
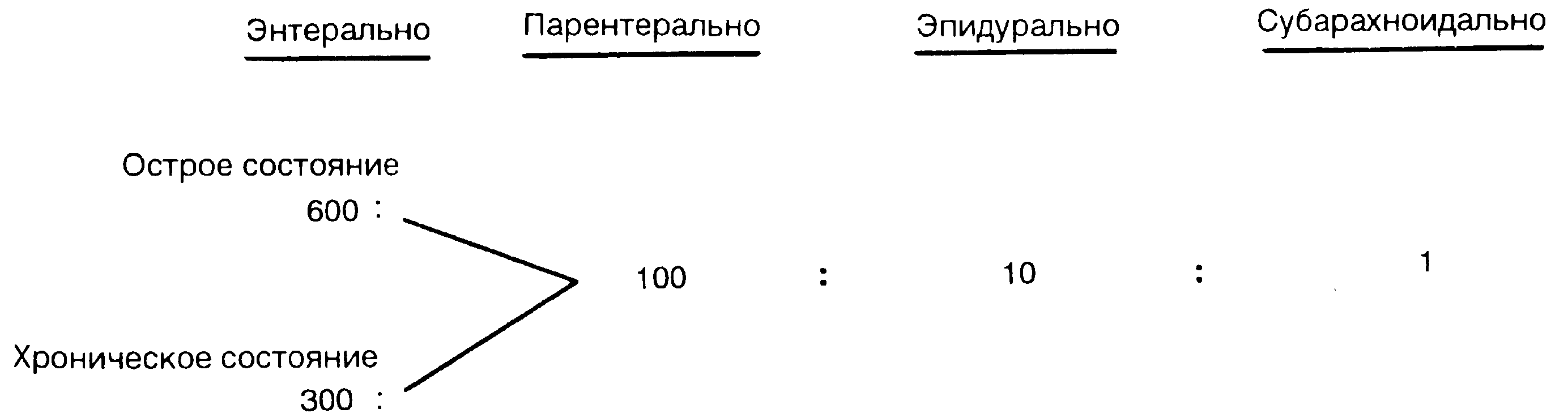
Рис. 8-7. Пути назначения препаратов в концепции равнообезболивающей конверсии.
Приведенное конверсионное соотношение является приблизительным, поэтому практикующий врач не должен быть догматиком в интерпретации полученных результатов.
Таблица 8-8. Аналгезические эквиваленты опиоидов
Опиоиды |
Пути введения |
Эквианалгезические дозы2 |
Морфин |
Парентерально 3 Энтерально |
10 мг 30 мг |
Кодеин |
Парентерально 3 Энтерально |
130 мг 200 мг |
Оксикодон |
Парентерально 3 Энтерально |
15 мг 30 мг |
Леворфанол |
Парентерально 3 Энтерально |
2 мг 4 мг |
Гидроморфон |
Парентерально 3 Энтерально |
1,5 мг 7,5 мг |
Меперидин |
Парентерально 3 Энтерально |
75 мг 300 мг |
Метадон |
Парентерально 3 Энтерально |
10 мг 20 мг |
Фентанил |
Парентерально 3 Энтерально |
100 мкг Не выпускается |
1Каждый препарат вводили в однократной дозе внутримышечно, а его действие сравнивали с действием морфина для определения относительной силы.
2Конверсию доз различных опиоидов проводили без учета возможной перекрестной переносимости (неполной устойчивости).
3Соотношение действенности морфина при энтеральном его введении к парентеральному в однократной дозировке по поводу острых или послеоперационных болей равно 1 :6. Это соотношение может снизиться до 1:3 или 1:2 при повторных введениях препарата (хронические боли). (По Foley, с разрешения [52].)
Замысел исследования. Схема равнообезболивающего дозирования традиционно основана на однократном внутримышечном введении опиоида. При этом сравнивают полученный эффект с действием морфина и вычисляют соотношение действенности препаратов [52]. Однако разные режимы введения препаратов обусловливают существенные вариации в величинах создающихся пиков концентрации препаратов и во времени их наступления. (Полное обсуждение ситуаций, встречающихся при рассасывании препаратов из мышечных депо, приведено в гл. 10.) Более практичным является сравнение действенности препаратов при их внутривенном введении.
В клинической практике продолжительную аналгезию редко удается обеспечить однократным введением опиоидов. Более реальным конверсионным ориентиром могла бы стать методика с использованием многократных дозировок. С этой целью проводятся исследования по внутривенной аналгезии, контролируемой самим пациентом (ВВ-АКП). Использование ВВ-АКП устраняет стремление экспериментировать, так как предоставляет пациенту самому определять, когда и сколько опиоидов он должен получить. ВВ-АКП также позволяет определить среднее потребление анальгетиков, несмотря на значительные различия в необходимости обезболивания [55-59].
Неполная перекрестная устойчивость. Развитие устойчивости к обезболивающему действию одного из опиоидов служит основанием для замены препарата. Более выраженный аналгезирующий эффект нового препарата в этих условиях объясняется неполным характером перекрестной устойчивости [60, 61]. Новый опиоид рекомендуют назначать в начальной дозе, равной половине равнообезболивающей. Подобная доза устанавливается эмпирически. Предполагается, что относительная эффективность опиоидов может нарастать при их повторном введении [53]. Необходимо отметить, что в табл. 8-8 не была учтена неполная перекрестная устойчивость.
Соотношение активности при оральном и парентеральном назначении. Биологическое использование морфина при его энтеральном введении варьирует от 15 до 64%, в среднем составляя 38% [62]. Большинство авторов полагают, что при парентеральном введении биологическое действие оказывают все 100% введенной дозы препарата. Поэтому при переходе с энтерального на парентеральный путь введения морфина важно правильно учесть особенности первоначального метаболизма этого препарата [63].
В случаях острой боли и при однократном применении отношение активности при оральном назначении морфина к его активности при парентеральном введении равно 1:6 [64]. При хронических болях и повторных назначениях морфина это отношение становится 1:2 или 1:3 [62, 65, 66]. Приведенные данные были получены эмпирически и адаптированы в отношении других опиоидов.
Эквивалентность активности при разных путях парентерального введения. Многие конверсионные схемы одинакового обезболивания основаны на предположении, что при подкожном (ПК), внутримышечном (ВМ) и внутривенном (ВВ) введении опиоиды действуют одинаково. Подобное предположение заранее допускает одинаковую биологическую активность независимо от пути введения препарата. Между тем установлены отдельные факты, позволившие многим авторам поставить под сомнение данное допущение.
В исследованиях Urquhart и сотр. [67] установлено, что при подкожном введении гидроморфона (ПК-АКП) для аналгезии требовалось значительно большее количество препарата, чем при внутривенном его введении (ВВ-АКП). Это наблюдение подтверждает неодинаковую биологическую активность препарата при разных путях его введения. По мнению автора, соотношение активности гидроморфона при ПК и ВВ введении варьирует от 1 : 1,5 до 1:2.
Дыхание
Все μ-агонисты и частичный агонист бупренорфин угнетают реакцию дыхательного центра в стволе мозга на повышенную концентрацию двуокиси углерода в крови (РСО2). Степень этого угнетения пропорциональна дозе опиоида. Препараты со свойствами агонист-антагонистов не вызывают столь выраженного угнетающего действия, зависящего от дозы, а оказывают лишь ограниченное влияние (так называемый потолочный эффект) [32]. Опиоиды со свойствами агонистов подавляют дыхательные центры также в области моста и продолговатого мозга, где регулируется ритм дыхания. Это проявляется удлинением пауз между вдохами, замедленным вдохом и появлением периодического дыхания [68, 69].
Снижение возбудимости дыхательных центров к СО2, вызванное μ-агонистами, сопровождается увеличением показателя РСО2 и смещением кривой реакции вправо (рис. 8-8). Под влиянием эквивалентных доз μ-агонисты вызывают одинаковые по степени нарушения дыхания и соответствующее смещение кривой реакции на СО2 [70-72]. Агонист-антагонисты также смещают кривую реакции на СО2 вправо, но при нарастающих дозах эта кривая приобретает закругленность («форма колокола»).
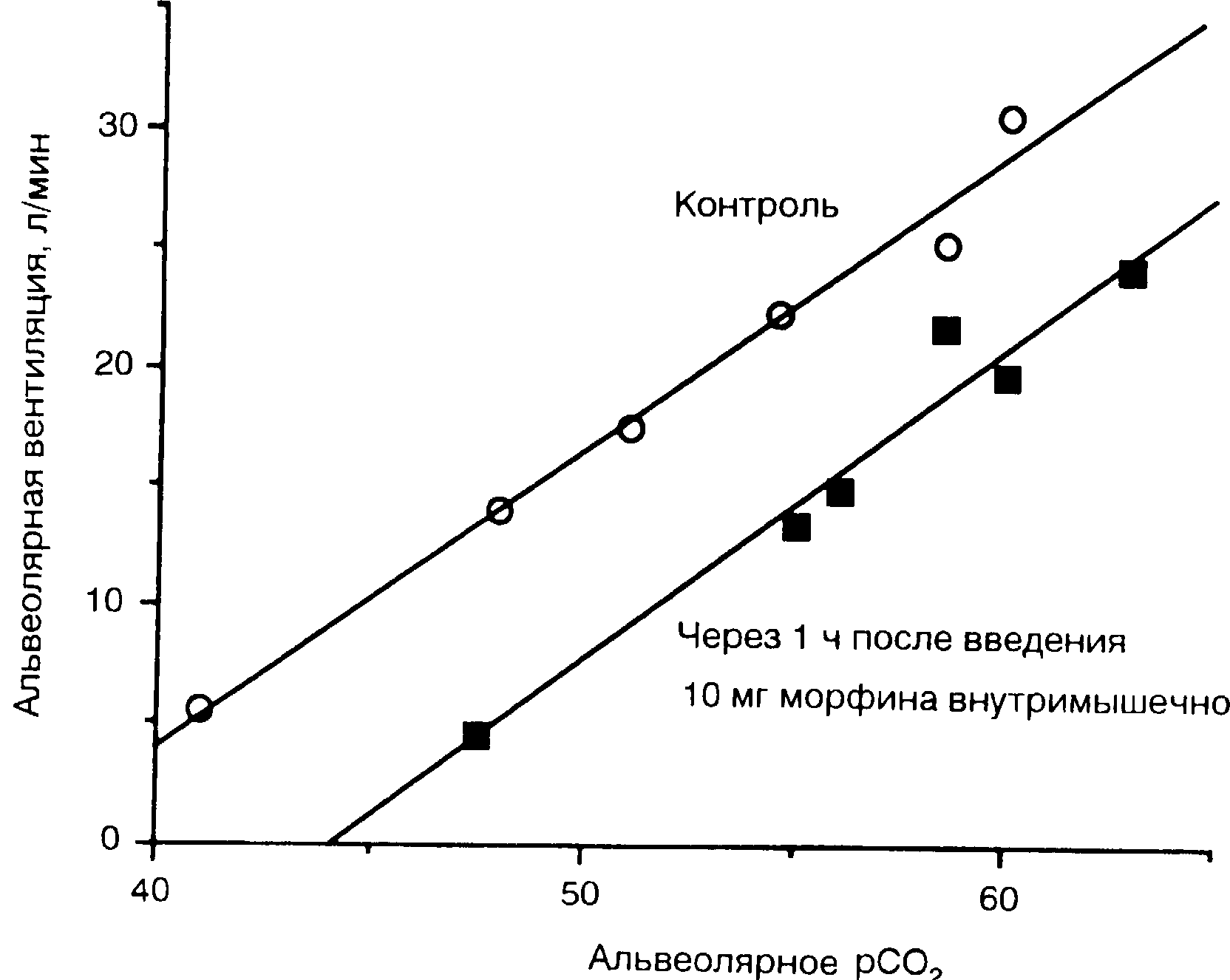
Рис. 8-8. Кривые реакции дыхания (СО2), полученные до и через 1 ч после внутримышечного введения 10 мг морфина.
Эквивалентные обезболивающие дозы опиоидов вызывают сопоставимые изменения реактивности дыхательных центров и одинаковое смещение кривой реакции на СО2 вправо.
Угнетение дыхания, вызванное опиоидами, в клинике выражается снижанием числа дыхательных движений и часто сопровождается увеличением дыхательного объема. Однако подобная компенсация оказывается явно недостаточной, что подтверждается ростом РСО2. После введения терапевтических доз препарата минутный объем дыхания может оставаться сниженным в течение 4-5 ч. Высокие дозы μ-агонистов или частичных агонистов вызывают апноэ. Особенно значительное угнетение дыхания под влиянием опиоидов отмечают у пожилых пациентов во время сна. В то же время боль в послеоперационном периоде противодействует угнетению дыхания опиоидами [71].
Снижение уровня сознания
Опиоиды относятся к препаратам, изменяющим душевное состояние. Больные, которые должны были бы испытывать боли, испытывают ощущение тепла, говорят о своем хорошем самочувствии, у них появляются сонливость и эйфория. Нарушения душевного состояния и восприятия окружающего, вероятно, опосредованы лимбической системой [73].
Таблица 8-9.
