
- •Москва медицина 1998 Издание рекомендовано для перевода академиком рамн
- •Майкл Ферранте
- •Значимость проблемы послеоперационной боли
- •Распространенность проблемы по данным исследований
- •Распространенность проблемы по хирургическим данным
- •Боль, обусловленная хирургическим вмешательством (в порядке снижения интенсивности)1 Операции на желудке
- •Сопоставление разных методов аналгезии (международное исследование)
- •Региональная анестезия/аналгезия и легочные осложнения
- •Региональная анестезия/аналгезия и заболевания в послеоперационном периоде
- •Аналгезия, контролируемая пациентом
- •Премедикация и техника анестезии
- •Факторы, обусловливающие неадекватный контроль послеоперационной боли
- •Недостаток рутинной количественной оценки
- •Побочное действие анальгетиков
- •Индивидуальные различия реакции на анальгетики
- •Направления и пути решения
- •Периферическая нервная система Основы анатомии
- •Микроскопическое строение
- •Трансдукция Характеристика ноцицепторов
- •Категории ноцицепторов
- •Миелинизированные ноцицепторы
- •Немиелинизированные ноцицепторы
- •Роль ноцицепторов в перцепции боли
- •Сенсибилизация и гиперсенсибилизация
- •Биохимические субстраты
- •Трансдукция в глубоких соматических тканях
- •Суставы
- •Трансдукция в висцеральных органах
- •Резюме по вопросам трансдукции
- •Центральная нервная система
- •Ультраструктура спинного мозга
- •Ультраструктура головного мозга
- •Главные структуры ствола мозга
- •Таламус
- •Трансмиссия Первичные афферентные волокна в заднем корешке
- •Первичные афферентные волокна в спинном мозге
- •Терминалы первичных афферентов
- •Нейротрансмиттеры первичных аффекторов
- •Трансмиссионные клетки в спинном мозге Анатомия
- •Центральная гиперсенсибилизация, или нервное перевозбуждение
- •Восходящие ноцицептивные проводящие пути
- •Спиноталамический путь (стп)
- •Вентральный спиноталамический путь
- •Спинно-ретикулярный путь (срп)
- •Спинно-мезэнцефалический путь (смп)
- •Дорсальный столб постсинаптической спинно-медуллярной системы
- •Проприоспинальная мультисинаптическая восходящая система
- •Ростральные центры Ретикулярная формация
- •Таламус
- •Гипоталамус и лимбическая система
- •Кора мозга
- •Резюме по вопросам трансмиссии
- •Модуляция
- •Аналгезия, возникающая при стимуляции
- •Аналгезия, обеспечиваемая опиоидами
- •Анатомия нисходящей модулирующей системы Средний мозг
- •Продолговатый мозг
- •Кора и промежуточный мозг
- •Нейротрансмиттеры нисходящих проводящих путей Норадреналин
- •Серотонин
- •Эндогенные опиоиды
- •Резюме по вопросам модуляции
- •Пути контроля теории боли
- •Периферический отдел автономной нервной системы
- •Ганглии и сплетения периферического отдела автономной нервной системы
- •Эндокринные
- •Обменные
- •Обмен липидов
- •Стрессовые гормоны - это еще не результаты (некоторые предостережения)
- •Заключение
- •Структуры, расположенные в позвоночном канале Спинной мозг
- •Кровоснабжение позвоночного канала Артерии
- •Методы, вызывающие боль Турникетный болевой тест
- •Побочные действия
- •Гастропатия
- •Нспвп и преодоление боли в послеоперационном периоде
- •Опиоиды
- •Соотношение структуры и активности
- •Фармакодинамика Эндогенные опиоидныс пептиды
- •Опиоидные рецепторы
- •Классификация типов рецепторов и их предполагаемое действие
- •Связывание рецепторов и их реакция: истинная активность
- •Пути поступления препаратов
- •Проникновение к рецепторам
- •Фармакология Действие на центральную нервную систему
- •Гипнотическое действие опиоидов (в порядке снижения активности)
- •Метадон
- •Меперидин
- •Алкалоиды Морфин
- •Синтетические опиоиды Леворфанол (лево-дроморан)
- •Метадон (дольфин)
- •Смешанные агонист-антагонисты Налбуфин (нубаин)
- •Частичные агонисты Бупренорфин (бупренекс)
- •Пероральные антагонисты Налтрексон
- •Заключение
- •Список литературы
- •Соотношение рКд к процентному содержанию основных форм и время развития 50% проводникового блока в изолированном нерве
- •Факторы, влияющие на анестезиологическую активность
- •Дозировка
- •Добавки
- •Беременность
- •Фармакокинетика
- •Абсорбция
- •Распределение
- •Метаболизм и выведение
- •Токсичность
- •Общая токсичность
- •Токсичность для центральной нервной системы
- •Токсичность для сердечно-сосудистой системы
- •Различные системные эффекты
- •Аллергические реакции
- •Местное токсическое воздействие
- •Осложнения региональной анестезии
- •Эпидуральная анестезия
- •Уровень блокады
- •Доза препарата
- •Особенности локального анестетика
- •Дополнительное введение вазоконстрикторов
- •Волемическое состояние, объем циркулирующей крови
- •Спинальная анестезия
- •Препараты для локальной анестезии Препараты из группы аминоэфиров Кокаин
- •Прокаин (новокаин)
- •Хлоропрокаин
- •Тетракаин
- •Препараты из группы аминоамидов Лидокаин
- •Мепивакаин
- •Прилокаин
- •Бупивакаин
- •Этидокаин
- •Другие препараты Дибукаин
- •Бензокаин
- •Заключение
- •Список литературы
- •Внутривенная аналгезия, контролируемая пациентом Определение методов акп и параметры дозировок
- •Инфузионная технология акп
- •Характеристика прибора
- •Факторы, относящиеся к оценке акп-инфузоров
- •Безопасность
- •Неблагоприятные реакции и побочное действие
- •Проблемы, связанные с работой приборов (механические проблемы)
- •Взаимодействие прибора и пользователя
- •Образец (парадигма) акп
- •Непрерывная инфузионная аналгезия для преодоления острой боли
- •Индивидуализация требований аналгезии
- •Вопросы фармакокинетики
- •Факторы фармакодинамики
- •Психологические факторы
- •Подкожная аналгезия, контролируемая пациентом
- •Эпидуральная аналгезия, контролируемая пациентом
- •Заключение
- •Список литературы
- •Клиническое использование эпидурального введения опиоидов Механизм действия
- •Значение растворимости в липидах
- •Опиоиды; обычно используемые для эпидурального введения
- •Клиническая характеристика эпидуральных опиоидов (после однократной инъекции)
- •Наступление аналгезии
- •Продолжительность аналгезии
- •Ростральная миграция в цсж
- •Место инъекции
- •Интермитткрующие инъекции или продолжительные инфузии?
- •Опиоиды, обычно используемые для эпидуральных инфузий 1
- •Клиническая практика госпиталя Brigham и женского госпиталя
- •Показания к применению
- •Субарахноидальное введение опиоидов в клинике
- •Побочное действие спинальных опиоидов
- •Угнетение дыхания
- •Тошнота
- •Задержка мочи
- •Активация латентной герпетической инфекции
- •Угнетение функции желудочно-кишечного тракта
- •Неврологические эффекты
- •Мониторинг
- •Заключение
- •Список литературы
- •Балансированная аналгезия
- •Эпидуральное введение локальных анестетиков
- •Влияние эпидуральной блокады на сердечно-сосудистую систему
- •Интермиттирующие инъекции
- •Продолжительные инфузии
- •Тахифилаксия
- •Общие сведения
- •Механизм тахифилаксии
- •Гипотетические механизмы тахифилаксии при эпидуральном введении локальных анестетиков
- •Клинические особенности эпидуральной анестезии при комбинации локальных анестетиков и опиоидов Синергизм аналгезии
- •Клинические особенности совместного назначения локальных анестетиков и опиоидов
- •Угнетение тахифилаксии
- •Угнетение центральной гиперсенсибилизации: концепция преимущественной аналгезии
- •Угнетение ноцицептивной трансмиссии: афферентный «барраж»
- •Продолжительность действия
- •Клинические исследования
- •Совместное эпидуральное применение локальных анестетиков и опиоидов
- •Эпидуральные инфузии локальных анестетиков и опиоидов: клиническая практика госпиталя -brigham и женского госпиталя
- •Комбинации локальных анестетиков и опиоидов для эпидуральной инфузии
- •Приготовление некоторых растворов для эпидурального введения
- •Выявление нарушений
- •Обычные проблемы, возникающие при проведении эпидуральной аналгезии
- •Осложнения и побочное действие
- •Заключение
- •Список литературы
- •Анатомия
- •Механизм действия
- •Методика Паховый параваскулярный метод
- •Противопоказания
- •Применение в клинике
- •Заключение
- •Список литературы
- •Анатомия
- •Симпатическая иннервация верхней конечности
- •Методика
- •Процедура Подмышечный подход
- •Межскаленный подход
- •Подключичный периваскулярный доступ
- •Подключичный (инфраклавикулярный) доступ
- •Выбор локального анестетика и его дозировка
- •Применение в клинике
- •Осложнения
- •Токсическое действие локальных анестетиков
- •Повреждение нерва
- •Заключение
- •Список литературы
- •Анатомия
- •Механизм действия
- •Методика Положение пациента и ориентиры
- •Выполнение процедуры
- •Возможные технические трудности
- •Варианты методики
- •Выбор локального анестетика и его дозировка
- •Интервалы между повторными введениями
- •Применение в клинике
- •Осложнения Недостаточная аналгезия
- •Пневмоторакс
- •Повреждение сосудов
- •Токсическое действие локального анестетика
- •Повреждение нерва
- •Заключение
- •Список литературы
- •Анатомия
- •Механизм аналгезии
- •Методика
- •Положение пациента и ориентиры
- •Выполнение процедуры
- •Выбор локального анестетика и его дозировка Концентрация бупивакаина
- •Объем вводимого раствора
- •Другие локальные анестетики
- •Адреналин
- •Интервалы между повторными введениями Интермиттирующие инъекции
- •Длительные внутриплевральные инфузий
- •Применение в клинике
- •Протокол по интермиттирующей дозировке препарата в случае установки внутриплеврального катетера
- •Применение в клинике внутриплевральной региональной аналгезии
- •Причины неэффективности внутриплевральной региональной аналгезии после операции торакотомии
- •Осложнения
- •Пневмоторакс
- •Токсическое действие локального анестетика
- •Противопоказания
- •Заключение
- •Список литературы
- •Анатомия
- •Механизм действия
- •Методика Положение пациента и ориентиры
- •Выполнение
- •Варианты методики
- •Выбор локального анестетика и интервалы между повторными введениями
- •Применение в клинике
- •Сообщения об аналгезии при использовании паравертебральной невральной блокады в грудном отделе
- •Осложнения
- •Список литературы
- •Анатомия
- •Методика
- •Мониторинг и подготовка
- •Положение пациента и ориентиры
- •Выполнение процедуры
- •Околосрединный подход
- •Подход по средней линии
- •Контроль проникновения в эпидуральное пространство
- •Потеря сопротивления
- •«Висящая капля»
- •Ощущение прокола желтой связки
- •Легкость введения катетера
- •Физиологические реакции
- •Выбор анальгетиков и их дозировка
- •Влияние эпидуральной аналгезии локальными анестетиками в грудном отделе на сердечно-сосудистую систему Снижение артериального давления
- •Ориентировочные дозы препаратов при торакальной эпидуральной аналгезии
- •Сегментарное распределение симпатической иннервации в грудопоясничном отделе
- •Потребность миокарда в кислороде
- •Применение в клинике
- •Осложнения Прокол твердой мозговой оболочки
- •Прокол вены
- •Парестезия
- •Задержка мочи
- •Тошнота
- •Седация
- •Гипотензия
- •Противопоказания Инфекция
- •Снижение сердечного резерва
- •Заключение
- •Список литературы
- •Система свертывания крови и ее физиологическая оценка
- •Эпидуральная гематома
- •Клинические признаки и патофизиология
- •Эпидуральная гематома после субарахноидальной пункции
- •Эпидуральная гематома после эпидуральной анестезии
- •Клинические сообщения, демонстрирующие безопасность региональной анестезии у больных, применявших антикоагулянты
- •Региональная анестезия/аналгезия у больного в состоянии антикоагуляции: ориентиры для критического решительного анализа
- •Спинальное введение опиоидов перед кардиопульмональным шунтированием
- •Предоперационная оценка
- •Подкожное введение гепарина («мини-дозы»)
- •Нестероидные противовоспалительные препараты
- •Ведение больного в операционном и послеоперационном периодах
- •Сроки сохранения факторов свертывания в плазме
- •Послеоперационный мониторинг
- •Заключение
- •Список литературы
- •Историческая справка
- •Механизм действия
- •Технические аспекты
- •Продолжительность импульса
- •Постоянный поток или постоянный вольтаж
- •Форма волн
- •Частотность
- •Амплитуда
- •Установка электродов и множественные каналы стимуляции
- •Электроды
- •Сроки стимуляции
- •Побочное действие
- •Противопоказания
- •Эффективность чэсн в послеоперационном периоде: обзор литературы Методологические аспекты
- •Абдоминальная хирургия
- •Предварительные клинические исследования по чэсн
- •Ортопедические операции
- •Акушерские операции
- •Операции на сердце и на органах грудной клетки
- •Состояние после ампутации
- •Ориентировочные показания по использованию чэсн в послеоперационном периоде
- •Пациенты, у которых ожидается улучшение от чэсн
- •Рекомендуемая установка электродов и параметры стимулирования при проведении чэсн
- •Заключение
- •Список литературы
- •Психосоциальный контекст послеоперационной боли
- •Анальгетические вмешательства нехимиотерапевтического характера
- •Обучение
- •Введение в транс
- •Погружение в транс
- •Гипнотическая работа
- •Завершение
- •Релаксационная реакция
- •Достижение релаксационной реакции
- •Заключение
- •Список литературы
- •Предоперационные факторы и подготовка
- •Оценка степени выраженности боли Боль у ребенка, не умеющего говорить
- •Оценка степени боли
- •Терапевтические возможности преодоления послеоперационной боли в педиатрии
- •Системные анальгетики Анальгетики неопиоидного типа
- •Послеоперационные режимы назначения морфина методом акп
- •Опиоиды
- •Режимы дозировок в педиатрии при региональной анестезии/аналгезии
- •Пути введения Энтеральная аналгезия
- •Внутримышечное введение
- •Интермиттирующее внутривенное введение опиоидов
- •Продолжительное внутривенное введение опиоидов
- •Аналгезия, контролируемая пациентом (акп)
- •Региональная анестезия/аналгезия
- •Каудальный блок
- •Эпидуральная аналгезия в поясничном и грудном отделах
- •Блокада подвздошно-пахового и подвздошно-подчревного нервов
- •Блокада дорсального нерва полового члена
- •Блокада бедренного и бокового кожного нервов бедра
- •Блокада отсека подвздошной фасции
- •Внутриплевральная региональная аналгезия
- •Инфильтрационная аналгезия операционной раны
- •Заключение
- •Список литературы
- •Послеродовое разрешение физиологической адаптации периода беременности
- •Физиологическая адаптация во время беременности
- •Анальгетические возможности Внутримышечное введение опиоидов
- •Внутривенное введение опиоидов
- •Эпидуральное введение опиоидов
- •Режимы дозировки эпидурально и суб-арахноидально вводимых опиоидов для аналгезии после кесарева сечения
- •Меперидин
- •Фентанил
- •Суфентанил
- •Буторфанол
- •Бупренорфин
- •Сочетанное применение препаратов
- •Субарахноидальное введение опиоидов
- •Фентанил
- •Суфентанил
- •Эпидуральное введение клофелина
- •Аналгезия опиоидами и грудное вскармливание
- •Выбор аналгезии после кесарева сечения
- •Список литературы
- •Аналгезия после некоторых ортопедических операций Артропластика и протезирование тазобедренного сустава
- •Влияние региональной анестезии на показатели смертности после операции артропластики тазобедренного сустава
- •Аналгезия, контролируемая пациентом (акп)
- •Субарахноидальное введение опиоидов
- •Эпидуральное введение опиоидов и локальных анестетиков
- •Субарахноидальное введение опиоидов при артропластике и протезировании коленного и тазобедренного суставов
- •Операции со вскрытием коленного сустава
- •Общее назначение опиоидов
- •Субарахноидальное введение опиоидов
- •Эпидуральное введение опиоидов
- •Эпидуральное введение локального анестетика
- •Комбинированная аналгезия
- •Невральная блокада поясничного сплетения
- •Клиническая практика госпиталя Brigham и женского госпиталя
- •Артроскопия коленного сустава Внутрисуставное введение бупивакаина
- •Внутрисуставное введение морфина
- •Артропластика плечевого сустава Аналгезия, контролируемая пациентом (акп)
- •Блокада плечевого сплетения
- •Эпидуральная анестезия/аналгезия в области шеи
- •Ампутация
- •Открытое вправление и внутренняя фиксация переломов лодыжки
- •Невральная блокада седалищного нерва в подколенной области
- •Заключение
- •Список литературы
- •Физиологические нарушения после операций на грудной полости
- •Причины нарушений функции дыхания после торакотомии
- •Методы аналгезии Парентеральное введение опиоидов
- •Межреберная невральная блокада
- •Внутриплевральная региональная аналгезия
- •Паравертебральная невральная блокада
- •Криоаналгезия
- •Чрескожная электростимуляция нерва
- •Субарахноидальное введение опиоидов
- •Эпидуралыюе введение локальных анестетиков и опиоидов Введение локальных анестетиков
- •Введение опиоидов
- •Установка эпидурального катетера в грудном или поясничном отделе
- •Комбинированное применение локальных анестетиков и опиоидов
- •Влияние на дыхание
- •Порядок ведения торакальной эпидуральной аналгезии после торакотомии
- •Порядок ведения торакальной эпидуральной аналгезии комбинацией локального анестетика и опиоида
- •Рекомендации по дозировке препаратов при торакальной эпидуральной аналгезии
- •Особые проблемы аналгезии после торакотомии
- •Заключение
- •Список литературы
- •Патофизиология послеоперационной абдоминальной боли
- •Кожная соматическая боль
- •Сенсибилизация ноцицепторов
- •Глубокая соматическая боль
- •Висцеральная боль Трансдукция
- •Трансмиссия
- •Иррадиирующая боль
- •Предполагаемые механизмы иррадиирующей боли
- •Последовательные рефлекторные реакции
- •Кортикальные реакции
- •Физиологические нарушения после операций на брюшной полости Нарушения функции легких
- •Осложнения со стороны желудочно-кишечного тракта
- •Тромбоэмболия
- •Аналгезия при некоторых вмешательствах на брюшной полости
- •Операции на верхнем отделе брюшной полости Нестероидные противовоспалительные препараты
- •Аналгезия, контролируемая пациентом
- •Межреберная невральная блокада
- •Внутриплевральная региональная аналгезия
- •Влияние внутриплевральной региональной аналгезии (впа) в сочетании с обычным введением опиоидов на обезболивание и на легочную функцию после операции холецистэктомии
- •Субарахноидальное введение опиоидов
- •Эпидуральное введение локальных анестетиков и опиоидов
- •Операции на нижнем отделе брюшной полости
- •Аппендэктомия
- •Операции на толстом кишечнике
- •Влияние эпидуральной анестезии/аналгезии на двигательную активность желудочно-кишечного тракта
- •Опорожнение желудка и подвижность тонкого кишечника
- •Моторика толстого кишечника
- •Заключение
- •Список литературы
- •Два мнения: аналгезия против диагностики
- •Физиологические нарушения, связанные с травмой
- •Возможности аналгезии Парентеральное назначение анальгетиков
- •Региональная анестезия/аналгезия
- •Подкожная инфильтрационная анестезия
- •Инфильтрационная анестезия
- •Фоновая блокада
- •Периферическая невральная блокада
- •Блокада сплетения
- •Внутриплевральная региональная аналгезия
- •Эпидуральная аналгезия
- •Субарахноидальная аналгезия
- •Травмы головы
- •Травмы грудной клетки
- •Повреждения скелета
- •Заключение
- •Список литературы
- •Коммуникация
- •Врачебный вклад
- •Концепция «глобального гонорара»
- •Администрация Департамент управления
- •Администрация госпиталей
- •Приобретение оборудования
- •Маркетинг
- •Заключение
- •Список литературы
- •Формирование эффективно работающих бригад по устранению боли: общий и женский госпиталь brigham
- •Группа задач, связанных с акп
- •Распределение препаратов
- •Участие медицинских сестер в переориентировке целей
- •Объекты проведения целевых усилии
- •Альтернативные методы контроля боли
- •Поза, позиционная установка
- •Сон, релаксация
- •Тошнота, рвота
- •Устранение боли дополнительное руководство по аналгезии, контролируемой пациентом
- •Общая информация:
- •Критерии акп Предлагаемые критерии акп совместно с лечением
- •Аналгезия, контролируемая пациентом
- •Общие указания Обучение пациента/родственников
- •Сестринский департамент госпиталя Протокол анестезии, контролируемой пациентом Реабилитационное отделение
- •Сестринский департамент госпиталя Соображения в случаях неадекватности аналгезии
- •Сестринский департамент госпиталя Инструкция по титрованию и введению «спасительной» дозы при акп-плюс
- •Сестринский департамент госпиталя Инструкция по титрованию и по введению «спасительной» дозы при акп-плюс
- •Список литературы
- •Персональный фактор
- •Анестезиолог
- •Сестринская помощь
- •Фармакологическая служба
- •Приготовление некоторых растворов для эпидурального введения
- •Оборудование
- •Основные требования, предъявляемые к эпиду-ральным инфузионным системам
- •Простота и легкость в обращении
- •Ограничитель скорости потока
- •Четкость в идентификации прибора (обозначение)
- •Вход для инъекций
- •Безопасность
- •Портативность
- •Мониторы
- •Процедуры, проводимые службой острой боли
- •Документация
- •Рабочий документ службы по борьбе с острой болью Служба лечения боли bwh отделение анестезиологии
- •Типичный лист стандартных назначений для пациента, получающего акп Общий и женский госпиталь Brigham Учебный филиал медицинского университета Гарварда
- •Проблемы, стоящие перед службой острой боли
- •Проблемы, стоящие перед соб
- •Список литературы
- •Молекулярная фармакология
- •Нейроэндокринная система
- •Сердечно-сосудистая система
- •Дыхательная система
- •Пищеварительная система
- •Центральная нервная система
- •Механизм аналгезии
- •Клинические исследования аналгезии Общее назначение
- •Эпидуральное назначение
- •Субарахноидальное введение
- •Заключение
- •Список литературы
- •Послеоперационная боль
- •101000, Москва, Петроверигский пер., 6/8
- •143200, Г. Можайск, ул. Мира, 93.
Нспвп и преодоление боли в послеоперационном периоде
Парентеральное применение опиоидов с целью послеоперационной аналгезии часто сопровождается неблагоприятными побочными реакциями со стороны сердечно-сосудистой, дыхательной и центральной нервной системы. Поэтому в настоящее время все большее внимание привлекают НСПВП как альтернативные опиоидам или дополнительные анальгетики. До появления кеторолак-трометамина использование НСПВП было ограничено отсутствием достаточно мощного препарата, вводимого парентерально. Большинство предшествующих исследований по парентеральному введению НСПВП с целью послеоперационной аналгезии были выполнены в Великобритании и опубликованы в Европе [34-42].
Ректальные свечи с индометацином оказались хорошим дополнительным анальгетиком после операций на брюшной полости. Их назначают одновременно с морфином и в более высоких дозах, чем рекомендовано при энтеральном приеме для подавления воспалительных реакций. Свечи можно назначать в послеоперационном периоде, не проводя предварительной проверки перед операцией. Однако на фоне применения свечей с индометацином чаще наблюдается кровоточивость в послеоперационном периоде [34, 35].
Некоторое время в Европе применяли лизин-ацетилсалицилат, вводимый парентерально. Правда, мнения о его эффективности при устранении тяжелых болей остались весьма противоречивыми [36-40].
Диклофенак, вводимый внутримышечно, единогласно был признан эффективным анальгетиком, особенно при назначении в сочетании с морфином [41, 42]. В отличие от индометацина этот препарат не усиливал кровоточивости (по крайней мере после операций простатэктомии) [43]. К сожалению, парентеральное введение диклофенака изучено недостаточно для того, чтобы рекомендовать его широкое применение.
Кеторолак-трометамин (торадол)
Кеторолак-трометамин - это один из препаратов группы пиролуксусной кислоты, обладающих противовоспалительным действием (рис. 7-2). Он недавно принят в США как анальгетик короткого действия, вводимый парентерально [44]. Кеторолак обладает многими положительными свойствами и выступает как средство, заменяющее или дополняющее опиоиды. Препарат пригоден для парентерального введения, вызывает выраженное и быстро наступающее достаточно продолжительное аналгезирующее действие. На месте его инъекции не возникает раздражения. Препарат не обладает недостатками опиоидов и НСПВП, к нему не наступает привыкания и зависимости [45-55].
Аналгезия наступает уже спустя 10 мин после введения кеторолака (так же как и после введения опиоидов). Минимальная концентрация препарата в плазме (Смакс). равная 2,2-3 мкг/мл, наступает спустя 40-60 мин (Тмакс) [56, 57]. Аналгезия длится примерно 6 ч [45-47]. Подобно остальным НСПВП, кеторолак в значительной степени связывается белками плазмы, подвергается метаболизму в печени с образованием неактивных метаболитов, выводимых с мочой [57]. Клиренс препарата заметно снижается у лиц пожилого возраста (65 лет и старше), а также у больных с патологией печени [58, 59].
Кеторолак по своему аналгезирующему действию вполне сопоставим с опиоидами (2 мг внутримышечно введенного кеторолака эквивалентны 1 мг морфина; 1 мг кеторолака эквивалентен 3-5 мг меперидина) [45-49, 60]. Время полувыведения кеторолака составляет 5-6 ч, поэтому повторные введения необходимы каждые 6 ч для поддержания стабильного его уровня в плазме. Нагрузочная доза кеторолака равна 60 мг внутримышечно, затем каждые 6 ч инъецируют по 30 мг препарата. Лицам с массой тела менее 60 кг, старше 65 лет или с нарушениями функции почек лечение начинают с дозы 30 мг внутримышечно с последующим введением по 15 мг каждые 6 ч. Больным с циррозом печени корректировать дозировку не требуется [61]. Особенности фармакокинетики препарата у больных с другими поражениями печени не изучены.
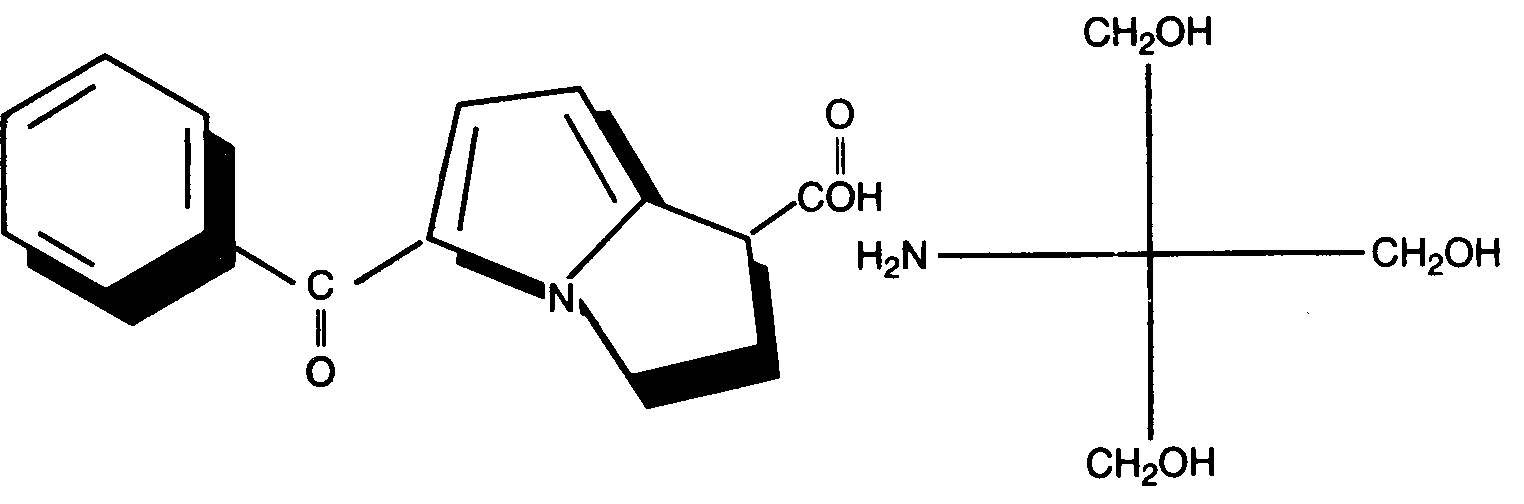
Рис. 7-2. Кеторолак-трометамин (торадол) является одним из нестероидных противовоспалительных препаратов группы уксусной кислоты. Он первый из НСПВП был предложен для парентерального введения в США.
При сильных болях после операций одного кеторолака может оказаться недостаточно для обеспечения адекватной аналгезии. В таких случаях его используют как дополнительное обезболивающее средство наряду с уменьшенными дозами опиоидов.
Кеторолак в отличие от опиоидов не угнетает функцию дыхания, не снижает моторику желудочно-кишечного тракта, не вызывает психомоторных эффектов и привыкания [48-50, 55]. Однако при его назначении возможны такие же нарушения со стороны желудочно-кишечного тракта, гемокоагуляции и функции почек, как и при других НСПВП.
Влияние на желудочно-кишечный тракт
Пероральный прием кеторолака в дозах до 120 г/сут сопровождался развитием кровоточащей язвы желудка у 0,3% из 6400 больных [44]. В большинстве случаев кровотечения развивались в период от 38-го до 248-го дня после начала лечения этим препаратом. При кратковременном приеме препарата с целью послеоперационной аналгезии частота кровотечений должна быть гораздо меньшей.
Нарушения гемокоагуляции
Кеторолак увеличивает время кровотечения, однако у пациентов с нормальной коагулограммой эти сдвиги бывают незначительными [51]. Кеторолак, подобно другим НСПВП, вытесняет остальные препараты, связывающиеся с белками плазмы (коумадин). Несмотря на увеличение времени кровотечения, назначение кеторолака не сопровождается повышением кровоточивости в послеоперационном периоде [62].
Нефротоксичность
Кеторолак, по-видимому, обладает небольшим нефротоксическим действием, проявляющимся у больных с почечной недостаточностью. Поэтому данный препарат, как и другие НСПВП, следует применять с осторожностью у больных с активацией ренин-ангиотензиновой системы, и особенно велика роль простагландинов в поддержании почечного кровотока.
ЗАКЛЮЧЕНИЕ
Кеторолак в настоящее время рассматривается как новый мощный неопиоидный анальгетик, пригодный для преодоления послеоперационной боли. С его появлением можно надеяться на дальнейшие достижения в химии НСПВП и на создание средств, заменяющих или дополняющих опиоиды.
Список литературы
1. Lim RKS, Guzman F, Rodgers DW et al: Site of action of narcotic and non-narcotic analgesics determined by blocking bradykinin-evoked visceral pain. Arch Int Pharmacodyn Ther 152'22 1964
2. Vane JR: Inhibition of prostaglandin synthesis as a mechanism of action for the aspirin-like drugs. Nature New Biol 231:232, 1971
3. Moncada S, Vane JR: Arachidonic acid metabolites and the interactions between platelets and blood-vessel walls. N Engi J Med 300:1142, 1979
4. Trang LE: Prostaglandins and inflammation. Semin Arthritis Rheum 9: 153, 1980
5. Abramson SB, Weissmann G: The mechanisms of action of nonsteroidal anti-inflammatory drugs. Arthritis Rheum 32:1, 1989
6. Brooks PM, Dav RO: Nonsteroidal antiinflammatory drugs-differences and similarities. N Engi J Med 324:1716, 1991
7. Simon LS, Mills JA: Nonsteroidal antiinflammatory drugs (Frist of two parts). N Engi J Med 302:1179, 1980
8. Simon LS, Mills JA: Nonsteroidal antiinflammatory drugs (Second of two parts). N Engi J Med 302:1237, 1980
9. Rooks WH II, Maloney PJ, Shott LD et al: The analgesic and anti-inflammatory profile of ketorolac and its tromethamine salt. Drugs Exp Clin Res 11:479, 1985
10. Rooks WH II. Tomolonis AJ, Maloney PJ et al: The analgesic and anti-inflammatory profile of (±)-5-benzoyl-l,2-dihydro-3H pyrrolo [1,2a] pyrrole-1-carboxylic acid (RS-37619). Agents Actions 12:684, 1982
11. Champion GD: Therapeutic usage of non-steroidal anti-inflammatory drugs. Med J Aust 149:203, 1988
12. Kilander A, Dotevall G: Endoscopic evaluation of the comparative effects of acetylsalicylic acid and choline magnesium trisalicylate on human gastric and duodenal mucosa. Br J Rheumatol 22:36, 1983
13. Cohen A. Garher HE: Comparison of choline magnesium trisalicylate and acetylsalicylic acid in relation to fecal blood loss. Curr Ther Res 28: 187, 1978
14. Huskisson EC: Antiinflammatory drugs. Semin Arthritis Rheum 7:1, 1977
15. Abramson S, Korchak H. Ludewiq R et al: Modes of action of aspirin-like drugs. Proc Nat] Acad Sci USA 82:7227, 1985
16. Clive DM, Stoff JS: Renal syndromes associated with nonsteroidal antiinflammatory drugs. N Engi J Med. 310:563, 1984
17. Patrono С, Dunn MJ: The clinical significance of inhibition of renal prostaglandin synthesis. Kidney Int 32:1, 1987
18. O'Brien WM, Bauby GF: Rare adverse reactions to nonsteroidal antiinflammatory drugs. (1). J Rheumatol 12:'13, 1985
19. O'Brien WM, Bagby GF: Rare adverse reactions to nonsteroidal antiinflammatory drugs. (2). J Rheumatol 12:347, 1985
20. O'Brien WM. Bagby GF: Rare adverse reactions to nonsteroidal antiinflammatory drugs. (3). J Rheumatol 12:562, 1985
21. O'Brien WM, Bagby GF: Rare adverse reactions to nonsteroidal antiinflammatory drugs. (4). J Rheumatol 12:785, 1985
22. Semble EL, Wu WC: Antiinflammatory drugs and gastric mucosal damage, Sem Arthritis Rheum 16:271, 1987
23. Roth SH. Bennett RE: Non-steroidal anti-inflammatory drug gastropathy: recognition and response. Arch Intern Med 147:2093, 1987
24. Hawkev CJ: Non-steroidal anti-inflammatory drugs and peptic ulcers. Br Med J 300:278, 1990
25. Soil АН: Pathogenesis of peptic ulcer and implications for therapy. N Engi J Med 322:909, 1990
26. Longman MJS: Treating ulcers in patients receiving anti-arthritic drugs (editorial). Q J Med 73:1089, 1989
27. Walan A, Bader JP. Classen M et a!: Effect of omeprazole and ranitidine on ulcer healing and relapse rates in patients with benign gastric ulcer. N Engi J Med 320:69, 1989
28. Roth S, Agrawal N, Malwwald M et ul: Misoprostol heals gastroduodenal injury in patients with rheumatoid arthritis receiving aspirin. Arch Intern Med 149:775, 1989
29. Graham DY, Agrawal N, Roth SH: Prevention of NSAID-induced gastric ulcer with misoprostol:
multicentre, double-blind, placebo-controlled trial. Lancet ii: 1277, 1988
30. Agrawal NM, Roth S, Graham DY et al: Misoprostol compared with sucralfate in the prevention of nonsteroidal anti-inflammatory drug-induced gastric ulcer. A randomized, controlled trial. Ann Intern Med 115:195, 1991
31. Carson JL, Strom BL, Soper К A et ah The association of nonsteroidal anti-inflammatory drugs with upper gastrointestinal tract bleeding. Arch Intern Med 147:85, 1987
32. Burch JW, Stanford N, Majerus PW: Inhibition of platelet prostaglandin synthetase by oral aspirin. J Clin Invest 61:3i4, 1978
33. All M, McDonald JWD: Reversible and irreversible inhibition of platelet cyclooxygenase and serotinin release by nonsteroidal antiinflammatory drugs. Thromb Res 13:1057, 1978
34. Reasbeck PG, Rice ML. Reasbeek JC: Double-blind controlled trial of indomethacin as an adjunct to narcotic analgesia after major abdominal surgery. Lancet ii: 115, 1982
35. Engel С, Lund В, Kirstensen SS et ah Indomethacin as an analgesic after hysterectomy. Acta Anaesthesiol Scand 33:498. 1989
36. Doutre M, Perissat M, Uiriogoyen M el ah Utilisation de FE.B.49G (acetyl salicylate dc lysine) par voie intraveineuse et intramusculaire en analgesie post-operatoire. Bord Med 12:3081, 1970
37. Nicolas F, Jeanniard Du Dot X: Utilisation des proprietes analgcsiques de Facetylsalicylate de lysine dans la periode post-operatoire. L'Ouest Med 25:1191, 1972
38. Kweekel-de Vries WJ. Spierdijk J, Mattk' H, Hermans JMH: A new soluble acelylsalicylic acid derivantive in the treatment of postoperative pain. Br J Anaesth 46: 133, 1974
39. MeAteer E, Dundee JW: Injcctable aspirin as a postoperative analgesic. Br J Anaesth 53: 1069, 1981
40. Cashman JN, Jones RM, Foster JMG, Adams AP\ Comparison of infusions of morphine and lysine acetyl salicylate for the relief of pain after surgery. Br J Anaesth 57:255, 1985
41. Hodsman NBA, Bums J, Bl\'th A et ah The morphine sparing effects of diclofenac sodium following abdominal surgery. Anaesthesia 42: 1005, 1987
42. Moffat AC, Kenny GNC. Prentice JW: Postoperative ncofam and diclofenac. Evaluation of their morphine-sparing effect after upper abdominal surgery. Anaesthesia 45:302, 1990
43. Brieker SRW, Savage ME. Hanning CD. Peri-operative blood loss and non-stcroidal anti-inflammatory drugs: an investigation using diclofenac in patients undergoing transurethral resection of the prostate. Eur J Anaesthesiol 4:429, 1987
44. Kennv GNC: Kctorolac trometamol - A new non-opioid analgesic (editorial). Br J Anaesth 65:445, 1990
45. Yee JP, Koshiver J E, Allhon C, Brown С R: Comparison of intramuscular kctorolac tromethaminc and morphine sulfate for analgesia of pain after major surgery. Pharmacotherapy 6:253, 1986
46. Gillies GWA, Kennv GNC', Bullingham RES, MeArdle CS: The morphine sparing effect of ketorolac tromcthamine: a study of a new, parenteral non-stcroidal antiinflammatory agent after abdominal surgery. Anaesthesia 42:727, 1987
47. O'Hara DA, Fragcn RJ, Kinzcr M, Pcmbcrton D: Ketorolac tromethamine as compared with morphine sulfate for treatment of postoperative pain. Clin Pharmacol Ther 41:556, 1987
48. Bravo LJC. Mattie H, Spierdijk J el ah The effects on ventilation of kctorolac in comparison with morphine. Eur J Clin Pharmacol 35:491, 1988
49. Ruhin P, Yee JP, Murthv VS. Seavey W'. Ketorolac tromethamine (KT) analgesia: no postoperative respiratory depression and less constipation. Clin Pharmacol Thcr 41 : 182, 1987
50. MaeDonald FC, Gough KJ. Nicoll RA(], Dow RJ: Psychomotor effects of ketorolac in comparison with buprenorphine and diclofenac. Br J Clin Pharmacol 27:453, 1989
51. Spowart К, Greer ТА. MeLaren M et ah Haemostatic effects of ketorolac with and without concomitant heparin in normal volunteers. Thromb Haemost 60:382, 1988
52. Conrad К A, Fagan TC, Maekie MJ, Mayshar PV: Effects of ketorlac tromethamine on hemostasis in volunteers. Clin Pharmacol Ther 43:542, 1988
53. Lanza FL, Karlin DA, Yee J P: A double-blind placebo controlled endoscopic study comparing the mucosal injury seen with an orally and parenterally administered new nonsteroidal analgesic ketorolac tromethaminc at therapeutic and subtherapeutic doses, abstracted. Am J Gastroenterol 82:939, 1987
54. Orme ML: Non steroidal anti-inflammatory drugs and the kidney (editorial). Br Med J 292: 1621, 1986
55. Lopez M, Waterhury LD, Miehel A et ah Lack of addictive potential of ketorolac tromethamine. Pharmacologist 29:136, 1987
56. Jung D, Mroszezak EJ, Bynum L: Pharmacokinetics of ketorolac tromethamine in humans after intravenous, intramuscular and oral administration. Eur J Clin Pharmacol 35:423, 1988
57. Jung D, Mroszezak EJ, Wu A et al: Pharmacokinetics of ketorolac and /7-hydroxyketorolac following oral and intramuscular administration of ketorolac tromethamine. Pharm Res 6:62, 1989
58. Montova-lraheta С, Gary DC, Jallad NS et al: Pharmacokinetics of single dose oral and intramuscular kctorolac tromethamine in elderly vs young healthy subjects, abstracted. J Clin Pharmacol 26:545, 1986
59. Martinez JJ, Garg DC. Pages LJ et al: Single dose pharmacokinetics of ketorolac in healthy young and renal impaired subjects, abstracted. J Clin Pharmacol 27:722, 1987
60. Yee J, Bradley R, Stanski E et al: A comparison of analgesic efficacy of intramuscular ketorolac tromethamine and meperidine in postoperative pain, abstracted. Clin Pharmacol Ther 39:237, 1986
61. Pages LJ. Martinez JJ, Garg DC et al: Pharmacokinetics of kctorolac tromethamine in hepa-tically impaired vs young healthy subjects, abstracted. J Clin Pharmacol 27:724, 1987
62. Power I, Noble DW, Douglas N, Spenee A A: Comparison of IM kclorolac trometamol and morphine sulfate for pain relief after cholecystectomy. Br J Anaeslh 65:448, 1990
8
