
- •Москва медицина 1998 Издание рекомендовано для перевода академиком рамн
- •Майкл Ферранте
- •Значимость проблемы послеоперационной боли
- •Распространенность проблемы по данным исследований
- •Распространенность проблемы по хирургическим данным
- •Боль, обусловленная хирургическим вмешательством (в порядке снижения интенсивности)1 Операции на желудке
- •Сопоставление разных методов аналгезии (международное исследование)
- •Региональная анестезия/аналгезия и легочные осложнения
- •Региональная анестезия/аналгезия и заболевания в послеоперационном периоде
- •Аналгезия, контролируемая пациентом
- •Премедикация и техника анестезии
- •Факторы, обусловливающие неадекватный контроль послеоперационной боли
- •Недостаток рутинной количественной оценки
- •Побочное действие анальгетиков
- •Индивидуальные различия реакции на анальгетики
- •Направления и пути решения
- •Периферическая нервная система Основы анатомии
- •Микроскопическое строение
- •Трансдукция Характеристика ноцицепторов
- •Категории ноцицепторов
- •Миелинизированные ноцицепторы
- •Немиелинизированные ноцицепторы
- •Роль ноцицепторов в перцепции боли
- •Сенсибилизация и гиперсенсибилизация
- •Биохимические субстраты
- •Трансдукция в глубоких соматических тканях
- •Суставы
- •Трансдукция в висцеральных органах
- •Резюме по вопросам трансдукции
- •Центральная нервная система
- •Ультраструктура спинного мозга
- •Ультраструктура головного мозга
- •Главные структуры ствола мозга
- •Таламус
- •Трансмиссия Первичные афферентные волокна в заднем корешке
- •Первичные афферентные волокна в спинном мозге
- •Терминалы первичных афферентов
- •Нейротрансмиттеры первичных аффекторов
- •Трансмиссионные клетки в спинном мозге Анатомия
- •Центральная гиперсенсибилизация, или нервное перевозбуждение
- •Восходящие ноцицептивные проводящие пути
- •Спиноталамический путь (стп)
- •Вентральный спиноталамический путь
- •Спинно-ретикулярный путь (срп)
- •Спинно-мезэнцефалический путь (смп)
- •Дорсальный столб постсинаптической спинно-медуллярной системы
- •Проприоспинальная мультисинаптическая восходящая система
- •Ростральные центры Ретикулярная формация
- •Таламус
- •Гипоталамус и лимбическая система
- •Кора мозга
- •Резюме по вопросам трансмиссии
- •Модуляция
- •Аналгезия, возникающая при стимуляции
- •Аналгезия, обеспечиваемая опиоидами
- •Анатомия нисходящей модулирующей системы Средний мозг
- •Продолговатый мозг
- •Кора и промежуточный мозг
- •Нейротрансмиттеры нисходящих проводящих путей Норадреналин
- •Серотонин
- •Эндогенные опиоиды
- •Резюме по вопросам модуляции
- •Пути контроля теории боли
- •Периферический отдел автономной нервной системы
- •Ганглии и сплетения периферического отдела автономной нервной системы
- •Эндокринные
- •Обменные
- •Обмен липидов
- •Стрессовые гормоны - это еще не результаты (некоторые предостережения)
- •Заключение
- •Структуры, расположенные в позвоночном канале Спинной мозг
- •Кровоснабжение позвоночного канала Артерии
- •Методы, вызывающие боль Турникетный болевой тест
- •Побочные действия
- •Гастропатия
- •Нспвп и преодоление боли в послеоперационном периоде
- •Опиоиды
- •Соотношение структуры и активности
- •Фармакодинамика Эндогенные опиоидныс пептиды
- •Опиоидные рецепторы
- •Классификация типов рецепторов и их предполагаемое действие
- •Связывание рецепторов и их реакция: истинная активность
- •Пути поступления препаратов
- •Проникновение к рецепторам
- •Фармакология Действие на центральную нервную систему
- •Гипнотическое действие опиоидов (в порядке снижения активности)
- •Метадон
- •Меперидин
- •Алкалоиды Морфин
- •Синтетические опиоиды Леворфанол (лево-дроморан)
- •Метадон (дольфин)
- •Смешанные агонист-антагонисты Налбуфин (нубаин)
- •Частичные агонисты Бупренорфин (бупренекс)
- •Пероральные антагонисты Налтрексон
- •Заключение
- •Список литературы
- •Соотношение рКд к процентному содержанию основных форм и время развития 50% проводникового блока в изолированном нерве
- •Факторы, влияющие на анестезиологическую активность
- •Дозировка
- •Добавки
- •Беременность
- •Фармакокинетика
- •Абсорбция
- •Распределение
- •Метаболизм и выведение
- •Токсичность
- •Общая токсичность
- •Токсичность для центральной нервной системы
- •Токсичность для сердечно-сосудистой системы
- •Различные системные эффекты
- •Аллергические реакции
- •Местное токсическое воздействие
- •Осложнения региональной анестезии
- •Эпидуральная анестезия
- •Уровень блокады
- •Доза препарата
- •Особенности локального анестетика
- •Дополнительное введение вазоконстрикторов
- •Волемическое состояние, объем циркулирующей крови
- •Спинальная анестезия
- •Препараты для локальной анестезии Препараты из группы аминоэфиров Кокаин
- •Прокаин (новокаин)
- •Хлоропрокаин
- •Тетракаин
- •Препараты из группы аминоамидов Лидокаин
- •Мепивакаин
- •Прилокаин
- •Бупивакаин
- •Этидокаин
- •Другие препараты Дибукаин
- •Бензокаин
- •Заключение
- •Список литературы
- •Внутривенная аналгезия, контролируемая пациентом Определение методов акп и параметры дозировок
- •Инфузионная технология акп
- •Характеристика прибора
- •Факторы, относящиеся к оценке акп-инфузоров
- •Безопасность
- •Неблагоприятные реакции и побочное действие
- •Проблемы, связанные с работой приборов (механические проблемы)
- •Взаимодействие прибора и пользователя
- •Образец (парадигма) акп
- •Непрерывная инфузионная аналгезия для преодоления острой боли
- •Индивидуализация требований аналгезии
- •Вопросы фармакокинетики
- •Факторы фармакодинамики
- •Психологические факторы
- •Подкожная аналгезия, контролируемая пациентом
- •Эпидуральная аналгезия, контролируемая пациентом
- •Заключение
- •Список литературы
- •Клиническое использование эпидурального введения опиоидов Механизм действия
- •Значение растворимости в липидах
- •Опиоиды; обычно используемые для эпидурального введения
- •Клиническая характеристика эпидуральных опиоидов (после однократной инъекции)
- •Наступление аналгезии
- •Продолжительность аналгезии
- •Ростральная миграция в цсж
- •Место инъекции
- •Интермитткрующие инъекции или продолжительные инфузии?
- •Опиоиды, обычно используемые для эпидуральных инфузий 1
- •Клиническая практика госпиталя Brigham и женского госпиталя
- •Показания к применению
- •Субарахноидальное введение опиоидов в клинике
- •Побочное действие спинальных опиоидов
- •Угнетение дыхания
- •Тошнота
- •Задержка мочи
- •Активация латентной герпетической инфекции
- •Угнетение функции желудочно-кишечного тракта
- •Неврологические эффекты
- •Мониторинг
- •Заключение
- •Список литературы
- •Балансированная аналгезия
- •Эпидуральное введение локальных анестетиков
- •Влияние эпидуральной блокады на сердечно-сосудистую систему
- •Интермиттирующие инъекции
- •Продолжительные инфузии
- •Тахифилаксия
- •Общие сведения
- •Механизм тахифилаксии
- •Гипотетические механизмы тахифилаксии при эпидуральном введении локальных анестетиков
- •Клинические особенности эпидуральной анестезии при комбинации локальных анестетиков и опиоидов Синергизм аналгезии
- •Клинические особенности совместного назначения локальных анестетиков и опиоидов
- •Угнетение тахифилаксии
- •Угнетение центральной гиперсенсибилизации: концепция преимущественной аналгезии
- •Угнетение ноцицептивной трансмиссии: афферентный «барраж»
- •Продолжительность действия
- •Клинические исследования
- •Совместное эпидуральное применение локальных анестетиков и опиоидов
- •Эпидуральные инфузии локальных анестетиков и опиоидов: клиническая практика госпиталя -brigham и женского госпиталя
- •Комбинации локальных анестетиков и опиоидов для эпидуральной инфузии
- •Приготовление некоторых растворов для эпидурального введения
- •Выявление нарушений
- •Обычные проблемы, возникающие при проведении эпидуральной аналгезии
- •Осложнения и побочное действие
- •Заключение
- •Список литературы
- •Анатомия
- •Механизм действия
- •Методика Паховый параваскулярный метод
- •Противопоказания
- •Применение в клинике
- •Заключение
- •Список литературы
- •Анатомия
- •Симпатическая иннервация верхней конечности
- •Методика
- •Процедура Подмышечный подход
- •Межскаленный подход
- •Подключичный периваскулярный доступ
- •Подключичный (инфраклавикулярный) доступ
- •Выбор локального анестетика и его дозировка
- •Применение в клинике
- •Осложнения
- •Токсическое действие локальных анестетиков
- •Повреждение нерва
- •Заключение
- •Список литературы
- •Анатомия
- •Механизм действия
- •Методика Положение пациента и ориентиры
- •Выполнение процедуры
- •Возможные технические трудности
- •Варианты методики
- •Выбор локального анестетика и его дозировка
- •Интервалы между повторными введениями
- •Применение в клинике
- •Осложнения Недостаточная аналгезия
- •Пневмоторакс
- •Повреждение сосудов
- •Токсическое действие локального анестетика
- •Повреждение нерва
- •Заключение
- •Список литературы
- •Анатомия
- •Механизм аналгезии
- •Методика
- •Положение пациента и ориентиры
- •Выполнение процедуры
- •Выбор локального анестетика и его дозировка Концентрация бупивакаина
- •Объем вводимого раствора
- •Другие локальные анестетики
- •Адреналин
- •Интервалы между повторными введениями Интермиттирующие инъекции
- •Длительные внутриплевральные инфузий
- •Применение в клинике
- •Протокол по интермиттирующей дозировке препарата в случае установки внутриплеврального катетера
- •Применение в клинике внутриплевральной региональной аналгезии
- •Причины неэффективности внутриплевральной региональной аналгезии после операции торакотомии
- •Осложнения
- •Пневмоторакс
- •Токсическое действие локального анестетика
- •Противопоказания
- •Заключение
- •Список литературы
- •Анатомия
- •Механизм действия
- •Методика Положение пациента и ориентиры
- •Выполнение
- •Варианты методики
- •Выбор локального анестетика и интервалы между повторными введениями
- •Применение в клинике
- •Сообщения об аналгезии при использовании паравертебральной невральной блокады в грудном отделе
- •Осложнения
- •Список литературы
- •Анатомия
- •Методика
- •Мониторинг и подготовка
- •Положение пациента и ориентиры
- •Выполнение процедуры
- •Околосрединный подход
- •Подход по средней линии
- •Контроль проникновения в эпидуральное пространство
- •Потеря сопротивления
- •«Висящая капля»
- •Ощущение прокола желтой связки
- •Легкость введения катетера
- •Физиологические реакции
- •Выбор анальгетиков и их дозировка
- •Влияние эпидуральной аналгезии локальными анестетиками в грудном отделе на сердечно-сосудистую систему Снижение артериального давления
- •Ориентировочные дозы препаратов при торакальной эпидуральной аналгезии
- •Сегментарное распределение симпатической иннервации в грудопоясничном отделе
- •Потребность миокарда в кислороде
- •Применение в клинике
- •Осложнения Прокол твердой мозговой оболочки
- •Прокол вены
- •Парестезия
- •Задержка мочи
- •Тошнота
- •Седация
- •Гипотензия
- •Противопоказания Инфекция
- •Снижение сердечного резерва
- •Заключение
- •Список литературы
- •Система свертывания крови и ее физиологическая оценка
- •Эпидуральная гематома
- •Клинические признаки и патофизиология
- •Эпидуральная гематома после субарахноидальной пункции
- •Эпидуральная гематома после эпидуральной анестезии
- •Клинические сообщения, демонстрирующие безопасность региональной анестезии у больных, применявших антикоагулянты
- •Региональная анестезия/аналгезия у больного в состоянии антикоагуляции: ориентиры для критического решительного анализа
- •Спинальное введение опиоидов перед кардиопульмональным шунтированием
- •Предоперационная оценка
- •Подкожное введение гепарина («мини-дозы»)
- •Нестероидные противовоспалительные препараты
- •Ведение больного в операционном и послеоперационном периодах
- •Сроки сохранения факторов свертывания в плазме
- •Послеоперационный мониторинг
- •Заключение
- •Список литературы
- •Историческая справка
- •Механизм действия
- •Технические аспекты
- •Продолжительность импульса
- •Постоянный поток или постоянный вольтаж
- •Форма волн
- •Частотность
- •Амплитуда
- •Установка электродов и множественные каналы стимуляции
- •Электроды
- •Сроки стимуляции
- •Побочное действие
- •Противопоказания
- •Эффективность чэсн в послеоперационном периоде: обзор литературы Методологические аспекты
- •Абдоминальная хирургия
- •Предварительные клинические исследования по чэсн
- •Ортопедические операции
- •Акушерские операции
- •Операции на сердце и на органах грудной клетки
- •Состояние после ампутации
- •Ориентировочные показания по использованию чэсн в послеоперационном периоде
- •Пациенты, у которых ожидается улучшение от чэсн
- •Рекомендуемая установка электродов и параметры стимулирования при проведении чэсн
- •Заключение
- •Список литературы
- •Психосоциальный контекст послеоперационной боли
- •Анальгетические вмешательства нехимиотерапевтического характера
- •Обучение
- •Введение в транс
- •Погружение в транс
- •Гипнотическая работа
- •Завершение
- •Релаксационная реакция
- •Достижение релаксационной реакции
- •Заключение
- •Список литературы
- •Предоперационные факторы и подготовка
- •Оценка степени выраженности боли Боль у ребенка, не умеющего говорить
- •Оценка степени боли
- •Терапевтические возможности преодоления послеоперационной боли в педиатрии
- •Системные анальгетики Анальгетики неопиоидного типа
- •Послеоперационные режимы назначения морфина методом акп
- •Опиоиды
- •Режимы дозировок в педиатрии при региональной анестезии/аналгезии
- •Пути введения Энтеральная аналгезия
- •Внутримышечное введение
- •Интермиттирующее внутривенное введение опиоидов
- •Продолжительное внутривенное введение опиоидов
- •Аналгезия, контролируемая пациентом (акп)
- •Региональная анестезия/аналгезия
- •Каудальный блок
- •Эпидуральная аналгезия в поясничном и грудном отделах
- •Блокада подвздошно-пахового и подвздошно-подчревного нервов
- •Блокада дорсального нерва полового члена
- •Блокада бедренного и бокового кожного нервов бедра
- •Блокада отсека подвздошной фасции
- •Внутриплевральная региональная аналгезия
- •Инфильтрационная аналгезия операционной раны
- •Заключение
- •Список литературы
- •Послеродовое разрешение физиологической адаптации периода беременности
- •Физиологическая адаптация во время беременности
- •Анальгетические возможности Внутримышечное введение опиоидов
- •Внутривенное введение опиоидов
- •Эпидуральное введение опиоидов
- •Режимы дозировки эпидурально и суб-арахноидально вводимых опиоидов для аналгезии после кесарева сечения
- •Меперидин
- •Фентанил
- •Суфентанил
- •Буторфанол
- •Бупренорфин
- •Сочетанное применение препаратов
- •Субарахноидальное введение опиоидов
- •Фентанил
- •Суфентанил
- •Эпидуральное введение клофелина
- •Аналгезия опиоидами и грудное вскармливание
- •Выбор аналгезии после кесарева сечения
- •Список литературы
- •Аналгезия после некоторых ортопедических операций Артропластика и протезирование тазобедренного сустава
- •Влияние региональной анестезии на показатели смертности после операции артропластики тазобедренного сустава
- •Аналгезия, контролируемая пациентом (акп)
- •Субарахноидальное введение опиоидов
- •Эпидуральное введение опиоидов и локальных анестетиков
- •Субарахноидальное введение опиоидов при артропластике и протезировании коленного и тазобедренного суставов
- •Операции со вскрытием коленного сустава
- •Общее назначение опиоидов
- •Субарахноидальное введение опиоидов
- •Эпидуральное введение опиоидов
- •Эпидуральное введение локального анестетика
- •Комбинированная аналгезия
- •Невральная блокада поясничного сплетения
- •Клиническая практика госпиталя Brigham и женского госпиталя
- •Артроскопия коленного сустава Внутрисуставное введение бупивакаина
- •Внутрисуставное введение морфина
- •Артропластика плечевого сустава Аналгезия, контролируемая пациентом (акп)
- •Блокада плечевого сплетения
- •Эпидуральная анестезия/аналгезия в области шеи
- •Ампутация
- •Открытое вправление и внутренняя фиксация переломов лодыжки
- •Невральная блокада седалищного нерва в подколенной области
- •Заключение
- •Список литературы
- •Физиологические нарушения после операций на грудной полости
- •Причины нарушений функции дыхания после торакотомии
- •Методы аналгезии Парентеральное введение опиоидов
- •Межреберная невральная блокада
- •Внутриплевральная региональная аналгезия
- •Паравертебральная невральная блокада
- •Криоаналгезия
- •Чрескожная электростимуляция нерва
- •Субарахноидальное введение опиоидов
- •Эпидуралыюе введение локальных анестетиков и опиоидов Введение локальных анестетиков
- •Введение опиоидов
- •Установка эпидурального катетера в грудном или поясничном отделе
- •Комбинированное применение локальных анестетиков и опиоидов
- •Влияние на дыхание
- •Порядок ведения торакальной эпидуральной аналгезии после торакотомии
- •Порядок ведения торакальной эпидуральной аналгезии комбинацией локального анестетика и опиоида
- •Рекомендации по дозировке препаратов при торакальной эпидуральной аналгезии
- •Особые проблемы аналгезии после торакотомии
- •Заключение
- •Список литературы
- •Патофизиология послеоперационной абдоминальной боли
- •Кожная соматическая боль
- •Сенсибилизация ноцицепторов
- •Глубокая соматическая боль
- •Висцеральная боль Трансдукция
- •Трансмиссия
- •Иррадиирующая боль
- •Предполагаемые механизмы иррадиирующей боли
- •Последовательные рефлекторные реакции
- •Кортикальные реакции
- •Физиологические нарушения после операций на брюшной полости Нарушения функции легких
- •Осложнения со стороны желудочно-кишечного тракта
- •Тромбоэмболия
- •Аналгезия при некоторых вмешательствах на брюшной полости
- •Операции на верхнем отделе брюшной полости Нестероидные противовоспалительные препараты
- •Аналгезия, контролируемая пациентом
- •Межреберная невральная блокада
- •Внутриплевральная региональная аналгезия
- •Влияние внутриплевральной региональной аналгезии (впа) в сочетании с обычным введением опиоидов на обезболивание и на легочную функцию после операции холецистэктомии
- •Субарахноидальное введение опиоидов
- •Эпидуральное введение локальных анестетиков и опиоидов
- •Операции на нижнем отделе брюшной полости
- •Аппендэктомия
- •Операции на толстом кишечнике
- •Влияние эпидуральной анестезии/аналгезии на двигательную активность желудочно-кишечного тракта
- •Опорожнение желудка и подвижность тонкого кишечника
- •Моторика толстого кишечника
- •Заключение
- •Список литературы
- •Два мнения: аналгезия против диагностики
- •Физиологические нарушения, связанные с травмой
- •Возможности аналгезии Парентеральное назначение анальгетиков
- •Региональная анестезия/аналгезия
- •Подкожная инфильтрационная анестезия
- •Инфильтрационная анестезия
- •Фоновая блокада
- •Периферическая невральная блокада
- •Блокада сплетения
- •Внутриплевральная региональная аналгезия
- •Эпидуральная аналгезия
- •Субарахноидальная аналгезия
- •Травмы головы
- •Травмы грудной клетки
- •Повреждения скелета
- •Заключение
- •Список литературы
- •Коммуникация
- •Врачебный вклад
- •Концепция «глобального гонорара»
- •Администрация Департамент управления
- •Администрация госпиталей
- •Приобретение оборудования
- •Маркетинг
- •Заключение
- •Список литературы
- •Формирование эффективно работающих бригад по устранению боли: общий и женский госпиталь brigham
- •Группа задач, связанных с акп
- •Распределение препаратов
- •Участие медицинских сестер в переориентировке целей
- •Объекты проведения целевых усилии
- •Альтернативные методы контроля боли
- •Поза, позиционная установка
- •Сон, релаксация
- •Тошнота, рвота
- •Устранение боли дополнительное руководство по аналгезии, контролируемой пациентом
- •Общая информация:
- •Критерии акп Предлагаемые критерии акп совместно с лечением
- •Аналгезия, контролируемая пациентом
- •Общие указания Обучение пациента/родственников
- •Сестринский департамент госпиталя Протокол анестезии, контролируемой пациентом Реабилитационное отделение
- •Сестринский департамент госпиталя Соображения в случаях неадекватности аналгезии
- •Сестринский департамент госпиталя Инструкция по титрованию и введению «спасительной» дозы при акп-плюс
- •Сестринский департамент госпиталя Инструкция по титрованию и по введению «спасительной» дозы при акп-плюс
- •Список литературы
- •Персональный фактор
- •Анестезиолог
- •Сестринская помощь
- •Фармакологическая служба
- •Приготовление некоторых растворов для эпидурального введения
- •Оборудование
- •Основные требования, предъявляемые к эпиду-ральным инфузионным системам
- •Простота и легкость в обращении
- •Ограничитель скорости потока
- •Четкость в идентификации прибора (обозначение)
- •Вход для инъекций
- •Безопасность
- •Портативность
- •Мониторы
- •Процедуры, проводимые службой острой боли
- •Документация
- •Рабочий документ службы по борьбе с острой болью Служба лечения боли bwh отделение анестезиологии
- •Типичный лист стандартных назначений для пациента, получающего акп Общий и женский госпиталь Brigham Учебный филиал медицинского университета Гарварда
- •Проблемы, стоящие перед службой острой боли
- •Проблемы, стоящие перед соб
- •Список литературы
- •Молекулярная фармакология
- •Нейроэндокринная система
- •Сердечно-сосудистая система
- •Дыхательная система
- •Пищеварительная система
- •Центральная нервная система
- •Механизм аналгезии
- •Клинические исследования аналгезии Общее назначение
- •Эпидуральное назначение
- •Субарахноидальное введение
- •Заключение
- •Список литературы
- •Послеоперационная боль
- •101000, Москва, Петроверигский пер., 6/8
- •143200, Г. Можайск, ул. Мира, 93.
Эндокринные
Усиление катаболизма
Вторично повышается: АКТГ, кортизол, гормон роста, вазопрессин, катехоламин, интерлейкин-1
Снижение анаболизма
Вторично снижается: синтез инсулина
Обменные
Углеводы:
Гипергликемия Непереносимость глюкозы
Инсулинорезистентность Усиление гликогенолиза Усиление глюконеогенеза Вторично снижается секреция инсулина и его внутреннее действие Вторично нарастает адреналин, глюкагон (усиление гликогенолиза) Вторично нарастает кортизол, глюкагон, гормон роста, адреналин, свободные жирные кислоты (усиленный глюконеогенез)
Белки:
повышение катаболизма повышенный синтез белков острой фазы Вторично нарастают: кортизол, адреналин, глюкагон, интерлейкин-1
Жиры:
усиленное окисление усиленный липолиз
Вторично нарастают: кортизол, глюкагон, гормон роста, катехоламины
МЕХАНИЗМЫ СТИМУЛЯЦИИ
Многие клинические наблюдения и результаты экспериментальных исследований указывают на первостепенную важность афферентных нейрогенных стимулов в классических стрессовых реакциях. Активация афферентных путей во время операции является первым и важным моментом в возникновении сердечно-сосудистых и гипоталамо-гипофизарных реакций [5, 6]. Уже локальное высвобождение из поврежденных тканей медиаторов (в том числе интерлейкин-1, простагландины, брадикинин, субстанция Р) стимулирует общую воспалительную реактивность [7]. Эти медиаторы непосредственно включаются в стрессовые реакции, так как, циркулируя в крови, они вызывают гормональные сдвиги в отдаленных «пусковых» органах (в том числе и в гипофизе). Эти медиаторы включаются в течение стрессовых реакций также и опосредованно, усиливая ноцицептивную афферентную трансмиссию, вызывая или потенцируя при этом высвобождение гипоталамических гормонов.
Таким образом, природа реакций, приводимых в действие хирургическим вмешательством, сложна. Она включает как гуморальные, так и воспалительные механизмы [8]. Пока еще невозможно выделить одну группу механизмов, которые бы в определенном соотношении были бы применимы к каждому из компонентов взаимосвязанного комплекса реакций [9, 10].
Нейрогенные механизмы
Ноцицептивные сигналы из места операции передаются в центральную нервную систему преимущественно по малым миелинизированным волокнам Аδ и по немиелинизированным волокнам С. Недавние исследования показали, что быстро проводящие волокна могут принимать участие также в гипоталамической активации начальных эндокринных реакций на операцию [11, 12].
Ноцицептивные волокна вступают в спинной мозг в составе задних корешков и разделяются на восходящие и нисходящие ветви, которые проходят в тракте Лиссауэра на протяжении ближайших одного или двух сегментов, где они образуют синапсы с клетками шести анатомически отличающихся друг от друга слоев заднего рога. Кожные ноцицептивные афференты проецируются на I, II и V пластины, в то время как висцеральные и мышечные Ноцицептивные афференты проецируются на пластины I и V, но не на пластину II [6, 12]. После перекрещивания болевые волокна восходят в переднебоковом квадранте спинного мозга в составе спиноталаического и спинно-ретикулярно-таламического проводящих путей. Спино-таламический путь на уровне таламуса разделяется на медиальную и латеральную части (рис. 4-1, 4-2). Латеральная ветвь заканчивается в вентро-базальном ядре, которое играет важную роль в трансмиссии боли [6], и в заднем комплексе ядер. (Анатомия ядер таламуса описана в гл. 2.) Латеральное и медиальное ответвления в последующем проецируются в соматосенсорную зону коры.
Спино-ретикулярно-таламическая система имеет важное значение в автономной, гуморальной и в аффективной реакции на боль [13] (рис. 4-3). Спино-ретикулярные волокна заканчиваются билатерально в продолговатом мозге, главным образом вблизи или в самом ретикулярном гигантоклеточном ядре. Дальнейшее их продолжение восходит в вентральном покрышечном проводящем пути и вступает в гипоталамус, где эти волокна соединяются со средним пучком переднего мозга. В его составе эти волокна достигают паравентрикулярного ядра гипоталамуса (ПВЯ), являющегося главным интегрирующим центром обоих типов (гуморальных и автономных) реакций [14].
Нейроны, содержащие вазопрессин (антидиуретический гормон-АДГ) и кортикотропин-рилизинг-гормон (КРГ), локализуются именно в ПВЯ [15, 16] (рис. 4-4). КРГ является главным гормоном гипоталамуса, стимулирующим секрецию передней долей гипофиза адренокортикотропного гормона (АКТГ) и β-эндорфина (см. гл. 8, эндогенные опиоиды).
Вазопрессин транспортируется из ПВЯ и накапливается в задней доле гипофиза, откуда он секретируется в кровь. Уровень вазопрессина в плазме рассматривают как показатель стресса. Продолжительное его повышение наблюдается после больших операций, в частности после операций на грудной клетке [17]. Вазопрессин задерживает свободную воду, отмечается также синергизм его действия с секрецией гипофизом АКТГ, КРГ и β-эндорфина [16, 18].
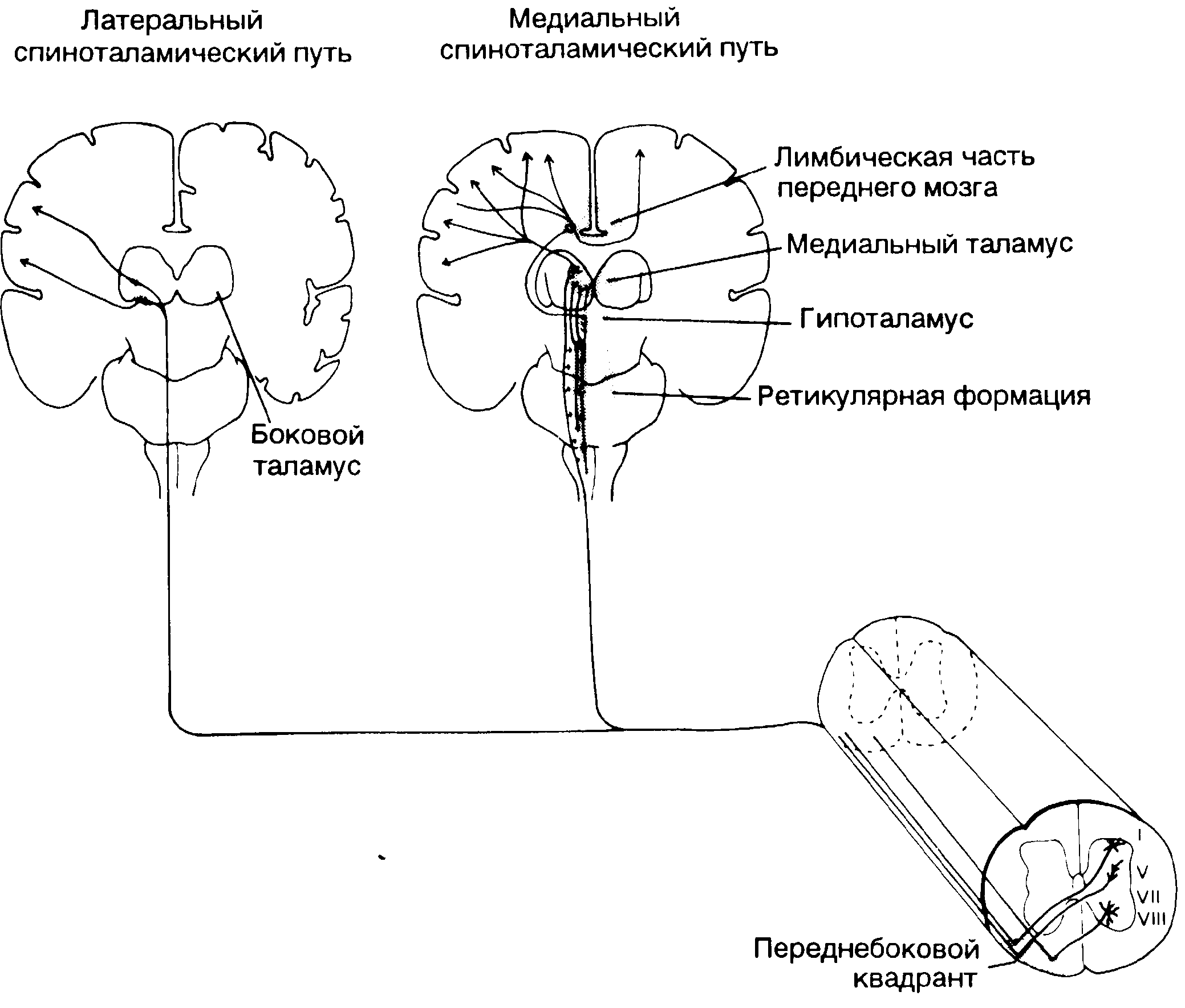
Рис. 4-1. Медиальный и латеральный спиноталамические проводящие пути.
Аксоны от тел клеток из пластин I, V, VII и VIII проецируются в основном в противоположный переднебоковой квадрант спинного мозга (на той же стороне остается небольшое число волокон). Восходящие волокна формируют спиноталамический и спинно-ретикулярно-таламический проводящие пути. Когда волокна гипоталамического пути достигают таламуса, они разделяются на медиальную и латеральную части. Медиальный спиноталамический путь проецируется в медиальный таламус, гипоталамус и в лимбическую часть переднего мозга. Волокна латерального спиноталамического пути образуют синапсы в вентробазальном и в заднем ядрах и дальше проецируются в кору мозга.
Прямая ноцицептивная проекция от спинного мозга к гипоталамусу, к перегородочным и прилежащим к ним ядрам в настоящее время идентифицируется как спиногипоталамический путь [19]. Клетки, обеспечивающие этот проводящий путь, происходят не только из боковой ретикулярной зоны спинного мозга (которая также входит в спиноталамический путь), но также из боковых спинальных ядер и из области, примыкающей к центральному каналу (не входит в состав спиноталамического пути) [20]. Следующим различием между спиногипоталамическим и спиноталамическим проводящими путями является степень биполярности их проекции. Более 40% первого проекцируется далее на той же стороне, в то время как в спиноталамическом пути таких волокон не более 10% [21]. Нейроны спиногипоталамического проводящего пути - это потенциально важный путь, с помощью которого сегментарные ноцицептивные стимулы могут дать толчок к развитию гипоталамо-гипофизарных реакций. Однако количественный вклад этого механизма в гормональную секрецию при стрессе пока не установлен.
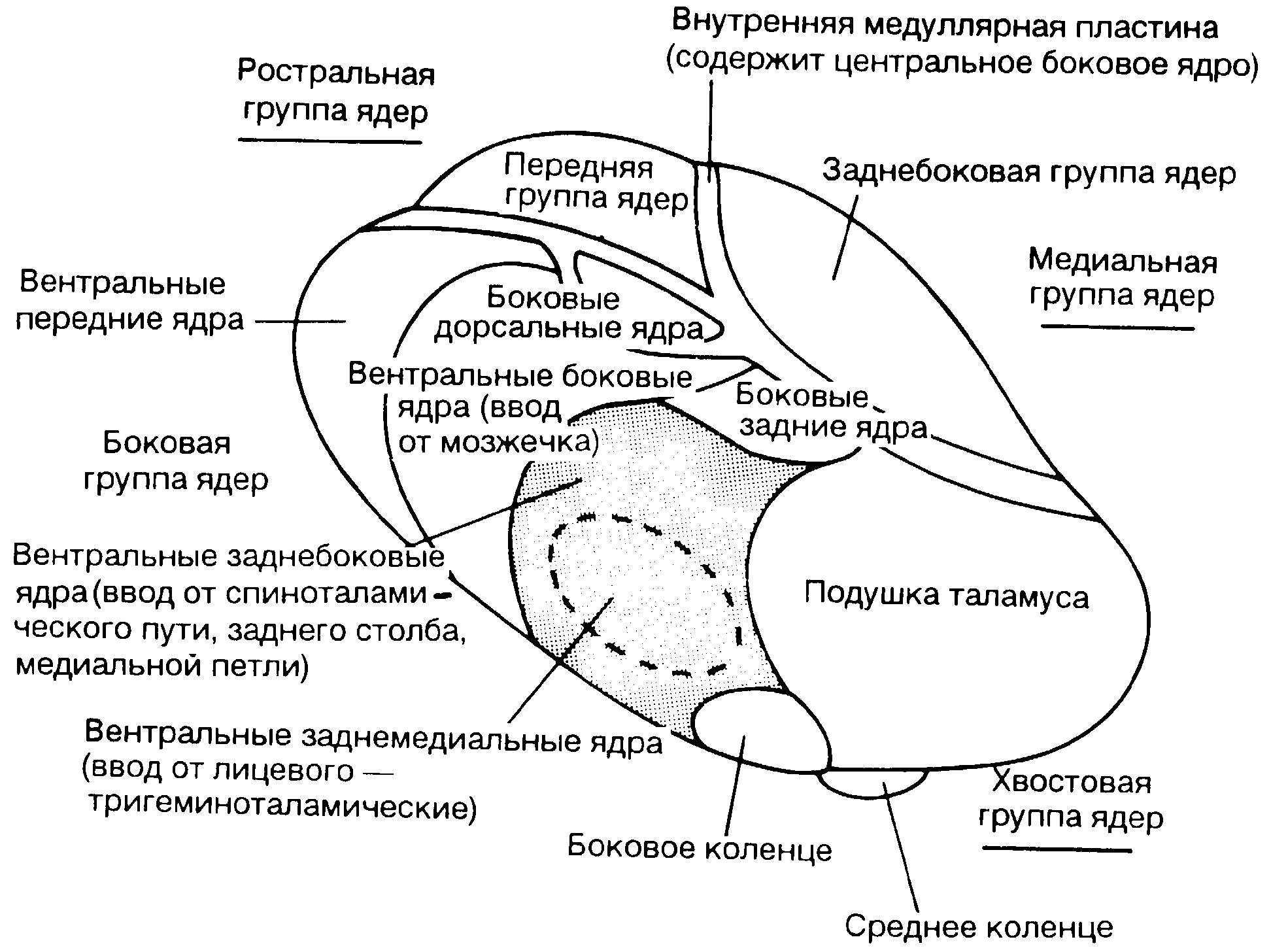
Рис. 4-2. Ядра таламуса (продольный вид).
Прямой ввод от спинного мозга получают следующие ядра таламуса: вентробазальный комплекс (вентрозаднебоковое и вентрозаднесрединное ядра), задний комплекс ядер (не показаны), центральное латеральное ядро (часть интраламинарного комплекса), субмедиальное ядра (не показано).
Корреляция между локализацией и тяжестью операции, с одной стороны, и степенью выраженности гормональных стрессовых реакций, с другой, может отражать степень участия невральных проводящих путей в происходящих сдвигах. Ряд исследований дал убедительные доказательства существования подобной клинической зависимости [22]. Биопсия поверхностных тканей, операции на глазах и на органе слуха вызывают скромные гормональные и метаболические реакции. Операции на грудной клетке, на костях, на глубоких тканях и органах брюшной полости сопровождаются значительно более сильными реакциями.
Медиаторы воспаления
Повреждение тканей приводит к высвобождению медиаторов воспаления, в том числе субстанции Р, цитокинов, эйкосаноидов и брадикинина, которые вызывают и поддерживают стрессовые реакции [23-25]. Невральные стимулы остаются ведущими в механизмах хирургических стрессовых реакций. Однако экспериментальные исследования по тканевым повреждениям на животных с прерванной связью мозг-гипофиз показали, что гипофизарно-надпочечниковые механизмы играют важную роль в качестве экстраневральных факторов развития стресса [7].
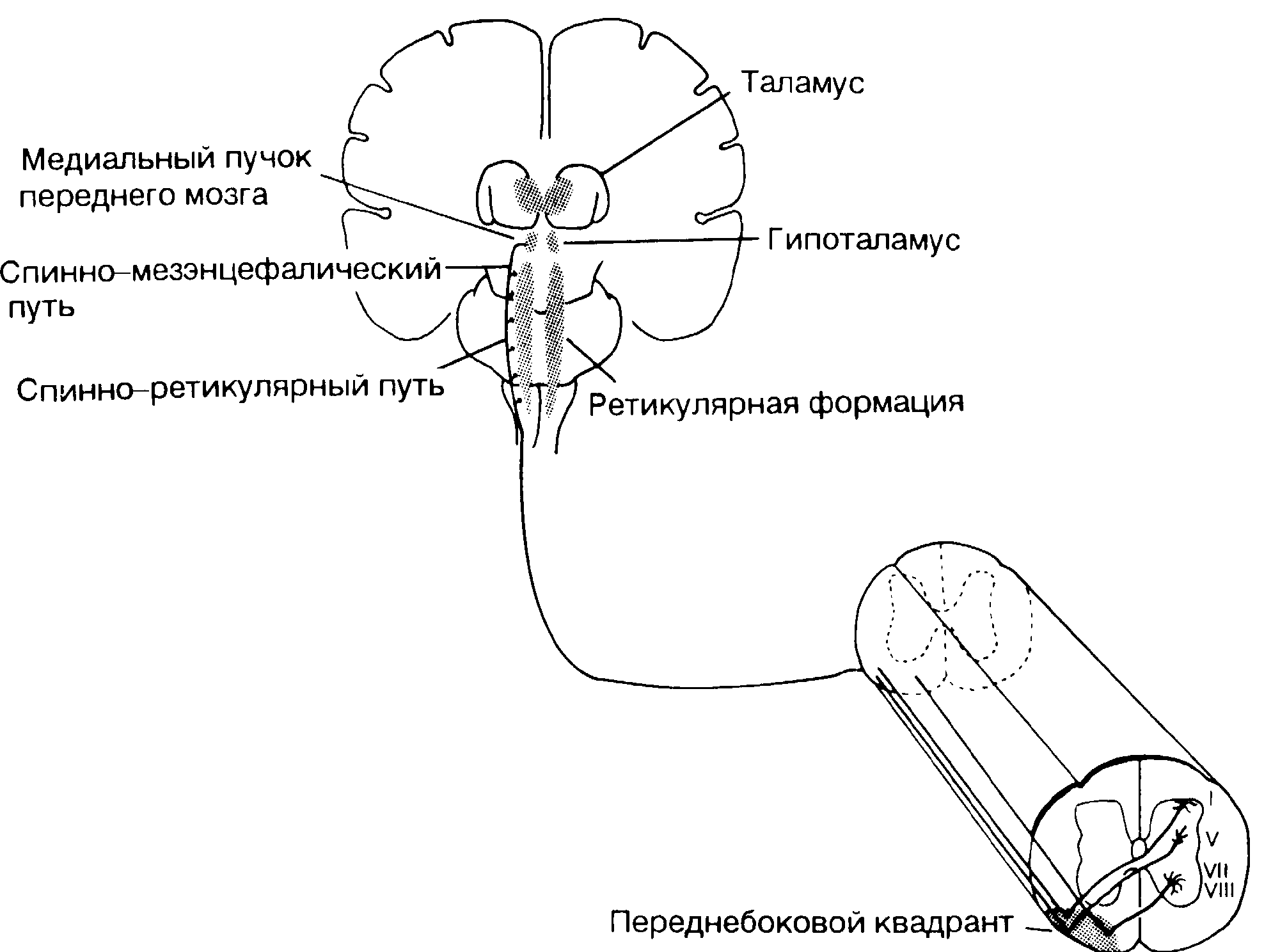
Рис. 4-3. Спинно-ретикулярно-таламический проводящий путь.
Спинно-ретикулярно-таламический путь включает спинно-ретикулярный путь (СРП), спинно-мезэнцефалический путь (СМП) и средний пучок переднего мозга (СПМ). Клетки, образующие СРП, расположены в пластинах Рекседа I и V-VIII, их аксоны восходят вместе со спиноталамическим путем. Аксоны СРП заканчиваются в ретикулярной формации ствола мозга, преимущественно в гигантоклеточном ядре или около него. Клетки, формирующие СМП, расположены преимущественно в пластинах Рекседа I и V. Их аксоны восходят в переднебоковом квадранте до гипоталамуса, где они сливаются с СПМ, образуя синапсы преимущественно в паравентрикулярном ядре гипоталамуса.
Субстанция Р [26] действует как нейротрансмиттер в ноцицептивной афференции на периферии даже в отсутствие спинного мозга. Кроме того, она обладает выраженным иммупомодулирующим действием, в том числе стимулирует высвобождение ингерлейкина-1 из лейкоцитов [27]. Субстанция Р способствует выделению гормона роста и пролактина передней долей гипофиза [28], а также моделирует экзо- и эндокринную функцию поджелудочной железы (в том числе ингибирует продукцию инсулина, индуцированную глюкозой). Разнообразие общего действия субстанции Р показывает, как медиатор, появившийся при локальном раздражении, способен усиливать и поддерживать общие стрессовые реакции.
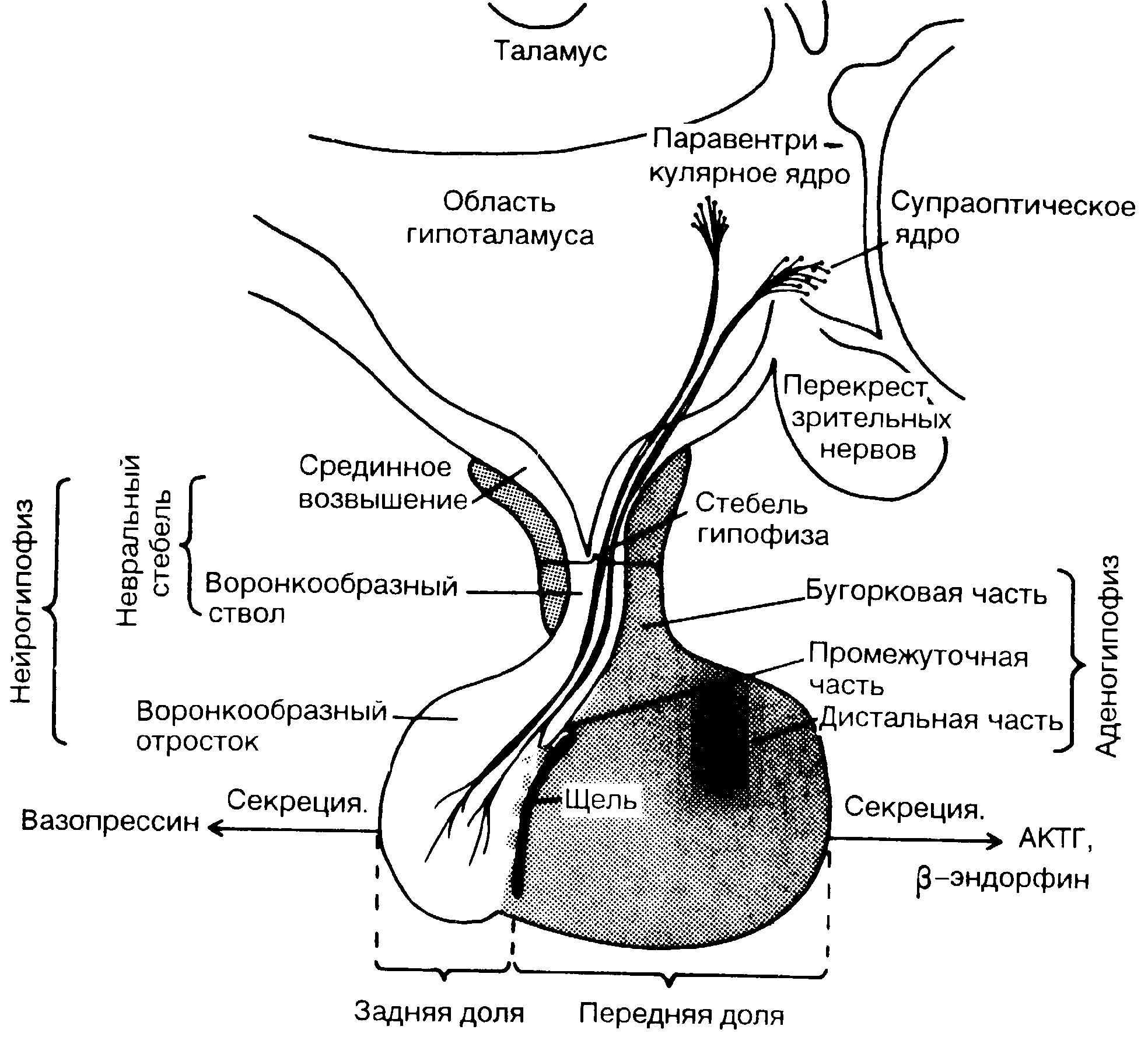
Рис. 4-4. Гипоталамус и гипофиз (иейрогипофиз и аденогипофиз).
Интерлейкин-1 - это протеин, продуцируемый макрофагами и клетками костномозгового происхождения (кроме эритроцитов). Два разных гена определяют появление двух разных форм интерлейкина-1 (ИЛ-1), именуемых а- и β- ИЛ-1. Каждая из них может быть гликозилирована по-разному. Первоначально ИЛ-1 обозначали как фактор активации лимфоцитов, или активатор β-клеток. Некоторые клеточные реакции или клинические симптомы послеоперационного периода, напоминающие действие ИЛ-1, выражаются лихорадкой, медленными волнами сна, анорексией, синтезом острофазных белков, высвобождением аминокислот из скелетных мышц, а также активацией Т- и В-лимфоцитов и естественных клеток-киллеров. ИЛ-1 это не только медиатор воспаления и иммуностимулятор, но он непосредственно усиливает секрецию АКТГ и β-эндорфина клетками передней доли гипофиза [29]. Это служит еще одним примером того, как под влиянием возникшего на периферии гуморального фактора усиливается (возможно, в результате синергизма) выраженность постхирургических стрессовых реакций, вызванных в силу ноцицептивной афферентной трансмиссии [23, 25, 30, 31].
Фактор некроза опухоли (ФНО) также является важным медиатором повреждающих реакций. ФНО-а (прежнее название кахектин) и ФНО-бета это близкие пептиды, секретируемые лимфоцитами и моноцитами/макрофагами разных линий. Оба эти ФНО обладают одинаковыми рецепторами. Экспериментальные исследования показали, что ФНО-а вызывает лихорадку, анорексию, усиливает синтез острофазных белков, высвобождает аминокислоты из скелетных мышц, повышает продукцию лактата, способствует гипергликемии, липолизу и снижает сосудистое сопротивление в опытах in vivo [30-33]. ФНО-а в настоящее время рассматривают как ключевой и пусковой фактор при многих проявлениях сепсиса, воспаления и множественной органной недостаточности [25].
Во время операции и после нее значительно повышается содержание в крови продуктов распада тромбоцитов. Было установлено, что увеличение уровня тромбоксана В2 и 5-гидрокситриптамина (серотонин) тесно связано с традиционными индексами хирургических стрессовых реакций. Пик концентрации тромбоксана В2 и серотонина наступает через 1-2 ч после разреза кожи. Повышение уровня продуктов дезинтеграции тромбоцитов в крови может наблюдаться также и в предоперационном периоде. Это следует интерпретировать как отражение адреномедуллярной активации, вызванной психологическим стрессом [34].
Далеко не всегда все из упомянутых выше медиаторов обнаруживаются в пораженных тканях. Существуют также и другие медиаторы, например брадикинин и эйкосанид (см. гл. 2). Медиаторы, образовавшиеся в поврежденных тканях, непосредственно участвуют в стрессовых реакциях, так как, циркулируя в крови, они воздействуют на отдаленные пусковые органы [35]. Медиаторы влияют на стрессовые реакции и опосредованно усиливают афферентную ноцицептивную трансмиссию, при этом вызывая и потенцируя гормональную секрецию гипоталамуса [36]. Еще Селье в своих первых работах по стрессовым реакциям (он их назвал «общим адаптационным синдромом») пророчески рассматривал возможности их инициации веществами, образующимися в поврежденной ткани.
СТРЕССОВЫЕ ГОРМОНЫ
Выделяют две главные системы гормональной секреции (оси), участвующие в нейроэндокринных реакциях на хирургический стресс. Это ось гипоталамус-гипофиз-надпочечники (ГТН) и симпато-адреномедуллярная система (рис. 4-5). Последняя накапливает и высвобождает катехоламины (норадреналин из периферических нервов и адреналин из мозгового вещества надпочечников). Адреномедуллярная система высвобождает также и опиоиды, в частности лей- и мет-энкефалины, производные проэнкефалина А (см. гл. 8) [37, 38]. Система ГГН вносит свой вклад продукцией трофических гормонов гипоталамусом (не только КРГ, см. ниже), стимуляцией гипофиза, выделяющего АКТГ, β-эндорфин, гормон роста и пролактин. Циркулирующий в крови АКТГ стимулирует надпочечники, которые в свою очередь усиливают секрецию кортизола и альдостерона.
После 40-летних исследований установлены основные принципы секреции АКТГ гипофизом [39], был выделен КРГ, оказавшийся пептидом, включавшим 41 аминокислоту (Vale и сотр., 1961) [40]. Нейроны ПВЯ гипоталамуса синтезируют КРГ и проецируют его в область средней возвышенности стебля гипофиза (см. рис. 4-4). Затем КОГ секретируется непосредственно в кровь. Проходя по системе кровеносных сосудов к передней доле гипофиза, КОГ стимулирует высвобождение АКТГ, β-эндорфина и их поступление в общую гемоциркуляцию (см. рис. 4-5) [41, 42]. АКТГ, циркулируя в крови, воздействует на рецепторы клеточной мембраны в фасцикулярной и в ретикулярной зонах коры надпочечников, активируя аденилатциклазу. Повышение внутриклеточного содержания аденозинмонофосфата (АМФ) непосредственно приводит к усилению синтеза и секреции кортизола и альдостерона [43].
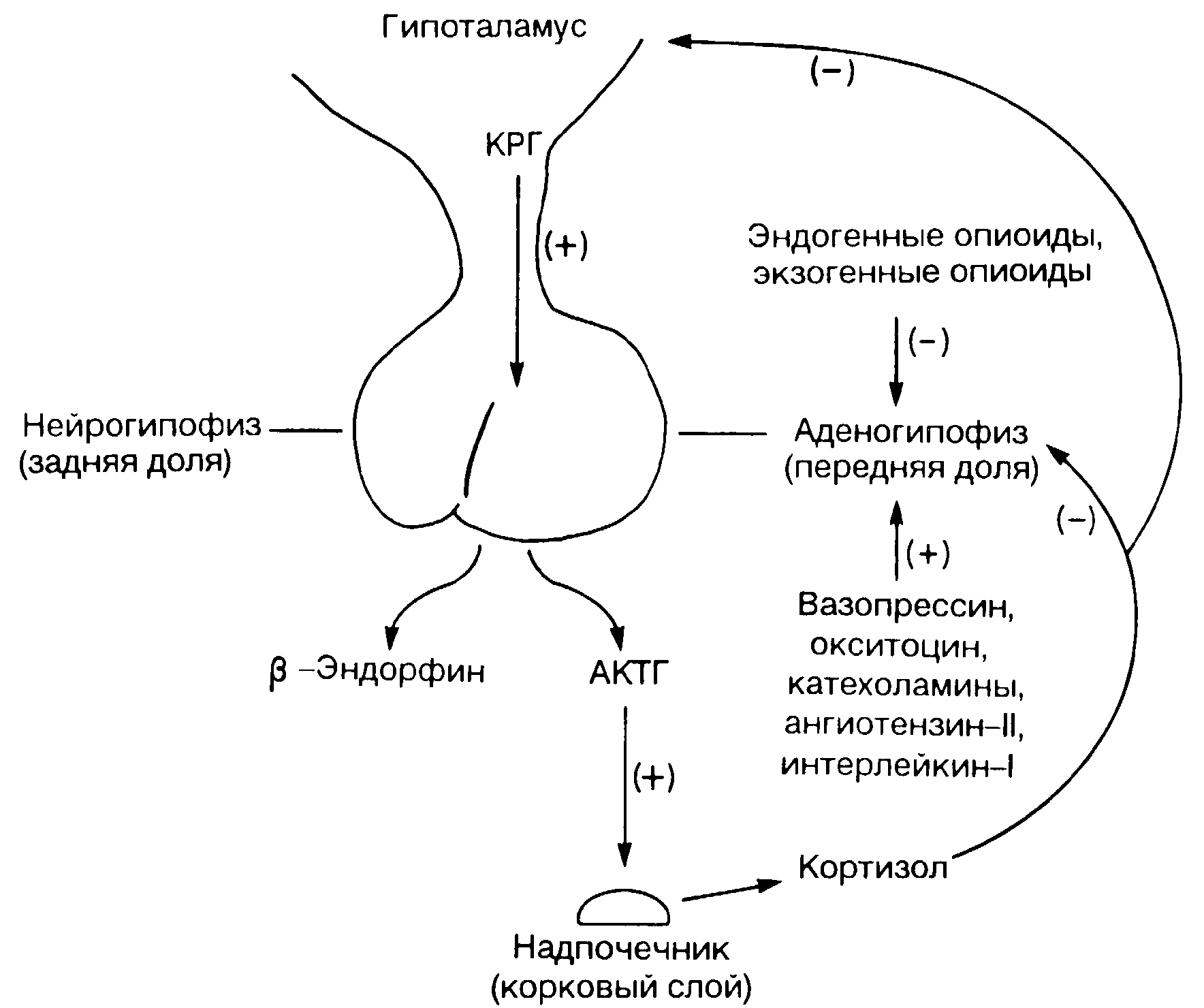
Рис. 4-5. Ось гипоталамус гипофиз-надпочечники (ГГН).
Знак (—) относится к угнетению отрицательной обратной связи различными субстанциями. Знак (+) означает стимуляцию секреции.
Глюкокортикоиды типа кортизола непосредственно тормозят синтез и выделение как АКТГ, так и КРГ [43-45]. Одновременно они усиливают синтез катехоламинов в мозговом слое надпочечников [9].
Недавние исследования подтвердили значительное распространение КРГ в головном и в спинном мозге, а также в надпочечниках [46]. Таким образом, КРГ действует и как нейротрансмиттер, а не только играет ведущую роль в системе ГГН (см. рис. 4-5).
Внутримозговое введение КРГ стимулирует активность симпатической нервной системы и адреномедуллярных формирований, вызывая реакции, которые не отличаются от таковых при стрессе, - повышение артериального давления, учащение пульса, увеличение содержания норадреналина и адреналина в плазме [47]. Повышение артериального давления и учащение пульса, индуцированные КРГ, наблюдаются даже у гипофизэктомированных животных, следовательно, подобные сдвиги не зависят от влияния этого гормона на гипофиз. Таким образом, вызываемые КРГ изменения функции автономной нервной системы следует объяснять воздействием гормона на нервные центры [41].
КРГ, кроме того, обладает истинным анальгетическим и противовоспалительным действием, местом приложения которого являются периферические нервы и лимфоциты. Локальные инъекции КРГ в воспаленную лапку животного снимают гипералгезию именно в силу своего периферического действия [48]. Аналгезия и снижение процессов экссудации плазмы наступают и после обычного парентерального введения КРГ благодаря противовоспалительному действию гормона на нервные окончания [49].
Подчеркивая важность КРГ, не следует забывать, что выделение АКТГ регулируется и многими другими гормонами. Катехоламины, многие пептиды, в том числе вазопрессин, окситоцин, ангиотензин-II, стимулируют высвобождение АКТГ [2, 17, 35, 42, 44]. В частности, вазопрессин стимулирует выделение АКТГ как непосредственно, воздействуя на клетки передней доли гипофиза, так и опосредованно, потенцируя активность КРГ [17, 20, 44, 50].
Подобно тому, как КРГ не один регулирует секрецию АКТГ, так синтез и выделение этого гормона не происходят изолированно. АКТГ и β-эндорфин являются производными одного вещества - проопимеланокортина (ПОМК) [51-54]. Это вещество подвергается серии протеолитических расщеплений и модификаций в кортикотрофах передней доли гипофиза, трансформируясь при этом в АКТГ и в β-липотропин [55]. Последний в свою очередь при расщеплении образует другие вещества, в том числе и β-эндорфин. Эндогенные опиоидные пептиды, как и экзогенные опиоиды, угнетают секрецию гонадотропина и оказывают двухфазное влияние на секрецию других гипофизарных гормонов, например вазопрессина [37], гормона роста и пролактина. Помимо центрального аналгезирующего действия, эндогенные опиоиды, попавшие в общую циркуляцию, оказывают обезболивающее и противовоспалительное действие на периферии в местах повреждения тканей [56, 57]. Это действие согласуется с иммунологическими аспектами стрессовых реакций (обсуждаются ниже). Поскольку секреция опоидных пептидов является одним из компонентов активации системы ГГН, то вполне закономерным представляется ингибирующее влияние на этот процесс экзогенных опиоидов [42, 43, 58]. Поэтому снижение реакции в системе ГГН на фоне введения опиоидов не обязательно означает адекватное обезболивание.
Повышение содержания в крови гормона роста и пролактина было отмечано во время операции и в послеоперационном периоде [9, 59]. Секреция первого регулируется многими гормонами, в том числе АКТГ. вазопрессином, кортизолом, катехоламинами. Медиаторы типа простагландинов (простагландин E2) стимулируют высвобождение гормона роста (ГР), активируя рецепторы гормонов, усиливающих его секрецию. Пролактин и ГР обладают выраженным сходством и одинаково влияют на метаболизм и иммунитет (мобилизация липидов и непереносимость углеводов) [60]. Место специфического связывания пролактина было обнаружено на лимфоцитах и лейкоцитах, синтезирующих ГР [6]. Как правило, опиоиды снижают уровень ГР, повышающийся во время операции. Но в то же время опиоиды, назначенные до развития стрессовых реакций, способствуют кратковременному увеличению уровня этих гормонов в плазме.
Ограниченные и иногда противоречивые сведения опубликованы по поводу нарушения функции тиреоидных гормонов и их динамики во время стресса. Секреция тиреоидстимулирующего гормона гипофиза снижается, содержание в плазме активных форм тиреоидного гормона (трийодтиронин, тироксин) также уменьшается. Одновременно нарастает содержание неактивных форм, например реверсированного Т3 [59]. Нормализация этих сдвигов наступает спустя 1 нед после травмы или операции [24, 52].
Суммируя приведенные выше сведения, следует отметить, что нейро-эндокринные реакции сопровождаются высвобождением трофических гормонов гипоталамусом. Они стимулируют выделение гипофизом АКТГ, β-эндорфина, гормона роста и пролактина [9, 10, 62]. Секреция других гормонов, например гонадотропина и тиреоидстимулирующего гормона, при стрессе подавляется. Вазопрессин выделяется задней долей гипофиза под контролем гипоталамуса. Уровень катаболических гормонов в крови нарастает. Это относится к катехоламинам, кортизолу, глюкагону. В то же время содержание анаболических гормонов, в частности инсулина, снижается [63, 64].
МЕТАБОЛИЧЕСКИЕ РЕАКЦИИ НА ОПЕРАЦИЮ ИЛИ ТРАВМУ
Более 50 лет назад Guthbertson обнаружил нарушения обмена, вызванные костными и иными повреждениями. Он выделил две фазы этих нарушений: фазу «отлива» и фазу «прилива» (табл. 4-3) [24, 65, 66]. Первая (фаза «отлива») отражает снижение метаболических процессов. Они опускаются ниже уровня, ожидаемого по расходу потребляемой энергии. Фаза «прилива» характеризуется относительно низким потреблением кислорода и ослабленной способностью к продукции тепла. Длительность этой фазы зависит от многих факторов, например от тяжести повреждения и от проводимого лечения, но обычно она длится не более суток. Содержание катехоламинов, кортизола, глюкагона и гормона роста в плазме обычно повышено, а концентрация инсулина снижена по сравнению с соответствующим уровнем глюкозы.
Таблица 4-3. Фаза «прилива» и «отлива» при стрессовых реакциях
Фаза «отлива» (шокоподобная) |
Фаза «прилива»
|
Развивается рано (первые 24 ч) Усиление или ослабление сердечного выброса Снижение потребления кислорода Спазм сосудов (в основном α-зффект) Уменьшение мочеотделения Состояние гипометаболизма Снижение температуры тела Снижение уровня инсулина |
Развивается поздно (2 -5-й день) Усиление сердечного выброса Усиление потребления кислорода Усиление регионального кровотока (в основном β-эффект) Состояние гиперметаболизма Повышение температуры тела Повышение катаболизма белков Усиление окисления жирных кислот Непереносимость глюкозы Усиление глюконеогенеза Усиление гликогенолиза |
Фаза «прилива» сменяется фазой «отлива», в которой преобладают процессы катаболизма. Ускоряются показатели обмена, повышаются температура тела, потребление кислорода, ускоряется пульс, увеличивается выделение азота с мочой, растут и другие показатели усиленного распада белков (например, 3-метилгистидин, цинк, креатинин) [67]. Продолжительность и интенсивность этой фазы преобладания процессов катаболизма варьируют в зависимости от природы поражения и его тяжести.
Обмен глюкозы
После тяжелых травм нарушается нормальная регуляция процессов как поглощения, так и высвобождения глюкозы. В этом участвуют несколько механизмов. Гипергликемия после операции отражает недостаточность процессов двойной обратной связи, когда повышенная концентрация глюкозы в крови должна тормозить ее образование в печени и усиливать потребление на периферии [66, 68]. Стимуляция глюконеогенеза в печени отражает усиленное поступление следующих субстратов: аминокислот типа аланина из скелетных мышц [68], глицерола, образующегося при липолизе жировой ткани, и лактата, появляющегося в ишемизированных участках тканей и в очагах воспаления [66-69].
В обычных условиях увеличение уровня глюкозы в крови стимулирует выделение инсулина. Под действием этого гормона усиливаются периферический клиренс глюкозы, ее потребление мышцами и жировой тканью. Непосредственно после травмы высокий уровень катехоламинов в крови подавляет секрецию инсулина поджелудочной железой. Лишь в последующем концентрация инсулина в плазме значительно возрастает, даже выше уровня, соответствующего содержанию глюкозы [63]. Замедленный подъем уровня инсулина в крови отражает, во-первых, прекращение сдерживающего адренергического влияния на его секрецию и, во-вторых, стимуляцию его высвобождения аминокислотами, в частности аргинином, мощным ускорителем инсулиновой секреции [24, 70]. Несмотря на повышение концентрации инсулина, его анаболическое действие ослабевает («инсулиновая резистентность»). Таким образом, в послеоперационном периоде повышается продукция глюкозы, истощаются ее запасы, мобилизуются жиры и нарастают процессы окисления. Обычно выраженное анаболическое действие инсулина на обмен белков не выявляется. Исследования по изолированному и по одновременному введению адреналина, кортизола и глюкагона подтвердили, что эти три гормона обладают синергизмом в отношении усиливающего и поддерживающего действия на продукцию глюкозы в печени. Они усиливают образование глюкозы и снижают ее клиренс [24]. В начальном периоде после их введения, как и сразу после травмы, повышается содержание инсулина в крови, но оно бывает недостаточным и остается ниже соответствующего уровня глюкозы [24, 66, 70].
